Содержание
Белка – описание, виды, чем питаются, где обитают белки
Белка (лат. Sciurus) – млекопитающее из отряда грызунов, семейства беличьих.
Описание белки
Обычная белка имеет длинное тело, пушистый хвост и длинные ушки. Уши белки крупные и вытянутые, иногда с кисточками на конце. Лапки сильные, с крепкими и острыми когтями. Благодаря сильным лапам грызуны так легко лазят по деревьям.
Взрослая белка имеет большой хвост, который составляет 2/3 всего тела и служит ей «рулем» в полетах. Она ловит им потоки воздуха и балансирует. Также хвостом белки укрываются, когда спят. При выборе партнера одним из главных критериев является именно хвост. Эти зверьки очень внимательны к данной части своего тела, именно хвост белки является показателем ее здоровья. Размеры средней белки составляют 20-31 см. Гигантские белки имеют размер около 50 см, при этом длина хвоста равна длине тела. Самая маленькая белка, мышиная, имеет длину тела всего 6-7,5 см.
Окрас белки
Шубка белки зимой и летом разная, так как этот зверек линяет два раза в год. Зимой меховой покров пушистый и плотный, а летом короткий и более редкий. Окрас белки неодинаковый, он бывает темно-бурый, почти черный, рыжий и серого цвета с белым животиком. Летом белки в основном рыжие, а зимой шубка приобретает голубовато-серый цвет.
Зимой меховой покров пушистый и плотный, а летом короткий и более редкий. Окрас белки неодинаковый, он бывает темно-бурый, почти черный, рыжий и серого цвета с белым животиком. Летом белки в основном рыжие, а зимой шубка приобретает голубовато-серый цвет.
Красные белки имеют коричневый или оливково-красный мех. Летом по бокам у них появляется черная продольная полоска, разделяющая живот и спину. На животике и вокруг глаз мех светлый.
У белок летяг по бокам тела, между запястьями и лодыжками имеется кожная перепонка, позволяющая им планировать.
Карликовые белки обладают серым или коричневым мехом на спинке и светлым на брюшке.
Виды белок
Семейство беличьих включает в себя 48 родов, которые состоят из 280 видов. Ниже приведены некоторые представители семейства:
- Белка Аберта;
- Персидская или кавказская белка;
- Огненная белка;
- Обыкновенная летяга;
- Белая белка;
- Черная белка;
- Японская белка;
- Мышиная белка;
- Индийская гигантская белка;
- Обыкновенная белка или векша – единственный представитель рода белок на территории России.

Самая маленькая – это мышиная белка. Ее длина составляет всего 6-7,5 см, при этом длина хвоста достигает 5 см.
Где обитает белка
Белка - животное, которое обитает на всех континентах, кроме Австралии, Мадагаскара, полярных территорий, юга Южной Америки и северо-западной Африки. Белки обитают в Европе от Ирландии до Скандинавии, на большей части стран СНГ, в Малой Азии, частично в Сирии и Иране, в Северном Китае. Также эти зверьки населяют Северную и Южную Америку, острова Тринидад и Тобаго.
Белка живет в различных лесах: от северных до тропических. Большую часть жизни проводит на деревьях, превосходно лазая и прыгая с ветки на ветку. Следы белки можно найти и возле водоемов. Также эти грызуны обитают по соседству с человеком возле паханых земель и в парках.
Что едят белки
В основном, белка питается орехами, желудями, семенами хвойных деревьев: ели, сосны, кедра, лиственницы, пихты. Рацион белки включает в себя грибы и различные зерна. Кроме растительной пищи она может питаться различными жуками, лягушками, ящерицами, птенцами птиц. При неурожае и ранней весной белка ест почки на деревьях, лишайники, ягоды, кору молодых побегов, корневища и травянистые растения.
Рацион белки включает в себя грибы и различные зерна. Кроме растительной пищи она может питаться различными жуками, лягушками, ящерицами, птенцами птиц. При неурожае и ранней весной белка ест почки на деревьях, лишайники, ягоды, кору молодых побегов, корневища и травянистые растения.
Белка зимой. Как белка готовится к зиме
Когда белка готовится к зиме, она делает множество укрытий для своих запасов. Она собирает желуди, орехи и грибы, может прятать пищу в дуплах, норах или вырывать ямы самостоятельно. Многие зимние запасы белки разворовываются другими животными. А про некоторые тайники белки просто забывают. Зверёк помогает восстановлению леса после пожара и увеличивает численность новых деревьев. Именно из-за забывчивости белок спрятанные орехи и семена прорастают и образуют новые насаждения. Зимой белка не спит, приготовив запас пищи еще осенью. Во время морозов она сидит в своем дупле, находясь в полудреме. Если же мороз небольшой, белка проявляет активность: может разворовывать тайники мышей, бурундуков и кедровок, находя добычу даже под полутораметровым слоем снега.
Белка весной
Ранняя весна – самое неблагоприятное время для белок, так в этот период зверькам практически нечего есть. Запасенные семена начинают прорастать, а новые еще не появились. Поэтому белкам остается только питаться почками на деревьях и грызть кости погибших во время зимы животных. Белки, живущие рядом с человеком, часто навещают кормушки птиц в надежде найти там семечки и зерна. В весенний период белки начинают линять, происходит это в середине-конце марта, заканчивается линька в конце мая. Также весной у белок начинаются брачные игры.
Размножение белок
Партнера белка выбирает только на сезон спаривания, так как эти зверьки скорее одиночки. Эти грызуны очень плодовиты и могут приносить до трех пометов за сезон. Все зависит от ареала обитания, плотности популяции и количества пищи. Во время гона возле самки собираются от 3 до 6 самцов. Они агрессивно ведут себя с конкурентами, пугают противника урчанием, устраивают погони, бьют по веткам и дерутся. Когда победитель останется один, происходит оплодотворение. Самка белки строит отдельное гнездо для детенышей. Гнездо белки для будущего потомства больше и аккуратней жилища обычных белок. Стоит отметить, что она строит несколько таких гнезд для малышей. В случае опасности она переносит детенышей с места на место. Беременность белки длится от 35 до 38 дней. Детенышей может быть от 1 до 10.
Когда победитель останется один, происходит оплодотворение. Самка белки строит отдельное гнездо для детенышей. Гнездо белки для будущего потомства больше и аккуратней жилища обычных белок. Стоит отметить, что она строит несколько таких гнезд для малышей. В случае опасности она переносит детенышей с места на место. Беременность белки длится от 35 до 38 дней. Детенышей может быть от 1 до 10.
Рождаются бельчата без волосяного покрова, слепые и с весом в 8 грамм. Только через 2 недели потомство белок обрастает волосками, а видеть они начинают через месяц. До 50 дней бельчата кормятся молоком. Через 8-10 недель они покидают гнездо и отправляются в самостоятельную жизнь. Через год, а иногда и меньше, бельчата становятся половозрелыми белками. Приблизительно около 70-80% всей популяции белок состоит из молодняка.
Сколько живут белки?
Белка живет максимум до 12 лет, но только в неволе. В лесу этот грызун может дожить до 4 лет, и даже это будет большой редкостью. Врагами белок являются куницы, совы, соболи, лисы и кошки. Белки, живущие в лесу, часто погибают от голода, эпизоотии, клещей, блох и остальных паразитов, а также могут быть переносчиками разных болезней, в том числе и бешенства. Болезни белок сильно сокращают продолжительность их жизни.
Врагами белок являются куницы, совы, соболи, лисы и кошки. Белки, живущие в лесу, часто погибают от голода, эпизоотии, клещей, блох и остальных паразитов, а также могут быть переносчиками разных болезней, в том числе и бешенства. Болезни белок сильно сокращают продолжительность их жизни.
Белка в домашних условиях
Очень важно создать правильные условия для содержания белки. Белка – это активный грызун, поэтому нужно приобретать высокий вольер высотой около 1 метра, длиной и шириной около 0,5 метра. Домик белки следует поставить в тихое место, где отсутствуют сквозняки. В вольер нужно поместить гнездо либо скворечник, несколько веток, по которым белка будет прыгать, дощечки или полочки, на которых зверек будет сидеть.
Для хорошего самочувствия домашней белки, ее следует правильно кормить. Рацион белки должен включать сушеные или свежие грибы, желуди, фундук, кедровые орехи, различных насекомых. Также зверьку необходимы шишки с семенами, сережки ивы или осины, молодые листья березы. Ни в коем случае нельзя кормить это животное едой с вашего стола.
Ни в коем случае нельзя кормить это животное едой с вашего стола.
Помните, что домашняя белка – это все тот же грызун, поэтому ей необходимо давать мел или яичную скорлупу, чтобы избежать дефицита минеральных веществ.
Белку можно приучить кушать с рук. Так как этот зверек приспособлен прятать излишки пищи, она будет брать у вас столько, сколько вы будете предлагать.
Считается, что белкам нельзя давать арахис, как в сыром, так и в жареном виде, также неполезны для них соленые семечки.
Интересные факты
- За недельный период белка может съесть пищу массой, равной массе собственного тела;
- Самец белки тратит больше времени на уход за своей шубкой, чем самка. Белка считается самым чистым грызуном;
- При падении с высоты до 30 метров белка не получит никаких повреждений. Это происходит благодаря строению тельца и большому хвосту, который служит ей как парашют.
Капская земляная белка
Систематика
Латинское название – Xerus inauris
Английское название – Cape ground squirrel или South African ground squirrel
Класс – Млекопитающие (Mammalia)
Отряд — Грызуны (Rodentia)
Семейство – Беличьи (Sciuridae)
Род — Африканские земляные белки (Xerus)
Статус вида в природе
Земляные белки не являются редкими животными. По международной классификации они относятся к категории животных, которым исчезновение в настоящее время не грозит — IUCN (LC).
По международной классификации они относятся к категории животных, которым исчезновение в настоящее время не грозит — IUCN (LC).
Вид и человек
Земляные белки могут заметно вредить посевам земляного ореха, посадкам сладкого картофеля и других корнеплодов. Ради меха люди на них не охотятся. Во многих местах их держат в качестве домашних питомцев.
Распространение и места обитания
Капские земляные белки обитают в южной и юго-западной части Африки, за исключением прибрежных территорий. Их распространение шире, чем Капская провинция, возможно, их назвали так для того, чтобы отличать от древесной белки, завезённой из Европы во второй половине 19 века и найденной в окрестностях Кейптауна.
Встречаются земляные белки в саваннах, светлых лесах, полупустынях и пустынях. Предпочитают участки с плотной почвой, но могут поселиться на пойменных лугах и сельскохозяйственных угодьях.
Внешний вид и особенности морфологии
Внешне земляная белка напоминает обыкновенную — небольшой симпатичный зверёк с пушистым хвостом. Длина тела этого грызуна 22-26 см, хвоста — около 25 см, вес от 420 до 600 г. Половой диморфизм очень незначительный — самцы чуть крупнее и весят на 8-10 % больше самок.
Шерсть короткая, жесткая, без подшерстка, при этом кожа у зверька черная. Окраска шерсти на спине светло-коричневая; щёки, нижняя сторона шеи, живот и внутренние стороны конечностей светлые. По бокам тела с каждой стороны от плеча до бедра тянется белая полоска. Глаза довольно большие, и вокруг них идут белые линии. Ушки очень короткие. Шерсть на хвосте длинная, но не густая, у основания хвоста с каждой стороны есть черные полоски.
Образ жизни и социальное поведение
Обычно зверьки активны в течение дня, ночь проводят в норах. От дневной жары также часто спасаются под землёй. Есть у них и своеобразный зонтик от солнца — пушистый хвост. Кроме того, такая гигиеническая процедура, как купание в песке, по-видимому, также хорошо охлаждает.
Есть у них и своеобразный зонтик от солнца — пушистый хвост. Кроме того, такая гигиеническая процедура, как купание в песке, по-видимому, также хорошо охлаждает.
Земляные белки хорошие землекопы, и их нора может располагаться на площади до 700 кв. метров. В ней множество ходов, камер и отнорков. В такой норе может быть до 100 входов-выходов. Белки часто используют одну нору совместно с сурикатами или желтыми мангустами, причем отношения с сурикатами у них равноправные, а с мангустами носят симбиотический характер.
Капские земляные белки социальные животные. Существуют самочьи и самцовые группы. Первые состоят из 2-3 взрослых самок с подростками (максимум 9 особей) обоего пола, а также детёнышей, ещё зависящих от матери. При большем количестве взрослых самок группа делится, образуя более мелкие. В самочьей группе отсутствует иерархия, все зверьки кормятся и спят там, где предпочтут сами.
Участок такой группы составляет порядка 4 га, причем пространство вокруг норы («ядро» участка) всего 0,25 га. Участки обитания соседних групп могут перекрываться, тогда как «ядро» члены группы, в первую очередь, взрослые самки, активно защищают от пришельцев. Иногда в пылу преследования взрослая самка может оказаться на чужом участке, тогда она сама становится объектом преследования со стороны хозяев.
Участки обитания соседних групп могут перекрываться, тогда как «ядро» члены группы, в первую очередь, взрослые самки, активно защищают от пришельцев. Иногда в пылу преследования взрослая самка может оказаться на чужом участке, тогда она сама становится объектом преследования со стороны хозяев.
Взрослые самцы живут отдельно от самок и присоединяются к ним только тогда, когда самки готовы к спариванию. Самцовые группировки могут насчитывать до 19 особей разного возраста, отношения между ними достаточно мирные, однако устанавливается линейная иерархия. Особи, занимающие доминирующее положение, всегда старше 3 лет. Внутри группы исследователи отмечают альянсы, состоящие из 4-5 самцов, состав которых меняется день ото дня. Самцовые группировки открыты для новых членов и не занимают четко определённой территории. Обычно они живут и свободно перемещаются по нескольким самочьим участкам, в среднем 12,1 га. Участки не защищают и ночуют в свободных норах, не занятых самками.
Питание и кормовое поведение
Питание этих грызунов разнообразно. Они едят и растительную, и животную пищу: траву, семена и плоды различных растений, корневища и луковицы, насекомых, яйца птиц. Зверьки добывают себе пищу ежедневно и не запасают её. Обычно они не пьют, а всю воду получают из своей еды.
Исследователи подсчитали, что 70% времени своей активности белки кормятся, 15-20% — осматриваются и около 10% времени проходит в общении друг с другом.
Вокализация
Звуковой репертуар довольно разнообразен. При опасности зверьки издают резкий свист, причем он бывает разным. Короткий и пронзительный, сигнализирует о большой опасности, а звук, издаваемый на средних частотах — о меньшей опасности. Во время агонистических взаимодействий белки издают низкое рычание. Молодые животные звуковыми сигналами приглашают к играм, щебечут в гнёздах и протестующе пищат.
Размножение и родительское поведение
Размножаться земляные белки могут круглогодично. Но происходит это один раз в год. Спаривание чаще наблюдается в сухие зимние месяцы. В это время самец может находиться рядом с самкой и её предыдущим потомством в течение нескольких недель. В этот период часты миролюбивые взаимодействия, в том числе, груминг. Взрослый самец может быть объектом социальных чисток, инициированных самками или подростками. Бывает так, что самка спаривается с несколькими самцами. Между самцами не бывает жесткой конкуренции за самок.
Но происходит это один раз в год. Спаривание чаще наблюдается в сухие зимние месяцы. В это время самец может находиться рядом с самкой и её предыдущим потомством в течение нескольких недель. В этот период часты миролюбивые взаимодействия, в том числе, груминг. Взрослый самец может быть объектом социальных чисток, инициированных самками или подростками. Бывает так, что самка спаривается с несколькими самцами. Между самцами не бывает жесткой конкуренции за самок.
Беременность длится около 48 дней, при этом все взрослые самки группы рождают детёнышей практически одновременно (в течение нескольких дней). В каждом помете бывает 1-3 щенка, беспомощных, слепых и без шерсти. В этот период полувзрослые (годовалые) зверьки еще держатся вместе со взрослыми, но постепенно начинают расселяться. Взаимодействия между взрослыми и годовалыми особями остаются миролюбивыми, однако взрослые самки гораздо больше времени проводят с новыми выводками.
В норе детёныши находятся примерно 45 дней. Через неделю после выхода из норы они уже едят твёрдую пищу, а молочное кормление заканчивается примерно на 52 день. Самцы становятся половозрелыми в 8 месяцев, а самки — в 10.
Через неделю после выхода из норы они уже едят твёрдую пищу, а молочное кормление заканчивается примерно на 52 день. Самцы становятся половозрелыми в 8 месяцев, а самки — в 10.
Продолжительность жизни
Максимальная продолжительность жизни капской белки 11,5 лет.
История жизни в зоопарке
Группа земляных белок впервые появилась в нашем зоопарке весной 2020 года. Три зверька — самцы 2015 и 2017 годов рождения — прибыли к нам из в Магдебургского зоопарка (ФРГ). Их назвали Желток, Белок и Яйка — как маленьких динозавриков из мультфильма «Ледниковый период».
Животных поселили на Новой территории зоопарка, на Африканской экспозиции. Для того чтобы земляные белки чувствовали себя комфортно, специально оборудовали вольер с песком, в котором можно рыть норы, с полыми брёвнами, в которых можно прятаться. Кроме того, установили дополнительное освещение.
Как и в природе, зверьки постоянно настороже – вдруг хищная птица налетит, или зверь какой подкрадётся. Белки живут дружно – ссор между ними не происходит, но таких близких отношений, как у сурикат, между белками не наблюдается. Держатся они поодиночке, но спят вместе, в одном дупле – так теплее и спокойнее.
Белки живут дружно – ссор между ними не происходит, но таких близких отношений, как у сурикат, между белками не наблюдается. Держатся они поодиночке, но спят вместе, в одном дупле – так теплее и спокойнее.
Кормят зверьков разнообразно: в рационе фрукты, овощи, орехи, зерновые смеси. Особенно белки оживляются, когда им дают мучного червя, личинок зофобоса, или в вольер выпускают саранчу.
БЕЛКА ОБЫКНОВЕННАЯ Sciurus vulgaris | izi.TRAVEL
Класс — млекопитающие (Mammlia)
Отряд — грызуны (Rodentia)
Семейство — беличьи (Sciuridae)
Род — белки (Sciurus)
В роду 54 вида. Длина тела 20 — 32 см, длина хвоста 19 — 31 см. Вес от 180 до 1000 г.
Окраска разная в зависимости от вида, сезона, возраста. Обыкновенная белка может быть рыжей, пепельной, почти чёрной. Большинство видов рода не имеют кисточки на ушах. Они есть у обыкновенной белки и у северо-американской.
Белки распространены по всем лесам северной Азии и Европы; в Северной и Южной Америке, от Канады до Аргентины. Обыкновенная белка живет в лесах Крыма, Кавказа, Тянь-Шаня. Нет белок в Гренландии, Новой Зеландии, Новой Гвинее и на Мадагаскаре.
Обыкновенная белка живет в лесах Крыма, Кавказа, Тянь-Шаня. Нет белок в Гренландии, Новой Зеландии, Новой Гвинее и на Мадагаскаре.
Образ жизни преимущественно древесный. Белка — живой, подвижный зверёк. Она легко совершает прыжки с дерева на дерево (3-4 м по прямой и 10-15 м по нисходящей кривой), «руля» хвостом. В бесснежный период, а также во время гона значительное время проводит на земле, где перемещается скачками длиной до 1 м. В зимний период перемещается в основном «верхами». При опасности скрывается на деревьях, обычно затаиваясь в кроне. Активна в утренние и вечерние часы. Гнёзда устраивает в дуплах или ветвях деревьев. Оно имеет форму шара с боковым входом. В разгар зимы покидает гнездо только на время кормёжки, а в сильные морозы и непогоду прячется в гнезде, впадая в полудремотное состояние.
Питается: древесными семенами, ягодами, фруктами, орехами, грибами, почками и побегами, корой и лишайниками; насекомыми и другими мелкими беспозвоночными, яйцами птиц, ящериц и змей, птенцами и мелкими грызунами. Белки запасают корм на зиму в дуплах или под корнями деревьев.
Белки запасают корм на зиму в дуплах или под корнями деревьев.
Линяет два раза в году, но хвост линяет только один раз. Зимний мех сильно отличается от летнего.
Детёнышей приносит 2 раза в год (от 3 до 10 бельчат). Появляются они на свет слепыми и голыми, 6 недель они находятся в гнезде, питаясь молоком. Взрослыми становятся 10-12 месяцев.
Врагами белки являются совообразные, ятреб-тетеревятник, лесная куница в Европейской части России, соболь— в азиатской и харза на Дальнем Востоке. На земле их ловят лисы и кошки.
Исследование белка S100 (S100 protein), правила подготовки к сдаче анализа, расшифровка результатов и показатели нормы.
ВАЖНО!
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Напоминаем вам, что самостоятельная интерпретация результатов недопустима, приведенная ниже информация носит исключительно справочный характер.
Белок S100: показания к назначению, правила подготовки к сдаче анализа, расшифровка результатов и показатели нормы.
Показания для назначения исследования
Белок S100 представляет собой вещество (белок), которое присутствует во многих органах (в коже, печени, почках, сердце и др.). Его основная особенность заключается в способности связывать кальций и за счет этого влиять на многие процессы, происходящие в организме. Этот белок необходим для нормальной работы клеток органов и тканей, но самое большое содержание S100 выявлено в клетках головного мозга.
Уровень белка S100 в крови позволяет оценить степень повреждения мозга при инсульте, черепно-мозговой травме и других состояниях, приводящих к неврологическим заболеваниям. Концентрация белка S100 повышается при онкологических заболеваниях. Огромное значение имеет исследование уровня белка S100 для оценки и контроля лечения рака кожи.
Огромное значение имеет исследование уровня белка S100 для оценки и контроля лечения рака кожи.
Подготовка к процедуре
- Предпочтительно выдержать 4 часа после последнего приема пищи.
- Рекомендуется сдавать кровь утром, в период с 8 до 11 часов, накануне избегать пищевых перегрузок.
- Исключить прием алкоголя накануне исследования.
- Не курить минимально в течение 1 часа до исследования.
- Исключить физические и эмоциональные перегрузки накануне исследования.
- При исследовании концентрации белка S100 в динамике рекомендуется проводить повторные исследования в одной и той же лаборатории.
Срок исполнения
1 рабочий день, исключая день взятия биоматериала.
Что может повлиять на результаты
Обычно результат оказывается корректным, если соблюдены все правила подготовки к исследованию. Важно помнить, что физиологическое повышение уровня белка S100 фиксируется после интенсивных занятий спортом.
Белок S100
Для исследования берется кровь из вены.
Референсные значения
В норме концентрация белка S100 в крови менее 0,105 мкг/л. Интерпретация результата проводится с целью комплексной оценки состояния при различных заболеваниях головного мозга, прогноза и контроля лечения при онкологии, а также при воспалительных процессах, например, при ревматоидном артрите.
Существуют несколько разных видов белка S100. Для указания вида белка S100 к названию прибавляют буквенно-цифровое обозначение, например, S100А1. Разные виды белка S100 характерны для различных органов. Определение конкретного вида белка S100 имеет значение в кардиологии, онкологии, при травмах и патологиях головного мозга.
В кардиологии повышенные концентрации таких видов как S100A1, S100A2 и S100A4 позволяют судить об остром повреждении клеток сердца (инфаркте миокарда) и инфекционном эндокардите (поражении сердца, особенно его клапанов, различными бактериями). Уровень S100 используют в дополнение к «классическим» биомаркерам: креатинкиназе (СК), креатинкиназе-МВ (СК-МВ) и тропонину-I.
Уровень S100 используют в дополнение к «классическим» биомаркерам: креатинкиназе (СК), креатинкиназе-МВ (СК-МВ) и тропонину-I.
Исследование группы белков S100 является ценным у пациентов с воспалительными заболеваниями и аллергией. При остром воспалении, как правило, повышаются уровни S100A8, S100A9 и / или S100A12. Эти белки считаются неспецифическими маркерами активации фагоцитов (клеток, уничтожающих бактерии и вирусы), поэтому определение значений S100A8 / A9 и S100A12 с другими маркерами того или иного заболевания повышает диагностическую точность. В таблице представлена связь белка S100 с некоторыми заболеваниями.
|
Показатель (белок S100) |
Болезни, при которых S100 играет роль дополнительного биомаркера воспаления и аллергии |
|
S100В |
Витилиго (нарушение пигментации кожи) |
|
S100А4 |
Связь между воспалением и прогрессированием опухоли Аллергия Сезонный аллергический ринит (аллергический насморк) |
|
S100А7 |
Псориаз (воспалительное заболевание кожи) |
|
S100А8 |
Ревматоидный артрит (хроническое воспаление суставов) Болезнь Крона (хроническое заболевание кишечника) Воспаление желудочно-кишечного тракта Воспалительные заболевания легких |
|
S100А12 |
Болезнь Кавасаки (повреждение мелких сосудов собственной иммунной системой) Воспаление сосудов и атеросклероз |
Представляемый Независимой лабораторией ИНВИТРО тест количественного определения S100 направлен на выявление таких видов белка как S100A1B и S100BB.
Обыкновенная белка
Обыкновенная белка — настолько обычна, что ее легко узнают большинство людей, хотя бы однажды увидевшие этого зверька в лесу. Длина тела белки 19—28 см, хвост 14—25 см более половины длины тела, а весит она 200—500 г. Задние конечности заметно длиннее передних. Окраска верха летом от рыжей до буро-коричневой, зимой — пепельно-серая с рыжиной на спине. Зимой на ушах длинные кисточки волос. Брюшко белое.
- Биотоп обитания. Различные типы лесов, парки.
- Чем питается. Семена хвойных, грибы, почки, желуди, орехи, насекомые, яйца птиц, птенцы, мыши.
- Экология вида. Активность дневная. Прекрасно лазает и прыгает по деревьям. Селится в дуплах. Чаще гнездо, называемое гайном, сооружает сама. На зиму делает запасы — сушит грибы, зарывает желуди, орехи. В году 1—2 выводка.
Белка — это типично лесной обитатель. Свободно передвигаясь по веткам, белка легко может перескакивать с дерева на дерево, идти «верхом», как говорят охотники. В то же время в поисках пищи и при длинных переходах часто спускается вниз. Ее следы постоянно попадаются в лесу не только зимой на снегу, но и летом на мокрых или пыльных тропинках. Узнать эти следы очень легко.
В то же время в поисках пищи и при длинных переходах часто спускается вниз. Ее следы постоянно попадаются в лесу не только зимой на снегу, но и летом на мокрых или пыльных тропинках. Узнать эти следы очень легко.
Нижняя поверхность передней (а) и задней (б) лапок белки зимой
Передняя лапка белки заметно мельче задней и имеет 4 довольно тонких пальца с недлинными (до 5 мм) когтями. На нижней поверхности лапки хорошо заметны выпуклые мозоли. Их можно увидеть на более четких отпечатках в виде 5 углублений. Задняя лапка крупнее и пятипалая, 1 -й (внутренний) палец заметно короче остальных. Зимой подошвы лапок сильнее обрастают шерстью. Размер отпечатка передней лапки около 4×2, задней 6×3,5 см.
По земле или по мелкому снегу белка передвигается легкими скачками, будто играет в чехарду. Обопрется на короткие передние лапки, оттолкнется задними и выносит их, широко расставив, далеко вперед. Так что отпечатки более крупных задних лап на беличьих следах почти всегда оказываются впереди отпечатков передних лапок. При этом мыски задних лапок чуть повернуты наружу и расположены на одном уровне, будто остановились у невидимой черты.
При этом мыски задних лапок чуть повернуты наружу и расположены на одном уровне, будто остановились у невидимой черты.
Передние лапки зверек ставит близко друг к другу и тоже на одном уровне. Длина прыжков белки может быть весьма различна, в зависимости от скорости движения. При нормальном, неторопливом, ходе по земле или неглубокому снегу длина прыжков 66— 86 см. Длина группы отпечатков примерно 12 см, ширина следовой дорожки 11 см.
Следы прыжков белки на мелком снегу
По глубокому снегу белка скачет более короткими прыжками, длиной около 43 см. При этом все 4 отпечатка расположены значительно ближе друг к другу, и нередко отпечатки задних и передних ног сливаются. Ширина следовой дорожки в этом случае уменьшается до 8 см. И только на самых коротких прыжках, когда зверек что-то ищет в лесной подстилке или осторожно подскакивает к луже, чтобы напиться, отпечатки передних лап на следах могут оказаться чуть выше отпечатков задних.
Научившись безошибочно узнавать беличьи следы, нетрудно отыскать по ним и другие следы деятельности белок. Прежде всего, это погрызенные шишки хвойных деревьев, чьи семена служат основным зимним кормом для большинства белок. Грызть шишки зверьки начинают рано, еще летом. Взгляните в конце лета под плодоносящие деревья, и увидите там много чешуек сосновых или еловых шишек, которые еще не полностью созрели и имеют зеленоватый цвет.
Прежде всего, это погрызенные шишки хвойных деревьев, чьи семена служат основным зимним кормом для большинства белок. Грызть шишки зверьки начинают рано, еще летом. Взгляните в конце лета под плодоносящие деревья, и увидите там много чешуек сосновых или еловых шишек, которые еще не полностью созрели и имеют зеленоватый цвет.
В России белка распространена по всей лесной зоне, от западных границ до восточных окраин. Поэтому в зависимости от района наблюдения и от урожая на те или иные семена хвойных пород мы можем встретить погрызенные белкой шишки самых различных деревьев. Это и разные виды елей и сосен, это пихта, лиственница и кедр, а на юге, у Черного моря, кипарис. И всегда, независимо от того, семенами какого дерева питалась белка, погрызенные ею шишки легко отличить от шишек, обработанных другими потребителями хвойных семян — клестами, дятлами, кедровками, мышевидными грызунами.
Добравшись до семечек, белка начинает откусывать чешуйку за чешуйкой, срезая их острыми зубами у самого основания. В конце концов, остается лишь голый стержень шишки с небольшим пучком мелких чешуек на самом конце, где семян уже нет. По осени, когда снега еще нет или он неглубок, зверек часто обгрызает шишки, сидя на земле или пеньке. После такой трапезы стержень и обгрызенные чешуйки остаются на месте в виде маленькой компактной кучки. С выпадением глубокого снег белка кормится на деревьях, и тогда под елкой или сосной, где она долго жировала, мы находим вразброс валяющиеся стержни использованных шишек и целые россыпи чешуек.
В конце концов, остается лишь голый стержень шишки с небольшим пучком мелких чешуек на самом конце, где семян уже нет. По осени, когда снега еще нет или он неглубок, зверек часто обгрызает шишки, сидя на земле или пеньке. После такой трапезы стержень и обгрызенные чешуйки остаются на месте в виде маленькой компактной кучки. С выпадением глубокого снег белка кормится на деревьях, и тогда под елкой или сосной, где она долго жировала, мы находим вразброс валяющиеся стержни использованных шишек и целые россыпи чешуек.
Погрызенные белкой шишки: а — ели; б — лиственницы; в — сосны; г — сибирского кедра
Обычно на местах кормежки различных животных остается много помета. Белка в этом отношении не похожа на других, и даже в тех местах, где она кормится постоянно, увидеть ее помет, небольшие темные неровные шарики около 3—4 мм в диаметре, трудно.
Другие характерные следы кормежки белок можно обнаружить в начале зимы под кустами лещины. Если урожай лесных орехов был хороший, мы почти всегда наткнемся на целый ряд покопок, сделанных зверьком, разыскивавшим опавшие орехи.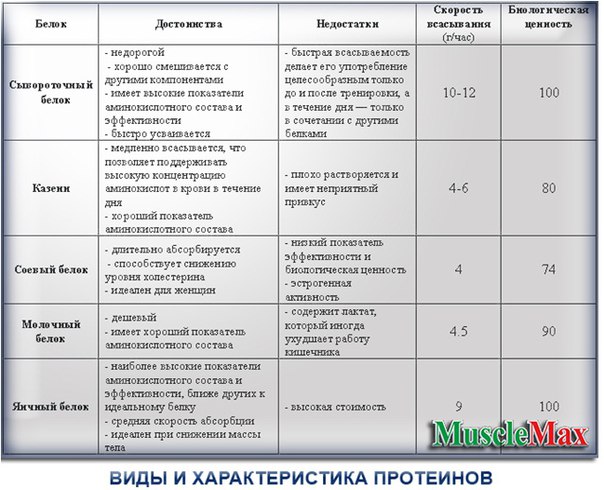 Увидим разрытый до земли снег, темнеющие на дне ямки сухие листья и мох. Если нырок белки в снег был удачным, то на краю воронок мы заметим скорлупки неровно расколотого надвое ореха. Здесь же можно набрести на покопки пернатых любителей орехов — кедровок и соек. Свежие следы лап нам безошибочно покажут, кто из лесных жителей искал орехи. Но даже если никаких отпечатков лап возле лунок не видно, можно узнать, кому принадлежит покопка, по другим признакам. Белка, копая снег, подгребает его под себя.
Увидим разрытый до земли снег, темнеющие на дне ямки сухие листья и мох. Если нырок белки в снег был удачным, то на краю воронок мы заметим скорлупки неровно расколотого надвое ореха. Здесь же можно набрести на покопки пернатых любителей орехов — кедровок и соек. Свежие следы лап нам безошибочно покажут, кто из лесных жителей искал орехи. Но даже если никаких отпечатков лап возле лунок не видно, можно узнать, кому принадлежит покопка, по другим признакам. Белка, копая снег, подгребает его под себя.
Птица крепким клювом раскидывает снег вправо и влево от лунки. Докопавшись до дна, она выбрасывает на снег листья и мох. Если отыщет орех или желудь, то не станет расклевывать его тут же на месте, а унесет на крепкий сук или пень и там расколет ударами клюва. Так что скорлупки расколотого ореха возле покопки безошибочно указывают на то, что здесь кормилась белка. Так же белка разгрызает желуди. В неурожайные годы, когда шишек мало, зверьки голодают и вынуждены питаться еловыми почками. В такие зимы под елками скапливается большое количество коротких еловых веточек со скусанными почками, и после длительных оттепелей подножье крупных елок кажется прикрытым зеленым щетинистым ковром.
В такие зимы под елками скапливается большое количество коротких еловых веточек со скусанными почками, и после длительных оттепелей подножье крупных елок кажется прикрытым зеленым щетинистым ковром.
Известно, что осенью белки делают запасы желудей, орехов или сушат грибы, развесив их на ветках. Но как собирают и где прячут свой корм эти зверьки, проследить бывает трудно. Однажды тихим октябрьским утром я отдыхал, сидя на пеньке в подмосковном лесу. Вдруг зашуршали опавшие листья, и увидел приближавшуюся ко мне белку. В ее зубах, как большая сигара, была зажата за самый кончик еловая шишка. Раза три белка приостанавливалась и пыталась засунуть свою находку в сухую листву, но почти тут же меняла решение и скакала дальше. Наконец, под маленькой жидкой елочкой она удачно подсунула шишку под сухие дубовые листья, поочередными движениями передних лап сгребла листья с боков, совсем ее прикрыв, и ускакала.
Иногда на шляпках грибов находишь следы беличьих зубов. Эти покусы нетрудно отличить от повреждений, нанесенных зубами рыжих полевок, по ширине оставленных зубами бороздок. Правда, надо помнить, что по мере роста гриба вместе с ним растут и повреждения, нанесенные на его поверхность. Список видов грибов, употребляемых белками, довольно велик. В средней полосе мне чаще всего попадались покусанные белками трубчатые грибы — подосиновики, подберезовики, маслята.
Правда, надо помнить, что по мере роста гриба вместе с ним растут и повреждения, нанесенные на его поверхность. Список видов грибов, употребляемых белками, довольно велик. В средней полосе мне чаще всего попадались покусанные белками трубчатые грибы — подосиновики, подберезовики, маслята.
В других регионах белки могут отдавать предпочтение иным видам. Надо сказать, что в средней полосе, например в Подмосковье, эти зверьки запасают грибы нечасто, поэтому развешенные на ветках грибы я не всегда склонен относить к деятельности белок. Возможно, это шутки людей. Достоверно известно, что весной и в начале лета белки разыскивают гнезда мелких птиц, выпивают яйца и поедают птенцов. Однако следы такой деятельности попадаются очень редко.
В средней полосе в холодные зимние ночи и в особо морозные или метельные дни белки отсиживаются в устроенных из тонких веточек округлых гнездах — гайнах. Внутрь такого гнезда заранее натаскивают большое количество зеленого мха или липового мочала, поэтому даже в лютые холода в беличьем гнезде бывает довольно тепло и уютно. Иногда поселяясь вблизи человеческого жилья, зверьки выстилают гнезда необычным для них материалом — ватой, паклей или еще чем-нибудь, что отыщут на задворках.
Иногда поселяясь вблизи человеческого жилья, зверьки выстилают гнезда необычным для них материалом — ватой, паклей или еще чем-нибудь, что отыщут на задворках.
Однажды я увидел упавшее с елки гнездо, вся выстилка которого состояла из стекловаты. Уж не знаю, насколько уютно чувствовали себя бельчата на этой подстилке. Заметив в лесу липу, с сухих веточек которой содраны длинные полоски лыка, нетрудно догадаться, что где-то поблизости находится беличье гнездо.
Часто, особенно весной, белки используют для жилья различные дупла. Это могут быть трещины в стволах, выгнившие в древесине пустоты или старые дупла, выдолбленные крупными дятлами, величиной с большого пестрого дятла, не менее. Мне известна старая липа, склонившаяся над лесным оврагом, в большом и глубоком дупле которой несколько лет подряд то гнездились лесные голуби клинтухи, то селились белки. Неизвестно, сколько поколений голубей и белок выросло в этом дупле, прежде чем старое дерево сломало бурей. Случается, что иногда зверьки поселяются где-нибудь на чердаке примыкающей к лесу дачи или другой постройки в лесу.
У белки много врагов. Это беркут, большой подорлик, кречет, сарыч. Однако на практике увидеть гибель зверьков от хищника или найти останки белок на месте трапезы хищника удается редко. За многие годы я отыскал место гибели белки от лисицы. На льду речной речушки возле лисьих следов я увидел кровавые пятна и случайно оставшийся кусочек беличьей губы. Там же, в Костромской обл., поздней осенью видел белку в зубах крупного домашнего кота, перебиравшегося через ручей по стволу сваленной елки. Находил останки погибших от куниц белок, в их гнездах. Беличьи кости и шерсть обнаруживал в погадках бородатых неясытей. А вот гибель белок от ястреба-тетеревятника я отмечал не менее 10 раз.
Смесь Nestle Alfare для детей с аллергией на коровий белок 400г
Alfaré (Алфаре) — специализированная смесь на основе высокогидролизованного белка молочной сыворотки для лечения аллергии на белок коровьего молока (АБКМ) у детей с симптомами расстройства ЖКТ или поливалентной пищевой аллергии. Сухая смесь применяется в рамках диетотерапии при различных формах нарушения переваривания и всасывания пищи, сопровождающихся нарушениями со стороны желудочно-кишечного тракта, включая аллергию к белку коровьего молока, хроническую диарею и мальабсорбцию, и может использоваться с рождения.
Сухая смесь применяется в рамках диетотерапии при различных формах нарушения переваривания и всасывания пищи, сопровождающихся нарушениями со стороны желудочно-кишечного тракта, включая аллергию к белку коровьего молока, хроническую диарею и мальабсорбцию, и может использоваться с рождения.
- Продукт отличается чрезвычайно низким аллергическим потенциалом и содержит все питательные вещества, необходимые для нормального роста и развития детей с пищевой непереносимостью, мальабсорбцией и повреждением слизистой кишечника.
- Продукт не содержит лактозу и сахарозу и легко переваривается даже у грудных детей с тяжелым поражением слизистой.
- Смесь Alfaré также обладает противовоспалительным действием за счет добавки жирных кислот.
- В продукте увеличено содержание многих макро- и микронутриентов по сравнению с обычными детскими смесями, за счет чего смесь способствует коррекции недостаточности питания, восстановлению темпов роста и регенерации тканей.
Состав: Мальтодекстрин, ферментативно гидролизованный белок молочной сыворотки, растительные масла (пальмовый олеин, подсолнечное масло, низкоэруковое рапсовое масло, масло семян черной смородины), среднецепочечные триглицериды, картофельный крахмал, минеральные вещества (кальция глицерофосфат, магния хлорид, натрия хлорид, калия фосфат, калия хлорид, кальция фосфат, железа сульфат, цинка сульфат, меди сульфат, калия йодид, кальция хлорид, марганца сульфат), эмульгатор (Е472с), витамины (С, Е, ниацин, пантотеновая кислота, В2, А, В6, В1, D3, К1, фолиевая кислота, В12, биотин), рыбий жир, таурин, холин битартрат, мио-инозитол, нуклеотиды, (Цитидинмонофосфат, Уридинмонофосфат, Аденозинмонофосфат, Гуанозинмонофосфат), L — картинин.
различных видов белка | Какие типы белка лучше всего подходят для бегунов?
- Бегуны должны получать достаточное количество белка для восстановления мышц и правильного функционирования клеток.
- Существует множество различных типов источников белка — некоторые из них животного происхождения, а другие — растительного происхождения.
- В вашем рационе должны быть разнообразные источники белка, чтобы максимально использовать все имеющиеся питательные вещества.
Как бегуны (и, как вы знаете, люди), нам нужны определенные основные питательные вещества, чтобы наш организм мог функционировать наилучшим образом.Одним из самых важных и известных является белок. Но с годами, по мере того как становится доступным все больше продуктов и продуктов, содержащих белок, путаница в отношении различных типов белка растет.
Чтобы помочь нам избавиться от беспорядка, мы обратились к Келли Хоган, MS, RD, зарегистрированному диетологу из Нью-Йорка, и Лесли Бончи, RD, спортивному диетологу в Pittsburgh Active Eating Advice, чтобы объяснить все от что такое белок, какие типы должны быть основными в вашем рационе, а какие вы, возможно, захотите использовать в умеренных количествах.
Что такое белок и зачем он нам нужен?
Белок является одним из трех основных макроэлементов, два других — это жир и углевод. Макронутриенты — это виды пищи, которые нам нужны в больших количествах, чтобы оставаться в живых. «С спортивной точки зрения [белок] важен для восстановления мышц и наращивания мышечной массы после тяжелых пробежек и тренировок», — говорит Хоган.
Хотя белок действительно важен для ваших спортивных результатов, он также необходим и для других функций организма.Например, он помогает вам чувствовать себя сытым и помогает восстановить все ваши клетки, добавляет Хоган.
Спортсменам, таким как мы, требуется больше белка, чем обычному человеку, из-за дополнительной нагрузки, которую мы подвергаем нашим мышцам во время таких тренировок, как длинные пробежки, скоростная работа и силовые тренировки. Хоган рекомендует бегунам получать от 1,3 до 2 граммов белка на килограмм массы тела в день, в то время как не бегунам достаточно от 0,8 до 1 грамма белка на килограмм массы тела в день. (Международная ассоциация легкоатлетических федераций даже рекомендует потреблять до 2,4 грамма белка на килограмм веса тела в день, если ваша цель — поддерживать мышечную массу.)
(Международная ассоциация легкоатлетических федераций даже рекомендует потреблять до 2,4 грамма белка на килограмм веса тела в день, если ваша цель — поддерживать мышечную массу.)
В фунтах это соответствует 0,6 граммам белка на фунт веса тела. до 1,1 грамма белка на фунт массы тела в день. Это будет где-то от 88 до 165 граммов для человека весом 150 фунтов.
«Вашему организму трудно использовать и усваивать более 20–25 граммов белка за раз, — говорит Хоган.Из-за этого она советует распределять потребление белка в течение дня с каждым приемом пищи или перекусом. «Остальное уходит в отходы или хранится в виде жира », — говорит она.
Этот контент импортирован из {embed-name}. Вы можете найти тот же контент в другом формате или найти дополнительную информацию на их веб-сайте.
Но какой тип белка лучше?
Существует так много различных вариантов протеина, что временами это может показаться ошеломляющим.Ниже Хоган рассказывает, какие источники являются лучшими, а какие вы, возможно, не хотите перегружать.
[Создайте убойный живот на кухне, чтобы без усилий преодолевать километры по дороге с Eat for Abs. ]
Цельнопищевой белок
Больше всего пользы организму приносит цельнопищевой источник белка, потому что в дополнение к белку вы также получаете витамины, минералы, жиры и углеводы, которые содержатся в этих продуктах. все это необходимо для поддержания вашего здоровья и повышения вашей производительности в качестве бегуна.Кроме того, чем менее обработана пища, тем легче наш организм ее переваривает.
По словам Хогана, суть игры в разнообразии. Это означает, что лучше всего смешивать источники белка, чтобы получать все различные питательные вещества, которые они содержат. Однако имейте в виду, что такие продукты, как бекон и красное мясо, лучше всего употреблять в умеренных количествах, а более постное мясо, такое как курица и индейка, является более здоровым вариантом.
Ниже перечислены популярные источники животного и растительного белка, а также указано, сколько граммов белка содержится в каждом из них. (Стоит отметить, что растительные источники почти всегда неполные, поэтому вам нужно добавить углеводы, чтобы сделать их полноценными. Например, рис и бобы образуют полноценный белок, а не только бобы.)
(Стоит отметить, что растительные источники почти всегда неполные, поэтому вам нужно добавить углеводы, чтобы сделать их полноценными. Например, рис и бобы образуют полноценный белок, а не только бобы.)
Протеиновые порошки
Белковые порошки можно и нужно использовать для удобства, говорит Хоган. Например, протеиновый коктейль после пробежки, выпитый в течение 30 минут после окончания тренировки, может быть полезен, если вы находитесь в пути и нуждаетесь в быстром и легком приеме протеина.Тем не менее, порошки — это не то, на что вы должны полагаться несколько раз в день, поскольку они обработаны, и ваше тело более эффективно использует питательные вещества в их наиболее естественных формах.
Существует множество различных типов порошков, но вы должны использовать только те, которые содержат все девять незаменимых аминокислот, которые способствуют синтезу мышечного белка или процессу наращивания мышечной массы. Белковые порошки обычно отдают предпочтение одному из двух производных молока: сыворотке или казеину. Или они могут быть составлены с растительным источником аминокислот, таким как соя или арахис.
Или они могут быть составлены с растительным источником аминокислот, таким как соя или арахис.
Однако протеиновые порошки на растительной основе также, как правило, имеют некоторые сильные ароматы, которые часто маскируются искусственными или натуральными подсластителями. Если вы пытаетесь ограничить потребление сахара или подсластителя, внимательно прочитайте информацию об ингредиентах и пищевой ценности, чтобы избежать «сахарных бомб».
Bonci предлагает искать протеиновые порошки, которые содержат все девять незаменимых аминокислот и достаточное количество BCAA. (Из девяти незаменимых аминокислот три являются аминокислотами с разветвленной цепью — лейцин, изолейцин и валин.) Сколько BCAA вам нужно, зависит от таких факторов, как вес, возраст, пол и тип упражнений, которые вы делаете, но, как правило, достаточно от 5 до 10 граммов в день.
Лейцин является наиболее важным, так как он больше всего помогает стимулировать синтез мышечного белка, но он не так сконцентрирован в порошках на растительной основе, о чем следует знать, говорит Бончи.
Выбор порошка зависит от вас. Бончи говорит, что все сводится к личным предпочтениям — что заставляет вас чувствовать себя хорошо? — и что подходит к вашей палитре.Следующие пять протеиновых порошков содержат все девять незаменимых аминокислот и могут использоваться для восстановления мышц после любого типа тренировок:
- Порошок сывороточного протеина
- Сывороточный протеин представляет собой смесь белков, выделенных из жидкой части молока. который отделяется при изготовлении сыра. Затем эта сыворотка перерабатывается в порошок.
- Концентрат сывороточного белка содержит от 70 до 80 процентов белка и состоит из лактозы и жира. Изолят сывороточного протеина содержит около 90 процентов белка или выше и содержит меньше лактозы и жира, чем концентрат.Однако в нем меньше питательных веществ.
- Концентрат сывороточного протеина: мерная ложка на 1 унцию содержит 22 грамма белка, 1,7 грамма углеводов и 2 грамма жира.
- Изолят сывороточного протеина: мерная ложка на 1 унцию содержит 25 граммов белка, 0,2 грамма углеводов и 0,3 грамма жира.

- Оба типа быстро перевариваются и всасываются в кровь.
- Казеиновый протеиновый порошок
- Казеин получают из творога, который остается при производстве сыра, который затем перерабатывается в порошок.
- В мерной ложке на 1 унцию содержится 24 грамма белка, 3 грамма углеводов и 1 грамм жира.
- Переваривается и всасывается в кровь медленнее, чем сыворотка. Помимо этого, казеин по питательным веществам аналогичен концентрату сывороточного белка.
- Соевый протеиновый порошок
- Соевый протеиновый порошок получают из обезвоженных соевых хлопьев, лишенных сахара и клетчатки.
- Хороший вариант для вегетарианцев, веганов или людей с аллергией на молочные продукты
- В мерной ложке 1 унция содержится 23 грамма белка, 2 грамма углеводов и 1 грамм жира.
- Конопляный протеиновый порошок
- Конопляный протеиновый порошок получают путем измельчения семян конопли в порошок.

- Хороший вариант для веганов
- В мерной ложке 1 унция содержится 12,6 г белка, 7 г углеводов и 3,4 г жира.
- Конопляный протеиновый порошок получают путем измельчения семян конопли в порошок.
- Порошок горохового протеина
- Порошок горохового протеина получают путем извлечения белка из желтого гороха и превращения его в порошок.
- Веганские, безглютеновые и безмолочные продукты
- В мерной ложке 1 унция содержится 24 грамма белка, 1 грамм углеводов и 2 грамма жира.
4 отличных протеиновых порошка для бегунов
Klean Athlete Klean Isolate Изолят сывороточного протеина
Этот протеин содержит все незаменимые аминокислоты и выпускается в шоколадном, ванильном и неароматизированном вариантах.
Изолят соевого протеина Now Sports, без вкуса
Содержит ноль граммов углеводов и 0,5 грамма жира на порцию, этот соевый протеин представляет собой постную добавку для тех, кто не получает достаточного количества белка с пищей.
Моментальное восстановление выносливости RedShift Grass Fed Whey
$55.00
livemomentous.com
Эта смесь со вкусом ванили или шоколада содержит 20 граммов белка на порцию и имеет достаточно приятный вкус, чтобы ее можно было смешивать только с водой.
Протеиновый порошок Vega Sport, ваниль
Эта ванна, наполненная такими ингредиентами, как горох, органические семена тыквы, органические семена подсолнечника и люцерна, содержит 30 граммов белка на порцию, а также BCAA и глутаминовую кислоту.
К сожалению, протеиновые добавки не регулируются нормами и могут быть полны ненужного хлама. Ищите продукты с сертификатом «NSF Certified for Sport», «Informed Sport» или «GMP Good Manufacturing Practices», чтобы убедиться, что вы получаете белок из надлежащих источников и не содержит запрещенных веществ. И, как всегда с упакованными продуктами, внимательно следите за этикетками, чтобы точно знать, что вы кладете в шейкер.
Даниэль Цикл
Старший редактор
Даниэль Зикл для журнала Runner’s World и велосипедного спорта.
Этот контент создается и поддерживается третьей стороной и импортируется на эту страницу, чтобы помочь пользователям указать свои адреса электронной почты. Вы можете найти дополнительную информацию об этом и подобном контенте на сайте piano.io.
Размер человеческого протеома: ширина и глубина
Int J Anal Chem. 2016; 2016: 7436849.
Пономаренко Елена Анатольевна
Институт биомедицинской химии, Москва 119121, Россия
Екатерина В.Институт биомедицинской химии
, Россия
Копылов
Институт биомедицинской химии, Москва 119121, Россия
Згода Виктор Григорьевич
Институт биомедицинской химии, Москва 119121, Россия
Андрей В.Lisitsa
Институт биомедицинской химии, Москва 119121, Россия
Александр И. Архаков
Институт биомедицинской химии, Москва 119121, Россия
Институт биомедицинской химии, Москва 119121, Россия
Академический редактор: Frantisek ForeT
получил 2016 18 января; Пересмотрено 11 апреля 2016 г . ; Принято к публикации 19 апреля 2016 г.
; Принято к публикации 19 апреля 2016 г.
Copyright © 2016 Elena A. Ponomarenko et al.
Это статья в открытом доступе, распространяемая в соответствии с лицензией Creative Commons Attribution, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии надлежащего цитирования оригинальной работы.
Эта статья была процитирована другими статьями в PMC.
Abstract
В этой работе обсуждаются биоинформатика и экспериментальные подходы к изучению протеома человека, совокупности белков, экспрессируемых в различных тканях и органах. Поскольку протеом человека не является статичным объектом, представляется необходимым оценить количество различных видов белков (протеоформ) и измерить количество копий одного и того же белка в конкретной ткани. Здесь предлагается метаанализ базы знаний neXtProt для теоретического предсказания количества различных протеоформ, возникающих в результате альтернативного сплайсинга (AS), полиморфизмов отдельных аминокислот (SAP) и посттрансляционных модификаций (PTM). Рассматриваются три возможных случая: (1) ПТМ и САП появляются исключительно в канонических последовательностях белков, но не в сплайс-вариантах; (2) PTM и SAP могут встречаться как в белках, кодируемых каноническими последовательностями, так и в сплайс-вариантах; (3) все типы модификаций (AS, SAP и PTM) происходят как независимые события. Экспериментальная проверка протеоформ ограничена аналитической чувствительностью протеомной технологии. Для белков, кодируемых одной хромосомой, была построена колоколообразная гистограмма распределения с оценкой количества копий в плазме, печени и клеточной линии HepG2.Предлагаемые метабиоинформатические подходы могут быть использованы для оценки количества различных протеоформ для любой группы белок-кодирующих генов.
Рассматриваются три возможных случая: (1) ПТМ и САП появляются исключительно в канонических последовательностях белков, но не в сплайс-вариантах; (2) PTM и SAP могут встречаться как в белках, кодируемых каноническими последовательностями, так и в сплайс-вариантах; (3) все типы модификаций (AS, SAP и PTM) происходят как независимые события. Экспериментальная проверка протеоформ ограничена аналитической чувствительностью протеомной технологии. Для белков, кодируемых одной хромосомой, была построена колоколообразная гистограмма распределения с оценкой количества копий в плазме, печени и клеточной линии HepG2.Предлагаемые метабиоинформатические подходы могут быть использованы для оценки количества различных протеоформ для любой группы белок-кодирующих генов.
1. От генома человека к протеому человека
Секвенирование генома [1] расшифровало количество кодирующих белок генов, установив первоначальную оценку сложности, связанной с молекулярной биологией человека. Следующим шагом является получение аналогичных тестов на уровне протеома. В двух недавних статьях описано создание проекта протеома человека [2, 3].Тем не менее еще требуются значительные усилия для изучения пространства (или размера) протеома человека как обязательной совокупности молекулярных профилей различных тканей и органов. Протеом человека — достаточно динамичная сущность [4], и это свойство следует рассматривать в двух измерениях. Во-первых, оценить количество различных типов белков (ширина протеома), а также измерить количество копий белка в конкретных тканях (глубина протеома).
В двух недавних статьях описано создание проекта протеома человека [2, 3].Тем не менее еще требуются значительные усилия для изучения пространства (или размера) протеома человека как обязательной совокупности молекулярных профилей различных тканей и органов. Протеом человека — достаточно динамичная сущность [4], и это свойство следует рассматривать в двух измерениях. Во-первых, оценить количество различных типов белков (ширина протеома), а также измерить количество копий белка в конкретных тканях (глубина протеома).
Согласно гипотезе «один ген = один белок», должно существовать не менее ~20 000 немодифицированных (канонических) белков человека.С учетом продуктов альтернативного сплайсинга (АС), содержащих одноаминокислотные полиморфизмы (SAP), возникающие из несинонимичных однонуклеотидных полиморфизмов (nsSNP), и тех, которые подвергаются ПТМ [4, 5], потенциально могут быть до 100 различных белков. производиться из одного гена. Из множества различных терминов, предложенных для описания вариантов белков [6], здесь мы выбрали «виды белков» [7] или «протеоформы» [6].
Экспериментальная проверка видов белков ограничена аналитической чувствительностью протеомной технологии.Это означает, что чувствительность технологии определяет способность обнаруживать редкие виды белков. Это ограничение проистекает из основного различия между геномикой и протеомикой [8]. Геномика опирается на ПЦР [9] для амплификации молекул ДНК или РНК в биологическом образце до концентраций выше порога обнаружения. Однако в настоящее время не существует сопоставимой высокопроизводительной технологии, способной размножать копии одного белка [8].
100% охват белковой последовательности с использованием восходящей МС недостижим; таким образом, невозможно обнаружить все потенциальные виды белков, экспрессируемых одним и тем же геном.Как правило, исследования протеома сосредоточены на основных белках , напоминающих по крайней мере одну из многих возможных протеоформ, кодируемых геном и содержащих по крайней мере один протеотипический пептид, обнаруживаемый с помощью MS. Последовательность может быть модифицирована или немодифицирована, так что это означает, что главный белок может присутствовать как один белок или как набор белков. Мастер-протеом отдельной хромосомы является результатом идентификации и измерения всех мастер-белков, кодируемых хромосомой и экспрессируемых в выбранном типе биологического материала.Для экспериментальной проверки протеоформ необходимо провести целевой МС-анализ, чтобы исследовать изменение последовательности-кандидата. Предполагалось, что биоинформатический анализ разнообразия видов белков создаст основу для будущих экспериментальных исследований протеомного пространства.
Последовательность может быть модифицирована или немодифицирована, так что это означает, что главный белок может присутствовать как один белок или как набор белков. Мастер-протеом отдельной хромосомы является результатом идентификации и измерения всех мастер-белков, кодируемых хромосомой и экспрессируемых в выбранном типе биологического материала.Для экспериментальной проверки протеоформ необходимо провести целевой МС-анализ, чтобы исследовать изменение последовательности-кандидата. Предполагалось, что биоинформатический анализ разнообразия видов белков создаст основу для будущих экспериментальных исследований протеомного пространства.
2. Сколько различных белков необходимо для поддержания жизнедеятельности человека?
Количество различных белков, составляющих протеом человека, является ключевым вопросом протеомики. Исследователи предлагают цифры от 10 000 [10] до нескольких миллиардов [6] различных видов белков.Здесь мы описываем теоретический прогноз количества различных протеоформ, которые могут возникнуть в результате событий AS, SAP или PTM.
Данные были получены из neXtProt, который содержит только белки человека, их модификации и особенности последовательности [11]. Аннотации neXtProt для AS, SAP и PTM возникли в результате биокурации данных из репозиториев, литературы и инструментов прогнозирования. Информация о возможной изменчивости белковой последовательности представлена в виде количества вариантов AS, nsSNP/SAP и PTM на ген.
Мы исходили из того, что расширение базы данных и аннотирование являются составляющими процессами, скорость которых в основном ограничена количеством исследователей и аннотаторов по всему миру. Скорость слабо зависит от пропускной способности канала связи и доступности информации, так как они не слишком сильно менялись в течение 10–15 лет для нужд пользователей PubMed или UniProt. Следовательно, на увеличение количества аннотаций в определенной базе данных, как правило, будут влиять технологические достижения, полученные за счет повышения чувствительности/производительности биоаналитического метода.
Исходя из вышеизложенного, мы предположили, что объем репрезентативных данных, загружаемых в UniProt [12] каждый год с 2005 г., достаточен для расчета среднего количества вариантов белка на один ген и числа для каждого типа вариации. Интересно, что с 2010 г. среднее количество модификаций на один ген практически не изменилось, несмотря на постоянное увеличение количества рассмотренных аннотаций. Среднее количество модификаций, в частности, со стороны AS (40% просмотренных аннотаций из всех записей данных), SAP (60% просмотренных аннотаций) или PTM (37%), практически не изменилось.
Насыщение числа аннотаций для геном-зависимых SAP, транскрипционно-зависимых AS и посттрансляционно-зависимых PTM весьма примечательно. В то время как определение PTM зависит от чувствительности анализа белков, обнаружение SAP и AS практически не имеет ограничений по чувствительности и активно накапливается в рамках крупномасштабных проектов [13]. Несмотря на такие различия, все технологии синхронно приобрели уровни насыщения, что указывает на баланс между данными, полученными с использованием стандартных методов белковой химии (накопленными за последние 50 лет), и данными, полученными с помощью высокопроизводительного секвенирования нового поколения (NGS).
Для оценки потенциального количества белков были рассмотрены три различных случая комбинации событий PTM, SAP и AS (см. (1)–(3)). Комбинаторные вариации не учитывались, так как нет систематических экспериментальных данных, описывающих совместное появление различных типов модификаций в белковых видах. Это лишь один из возможных путей решения проблемы оценки потенциального числа белков на основе данных о белковой дисперсии, уже накопленных в постгеномных базах знаний.Уравнение (1) предполагает, что PTM появляются исключительно в канонических последовательностях белков, но не в вариантах сплайсинга. Уравнение (2) предполагает, что PTM и SAP могут встречаться как в белках, кодируемых каноническими последовательностями, так и в вариантах сплайсинга. Уравнение (3) предполагает, что все типы модификации (AS, SAP и PTM) возникают независимо. Следовательно,
Nps=N*ASav+SAPav+PTMav,
(1)
Nps=N+AS*SAPav+PTMav,
(2)
Nps=N*ASav*SAPav*PTMav,
Nps=N*ASav*SAPav*PTMav,
Nps=N*ASav*SAPav*PTMav,
Nps=N*ASav*SAPav*PTMav,
Nps=N*ASav*SAPav*PTMav (3)
, где Nps представляет собой количество видов белка, N представляет собой общее количество генов, кодирующих белок, AS — количество видов, полученных в результате альтернативного сплайсинга, ASav — среднее количество вариантов сплайсинга на один ген, кодирующий белок.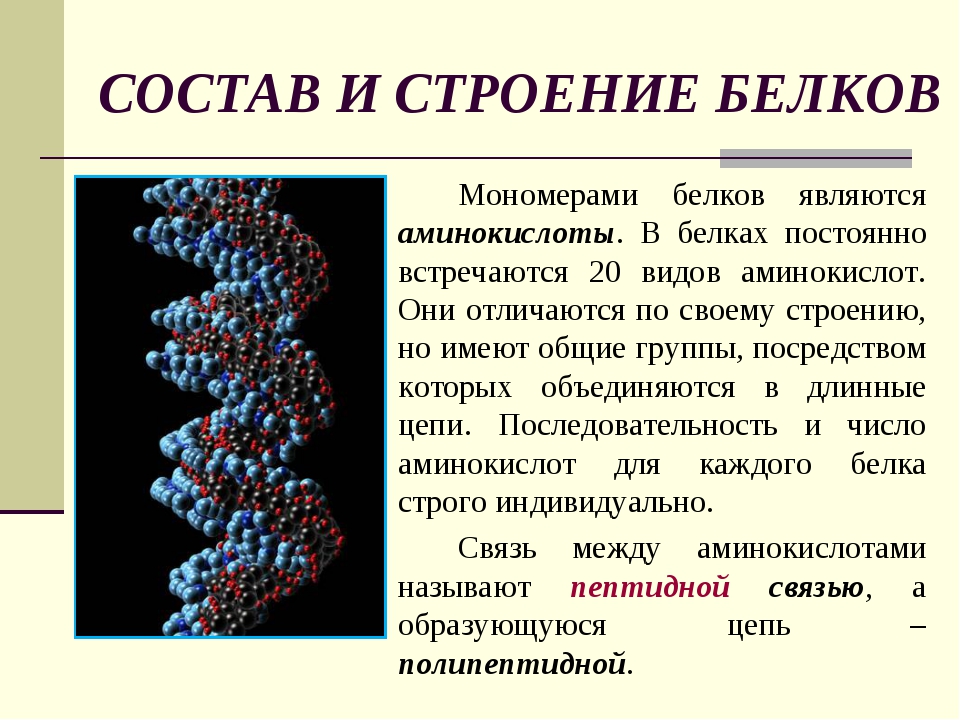 , SAPav — среднее количество nsSNP, а PTMav — среднее количество событий PTM на один ген, кодирующий белок.
, SAPav — среднее количество nsSNP, а PTMav — среднее количество событий PTM на один ген, кодирующий белок.
Обычно САП предопределены на уровне ДНК, АС возникает в результате модификаций на уровне мРНК, тогда как ПТМ возникают на уровне белка. Эти три процесса нельзя рассматривать как независимые события, учитывая, что между процессами генной экспрессии, транскрипции и трансляции существует внутренняя связь, направленная на регуляцию и сохранение клетки. Кроме того, обогащение поиска MS/MS через базу данных, содержащую все возможные комбинации вариаций белков, привело бы к комбинаторному коллапсу, несмотря на тип используемого подхода [14].
Поиск neXtProt (версия 2015_06) модификаций белка AS выявил 21 921 вариант AS в 10 519 кодирующих белок генах (2,1 ± 0,1 варианта на ген, включая одну каноническую последовательность). Наибольшее количество модифицированных форм (434 398, без элементов, связанных с раком, полученных из базы данных раковых мутаций COSMIC [15]) было связано с появлением SAP, полученных из nsSNP в 18 986 белок-кодирующих генах (22,1 ± 3,9 вариантов/ген). PTM добавили 6,6 ± 0,8 модифицированных белков на ген (94 036 PTM в 14 006 кодирующих белок генов).Применяя эти числа к уравнениям ( N = 20 043), мы оцениваем, что в организме человека существует 0,62, или 0,88, или 6,13 миллиона белковых видов.
PTM добавили 6,6 ± 0,8 модифицированных белков на ген (94 036 PTM в 14 006 кодирующих белок генов).Применяя эти числа к уравнениям ( N = 20 043), мы оцениваем, что в организме человека существует 0,62, или 0,88, или 6,13 миллиона белковых видов.
Приведенные выше результаты были сопоставлены с данными о вариациях, связанных с AS и SAP, полученными из наших результатов NGS по профилированию транскриптома ткани печени [16–18]. По результатам NGS среднее число обнаруженных сплайс-вариантов составило 1,3 на белок-кодирующий ген (или 2,3 на ген, включая канонический вариант), что сопоставимо с данными neXtProt.Среднее количество САП-содержащих протеоформ составило ~1,4 на один ген, что значительно ниже рассчитанного по данным neXtProt. Эти различия связаны с тем, что neXtProt предоставляет информацию из множества различных экспериментов («совокупная человеческая популяция»), в то время как конкретные данные NGS указывают события SAP для отдельного образца или ткани (индивидуальные отклонения).
По мере того, как базы протеомных знаний объединяют информацию об изменчивости белков в человеческой популяции, несколько миллионов различных белков в конечном итоге заселят «агрегированный» человеческий протеом.Чтобы расшифровать изменчивость, присущую предсказанию пространства протеома для человека, можно добиться более точной оценки количества белков, содержащих AS и SAP, с использованием результатов профилирования транскриптома конкретных образцов тканей.
3. Сколько белков можно обнаружить сегодня?
Согласно базе данных Plasma Proteome Database (ver. 06_2015) [19], обнаружено 10,5 тыс. белков плазмы крови и менее 10% (1278 из 20 043 белков человека) измерено количественно.Основной проблемой, касающейся экспериментальной проверки существующих наборов теоретически предсказанных белков, является предел аналитической чувствительности протеомной технологии. Аналитическая чувствительность определяется пределом обнаружения, зависящим от прибора, и динамическими диапазонами концентрации белка, зависящими от биоматериала. Плазма крови представляет собой сложную смесь с динамическим диапазоном концентраций белка, меняющимся более чем на 10 порядков [20], в то время как диапазон концентраций белка тканей или клеточных линий находится в пределах семи порядков [21].Задача состоит в обнаружении видов с низкой и сверхнизкой численностью с концентрациями <10 -12 мкМ в присутствии высококопийных белковых молекул с концентрациями >10 -6 мкМ [22].
Плазма крови представляет собой сложную смесь с динамическим диапазоном концентраций белка, меняющимся более чем на 10 порядков [20], в то время как диапазон концентраций белка тканей или клеточных линий находится в пределах семи порядков [21].Задача состоит в обнаружении видов с низкой и сверхнизкой численностью с концентрациями <10 -12 мкМ в присутствии высококопийных белковых молекул с концентрациями >10 -6 мкМ [22].
Принимая во внимание сверхчувствительные возможности олигонуклеотидной аналитики, поучительно учитывать, что результаты исследования транскриптома часто определяются на основе копий молекул РНК, а не их концентраций [23]. Работа при низких (<10 -12 мкМ) и сверхнизких (<10 -15 мкМ) концентрациях белков означает, что количественная оценка белка в количестве копий, а не в единицах концентрации, позволяет сравнивать транскриптомные и протеомные результаты [24].
В области протеомики белки обычно количественно определяют [25] по концентрации в биологическом образце, C , выраженной в моль/л (молярность, M). Соответствующее количество копий белка, N , в 1 л можно рассчитать из единиц концентрации следующим образом:
Соответствующее количество копий белка, N , в 1 л можно рассчитать из единиц концентрации следующим образом:
, где R
A представляет собой обратное число Авогадро, 10 −24 M [26], V представляет собой объем пробы, м представляет собой содержание белка, а M
w представляет собой молекулярную массу белка.
Формулы (4) решают главную задачу протеомики: перейти от представления о единицах концентрации к подсчету одиночных биомакромолекул в образце (ткани) [27].
Тройной квадрупольный масс-спектрометр позволяет достичь чувствительности 10 −14 M [28, 29] для белков-мишеней [30]. Чувствительность определения белков SRM может быть дополнительно увеличена до 10 −16 M за счет необратимого химического связывания белков из больших объемов биологических образцов [31] (не предполагается, что все измеренные белки были определены с такой чувствительностью; результаты измерения могут различаться на несколько порядков из-за различных физико-химических свойств протеотипических пептидов).
В контексте ширины протеома целевой подход ограничен необходимостью измерения только протеоформ, демонстрирующих априорное предположение о протеотипических пептидах, которые правильно напоминают события PTM, SAP или AS. В отличие от MS дробовика, SRM не может обнаруживать новые, неожиданные виды белков [32]. Возможности подходов МС «сверху вниз» и «снизу вверх» для решения проблемы микрогетерогенности протеома человека были описаны ранее [33]. Целевой SRM легко доступен для обнаружения SAP в связи с заболеваниями, включая ожирение/диабет [34] и рак [35].Например, метод SRM/MRM был применен для измерения количества сплайс-форм: три изоформы трансформирующего фактора роста были измерены с помощью SRM на уровне концентрации 10 -11 мкМ в плазме мыши и слюне человека [36]. Другой пример, изоформы остеопонтина, были измерены с помощью анализа SRM и показали, что уровень изоформы был значительно выше для немелкоклеточной карциномы легкого по сравнению с контрольной группой (7 ∗ 10 -10 по сравнению с 30 ∗ 10 ). −10 M) [37].Применение направленной МС для выявления ПТМ было проиллюстрировано гликозилированием белков: N-гликозиды были обнаружены в плазме крови человека с уровнем чувствительности 10 -11 мкМ [38] и убиквитинированием [39]. Из этих экспериментальных исследований следует, что подавляющее большинство предсказуемых протеоформ, по-видимому, присутствует в концентрациях ниже предела обнаружения. Дальнейшее повышение чувствительности аналитических методов важно для выявления диагностически значимых протеоформ в биообразцах человека.
−10 M) [37].Применение направленной МС для выявления ПТМ было проиллюстрировано гликозилированием белков: N-гликозиды были обнаружены в плазме крови человека с уровнем чувствительности 10 -11 мкМ [38] и убиквитинированием [39]. Из этих экспериментальных исследований следует, что подавляющее большинство предсказуемых протеоформ, по-видимому, присутствует в концентрациях ниже предела обнаружения. Дальнейшее повышение чувствительности аналитических методов важно для выявления диагностически значимых протеоформ в биообразцах человека.
Поскольку было показано, что набор белков, кодируемых любой хромосомой человека, представляет собой репрезентативную часть всего протеома человека [40], виды белков с высокой, средней и низкой копийностью могут быть оценены путем отбора образцов мастер-белков, кодируемых единая хромосома. В качестве примера протеомной карты, ориентированной на хромосомы, мы загрузили данные из PASSEL [41] (идентификаторы PASSEL: PASS00278, PASS00276, PASS00092 и PASS00742), полученные для мастер-белков, кодируемых хромосомой 18 [16, 17]. Эти белки измеряли в трех типах биоматериала, включая плазму человека, образцы печени и клетки HepG2.Измерения проводились в соответствии с рекомендациями уровня 3 (исследовательские исследования) [42] с использованием стратегии двойной цели, которая сочетает в себе хромосомно-центрический подход с масс-спектрометрией SRM «снизу вверх» [43].
Эти белки измеряли в трех типах биоматериала, включая плазму человека, образцы печени и клетки HepG2.Измерения проводились в соответствии с рекомендациями уровня 3 (исследовательские исследования) [42] с использованием стратегии двойной цели, которая сочетает в себе хромосомно-центрический подход с масс-спектрометрией SRM «снизу вверх» [43].
Наблюдалась колоколообразная гистограмма распределения основных белков, кодируемых хромосомой 18 (), показывающая медиану 10 8 копий на 1 мк л плазмы крови и 10 5 копий на печень/клетку HepG2. Восходящий участок кривой отражает высоко- и среднекопийные белки, тогда как нисходящий участок может быть объяснен либо уменьшением разнообразия протеомов в биологическом образце, либо, что более вероятно, представлением о том, что белки не могут быть обнаружены из-за низкой чувствительности аналитических методов. [44].Интересно, что после увеличения чувствительности аналитического метода с 10 -14 мкМ до 10 -18 мкМ за счет необратимого связывания аналитов [30] было обнаружено 14 дополнительных низкокопийных видов белков (<10 5 копий на клетку или на 1 мкл л плазмы крови) были получены и количественно измерены не менее двух протеотипических пептидов в каждом виде биоматериала (см. заштрихованные области на рис.). Согласно полученным результатам, в плазме значительно больше видов белков с высоким содержанием по сравнению с клетками печени или HepG2.Поэтому вполне вероятно, что трудность идентификации ультранизкокопийных белков в плазме связана с высоким динамическим диапазоном концентраций белков плазмы [22].
заштрихованные области на рис.). Согласно полученным результатам, в плазме значительно больше видов белков с высоким содержанием по сравнению с клетками печени или HepG2.Поэтому вполне вероятно, что трудность идентификации ультранизкокопийных белков в плазме связана с высоким динамическим диапазоном концентраций белков плазмы [22].
(а) Распределение количества копий мастер-белков хромосомы 18, нормализованное на одну клетку HepG2/печени или 1 мк л плазмы. (б) Доля в зависимости от обнаруженных белков (в % от общего числа белков, кодируемых хромосомой 18) и аналитической чувствительности.
Для демонстрации глубины протеома количество копий мастер-белка в биообразце строили в зависимости от чувствительности протеомной технологии ().Покрытие протеома выражали в процентах доли обнаруженных белков от общего числа генов хромосомы 18, которое по данным neXtProt составило 276. Как показано на рисунке, кривая распределения белков плазмы смещается влево относительно кривых для клеток. Общее количество обнаруженных видов белков в клетках печени и HepG2 увеличилось по сравнению с плазмой крови человека.
Общее количество обнаруженных видов белков в клетках печени и HepG2 увеличилось по сравнению с плазмой крови человека.
Будущие успехи в исследовании протеома человека зависят от способности использовать методы биоинформатики для выяснения существующих видов белков и целевого МС-анализа, высокопроизводительных измерений и высокопроизводительных алгоритмов для de novo сборки белковых последовательностей на основе результатов МС.Кроме того, повышение чувствительности аналитической технологии обеспечит более широкий доступ к сверхнизкокопируемым белкам и расширит возможности для обнаружения и анализа. В этом контексте теоретическое предсказание количества протеоформ (оценка ширины протеома) и их распределения по динамическому диапазону (т. е. глубины протеома) в конечном итоге требуется для планирования рабочей нагрузки для проекта протеома человека, ориентированного на хромосомы.
Благодарности
Работа выполнена при поддержке RSF Grant no.15-15-30041.
Сокращения
| AS: | альтернативного сплайсинга |
| NGS: | следующего поколения секвенирования |
| nsSNPs: | несинонимичных однонуклеотидных полиморфизмов |
| SAP: | одной аминокислоты полиморфизм. |
Конкурирующие интересы
Авторы заявляют об отсутствии конкурирующих интересов.
Ссылки
1. Коллинз Ф.С., Ландер Э.С., Роджерс Дж., Уотерстон Р.Х. Завершение эухроматической последовательности генома человека. Природа . 2005; 50: 162–168. [Google Академия]2. Вильгельм М., Шлегл Дж., Хане Х. и др. Проект протеома человека на основе масс-спектрометрии. Природа . 2014;509(7502):582–587. doi: 10.1038/nature13319. [PubMed] [CrossRef] [Google Scholar]4. Karlsson C., Malmström L., Aebersold R., Malmström J. Избранные для всего протеома анализы мониторинга реакции на человеческий патоген Streptococcus pyogenes
. Связь с природой . 2012;3, статья 1301 doi: 10.1038/ncomms2297. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]5. Рот М.Дж., Форбс А.Дж., Бойн М.Т., И.И., Ким Ю.-Б., Робинсон Д.Е., Келлехер Н.Л. Точная и параллельная характеристика кодирующих полиморфизмов, альтернативного сплайсинга и модификаций белков человека с помощью масс-спектрометрии. Молекулярная и клеточная протеомика . 2005;4(7):1002–1008. doi: 10.1074/mcp.M500064-MCP200. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]7.Юнгблут П., Тиеде Б., Зимни-Арндт У. и др. Разрешающая способность двумерного электрофореза и идентификация белков из гелей. Электрофорез . 1996;17(5):839–847. doi: 10.1002/elps.1150170505. [PubMed] [CrossRef] [Google Scholar]8. Арчаков А., Згода В., Копылов А. и др. Хромосомоцентрический подход к преодолению узких мест в проекте «Протеом человека». Экспертиза протеомики . 2012;9(6):667–676. doi: 10.1586/epr.12.54. [PubMed] [CrossRef] [Google Scholar]9.
Связь с природой . 2012;3, статья 1301 doi: 10.1038/ncomms2297. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]5. Рот М.Дж., Форбс А.Дж., Бойн М.Т., И.И., Ким Ю.-Б., Робинсон Д.Е., Келлехер Н.Л. Точная и параллельная характеристика кодирующих полиморфизмов, альтернативного сплайсинга и модификаций белков человека с помощью масс-спектрометрии. Молекулярная и клеточная протеомика . 2005;4(7):1002–1008. doi: 10.1074/mcp.M500064-MCP200. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]7.Юнгблут П., Тиеде Б., Зимни-Арндт У. и др. Разрешающая способность двумерного электрофореза и идентификация белков из гелей. Электрофорез . 1996;17(5):839–847. doi: 10.1002/elps.1150170505. [PubMed] [CrossRef] [Google Scholar]8. Арчаков А., Згода В., Копылов А. и др. Хромосомоцентрический подход к преодолению узких мест в проекте «Протеом человека». Экспертиза протеомики . 2012;9(6):667–676. doi: 10.1586/epr.12.54. [PubMed] [CrossRef] [Google Scholar]9. Сайки Р.К., Гельфанд Д.Х., Стоффель С. и др. Праймер-направленная ферментативная амплификация ДНК с помощью термостабильной ДНК-полимеразы. Наука . 1988;239(4839):487–491. doi: 10.1126/science.2448875. [PubMed] [CrossRef] [Google Scholar] 10. Адкинс Дж. Н. На пути к протеому сыворотки крови человека: анализ с помощью многомерного разделения в сочетании с масс-спектрометрией. Молекулярная и клеточная протеомика . 2002; 1: 947–955. doi: 10.1074/mcp.m200066-mcp200. [PubMed] [CrossRef] [Google Scholar] 11.Лейн Л., Аргуд-Пюи Г., Британ А. и др. NeXtProt: платформа знаний о белках человека. Исследование нуклеиновых кислот . 2012;40(1):D76–D83. doi: 10.1093/nar/gkr1179. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]13. Abecasis G.R., Auton A., Brooks L.D., et al. Интегрированная карта генетических вариаций из 1092 геномов человека. Природа . 2012; 491:56–65. [Бесплатная статья PMC] [PubMed] [Google Scholar]14. Коттрелл Дж. С. Идентификация белков с использованием данных МС/МС.
Сайки Р.К., Гельфанд Д.Х., Стоффель С. и др. Праймер-направленная ферментативная амплификация ДНК с помощью термостабильной ДНК-полимеразы. Наука . 1988;239(4839):487–491. doi: 10.1126/science.2448875. [PubMed] [CrossRef] [Google Scholar] 10. Адкинс Дж. Н. На пути к протеому сыворотки крови человека: анализ с помощью многомерного разделения в сочетании с масс-спектрометрией. Молекулярная и клеточная протеомика . 2002; 1: 947–955. doi: 10.1074/mcp.m200066-mcp200. [PubMed] [CrossRef] [Google Scholar] 11.Лейн Л., Аргуд-Пюи Г., Британ А. и др. NeXtProt: платформа знаний о белках человека. Исследование нуклеиновых кислот . 2012;40(1):D76–D83. doi: 10.1093/nar/gkr1179. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]13. Abecasis G.R., Auton A., Brooks L.D., et al. Интегрированная карта генетических вариаций из 1092 геномов человека. Природа . 2012; 491:56–65. [Бесплатная статья PMC] [PubMed] [Google Scholar]14. Коттрелл Дж. С. Идентификация белков с использованием данных МС/МС. Журнал протеомики .2011;74(10):1842–1851. doi: 10.1016/j.jprot.2011.05.014. [PubMed] [CrossRef] [Google Scholar] 15. Forbes S.A., Beare D., Gunasekaran P., et al. COSMIC: изучение мировых знаний о соматических мутациях при раке человека. Исследование нуклеиновых кислот . 2015;43(1):D805–D811. doi: 10.1093/nar/gku1075. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]16. Згода В. Г., Копылов А. Т., Тихонова О. В. и др. Профилирование транскриптома хромосомы 18 и целевое картирование протеома в истощенной плазме, ткани печени и клетках HepG2. Журнал исследований протеома . 2013;12(1):123–134. doi: 10.1021/pr300821n. [PubMed] [CrossRef] [Google Scholar] 17. Пономаренко Е. А., Копылов А. Т., Лисица А. В. и др. Транскриптопротеом хромосомы 18 ткани печени и клеток HepG2 и целевое картирование протеома в обедненной плазме: обновление 2013 г. Journal of Proteome Research . 2014;13(1):183–190. doi: 10.1021/pr400883x. [PubMed] [CrossRef] [Google Scholar] 18.
Журнал протеомики .2011;74(10):1842–1851. doi: 10.1016/j.jprot.2011.05.014. [PubMed] [CrossRef] [Google Scholar] 15. Forbes S.A., Beare D., Gunasekaran P., et al. COSMIC: изучение мировых знаний о соматических мутациях при раке человека. Исследование нуклеиновых кислот . 2015;43(1):D805–D811. doi: 10.1093/nar/gku1075. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]16. Згода В. Г., Копылов А. Т., Тихонова О. В. и др. Профилирование транскриптома хромосомы 18 и целевое картирование протеома в истощенной плазме, ткани печени и клетках HepG2. Журнал исследований протеома . 2013;12(1):123–134. doi: 10.1021/pr300821n. [PubMed] [CrossRef] [Google Scholar] 17. Пономаренко Е. А., Копылов А. Т., Лисица А. В. и др. Транскриптопротеом хромосомы 18 ткани печени и клеток HepG2 и целевое картирование протеома в обедненной плазме: обновление 2013 г. Journal of Proteome Research . 2014;13(1):183–190. doi: 10.1021/pr400883x. [PubMed] [CrossRef] [Google Scholar] 18. Тяхт А. В., Ильина Е. Н., Алексеев Д. Г. и др. Профилирование экспрессии генов RNA-Seq в клетках HepG2: влияние экспериментальных факторов и сравнение с тканью печени. BMC Genomics . 2014;15, статья 1108 doi: 10.1186/1471-2164-15-1108. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]19. Мутусами Б., Хануманту Г., Суреш С. и др. База данных протеома плазмы как ресурс для протеомных исследований. Протеомика . 2005;5(13):3531–3536. doi: 10.1002/pmic.200401335. [PubMed] [CrossRef] [Google Scholar] 20. Андерсон Н.Л., Полански М., Пипер Р. и соавт. Протеом плазмы человека. Молекулярная и клеточная протеомика . 2004;3(4):311–326.doi: 10.1074/mcp.m300127-mcp200. [PubMed] [CrossRef] [Google Scholar] 21. Бек М., Шмидт А., Мальмстрём Дж. и др. Количественный протеом клеточной линии человека. Молекулярно-системная биология . 2011;7, статья 549 doi: 10.1038/msb.2011.82. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]22. Андерсон Н.
Тяхт А. В., Ильина Е. Н., Алексеев Д. Г. и др. Профилирование экспрессии генов RNA-Seq в клетках HepG2: влияние экспериментальных факторов и сравнение с тканью печени. BMC Genomics . 2014;15, статья 1108 doi: 10.1186/1471-2164-15-1108. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]19. Мутусами Б., Хануманту Г., Суреш С. и др. База данных протеома плазмы как ресурс для протеомных исследований. Протеомика . 2005;5(13):3531–3536. doi: 10.1002/pmic.200401335. [PubMed] [CrossRef] [Google Scholar] 20. Андерсон Н.Л., Полански М., Пипер Р. и соавт. Протеом плазмы человека. Молекулярная и клеточная протеомика . 2004;3(4):311–326.doi: 10.1074/mcp.m300127-mcp200. [PubMed] [CrossRef] [Google Scholar] 21. Бек М., Шмидт А., Мальмстрём Дж. и др. Количественный протеом клеточной линии человека. Молекулярно-системная биология . 2011;7, статья 549 doi: 10.1038/msb.2011.82. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]22. Андерсон Н. Л., Андерсон Н. Г. Протеом плазмы человека: история, характер и перспективы диагностики. Молекулярная и клеточная протеомика . 2002;1(11):845–867. doi: 10.1074/mcp.р200007-мкп200. [PubMed] [CrossRef] [Google Scholar] 23. Де Соуза Абреу Р., Пенальва Л. О., Маркотт Э. М., Фогель К. Глобальные признаки уровней экспрессии белков и мРНК. Молекулярные биосистемы . 2009;5(12):1512–1526. doi: 10.1039/b5d. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]24. Шванхойссер Б., Буссе Д., Ли Н. и др. Глобальная количественная оценка контроля экспрессии генов млекопитающих. Природа . 2011;473(7347):337–342. doi: 10.1038/nature10098. [PubMed] [CrossRef] [Google Scholar] 25.Андерсон Н.Л., Андерсон Н.Г., Пирсон Т.В. и соавт. Проект обнаружения и количественного определения протеома человека. Молекулярная и клеточная протеомика . 2009;8(5):883–886. doi: 10.1074/mcp.R800015-MCP200. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]26. Арчаков А.
Л., Андерсон Н. Г. Протеом плазмы человека: история, характер и перспективы диагностики. Молекулярная и клеточная протеомика . 2002;1(11):845–867. doi: 10.1074/mcp.р200007-мкп200. [PubMed] [CrossRef] [Google Scholar] 23. Де Соуза Абреу Р., Пенальва Л. О., Маркотт Э. М., Фогель К. Глобальные признаки уровней экспрессии белков и мРНК. Молекулярные биосистемы . 2009;5(12):1512–1526. doi: 10.1039/b5d. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]24. Шванхойссер Б., Буссе Д., Ли Н. и др. Глобальная количественная оценка контроля экспрессии генов млекопитающих. Природа . 2011;473(7347):337–342. doi: 10.1038/nature10098. [PubMed] [CrossRef] [Google Scholar] 25.Андерсон Н.Л., Андерсон Н.Г., Пирсон Т.В. и соавт. Проект обнаружения и количественного определения протеома человека. Молекулярная и клеточная протеомика . 2009;8(5):883–886. doi: 10.1074/mcp.R800015-MCP200. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]26. Арчаков А. И., Иванов Ю. Д., Лисица А. В., Згода В. Г. Нанотехнология АСМ-рыболовства — способ обращения числа Авогадро в протеомике. Протеомика . 2007;7(1):4–9. doi: 10.1002/pmic.200600467. [PubMed] [CrossRef] [Google Scholar] 27.Лисица А. В. Молярная концентрация приветствует авогадро в постгеномной аналитике. Биохимия и аналитическая биохимия . 2015;04:4–7. doi: 10.4172/2161-1009.1000216. [Перекрестная ссылка] [Академия Google] 28. Киёнами Р., Шон А., Пракаш А. и др. Повышенная селективность, аналитическая точность и производительность в целевой протеомике. Молекулярная и клеточная протеомика . 2011; 10(2) doi: 10.1074/mcp.M110.002931. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]29. Сано С., Тагами С., Хашимото Ю. и др. Абсолютное количественное определение пептидов APL1 β в плазме с низким содержанием на уровне субфмоль/мл с помощью SRM/MRM без иммуноаффинного обогащения. Журнал исследований протеома . 2014;13(2):1012–1020.
И., Иванов Ю. Д., Лисица А. В., Згода В. Г. Нанотехнология АСМ-рыболовства — способ обращения числа Авогадро в протеомике. Протеомика . 2007;7(1):4–9. doi: 10.1002/pmic.200600467. [PubMed] [CrossRef] [Google Scholar] 27.Лисица А. В. Молярная концентрация приветствует авогадро в постгеномной аналитике. Биохимия и аналитическая биохимия . 2015;04:4–7. doi: 10.4172/2161-1009.1000216. [Перекрестная ссылка] [Академия Google] 28. Киёнами Р., Шон А., Пракаш А. и др. Повышенная селективность, аналитическая точность и производительность в целевой протеомике. Молекулярная и клеточная протеомика . 2011; 10(2) doi: 10.1074/mcp.M110.002931. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]29. Сано С., Тагами С., Хашимото Ю. и др. Абсолютное количественное определение пептидов APL1 β в плазме с низким содержанием на уровне субфмоль/мл с помощью SRM/MRM без иммуноаффинного обогащения. Журнал исследований протеома . 2014;13(2):1012–1020. doi: 10.1021/pr4010103. [PubMed] [CrossRef] [Google Scholar] 30. Копылов А. Т., Згода В. Г., Лисица А. В., Арчаков А. И. Совместное использование технологии необратимого связывания и MRM для обнаружения и количественного определения низко- и сверхнизкокопийных белков. Протеомика .2013;13(5):727–742. doi: 10.1002/pmic.201100460. [PubMed] [CrossRef] [Google Scholar] 31. Арчаков А., Иванов Ю., Лисица А., Згода В. Биоспецифический необратимый фишинг в сочетании с атомно-силовой микроскопией для обнаружения крайне малочисленных белков. Протеомика . 2009;9(5):1326–1343. doi: 10.1002/pmic.200800598. [PubMed] [CrossRef] [Google Scholar] 32. Оливейра А. П., Людвиг К., Пикотти П., Когадеева М., Эберсолд Р., Зауэр У. Регуляция центрального метаболизма дрожжей путем фосфорилирования ферментов. Молекулярно-системная биология . 2012;8, статья 623 doi: 10.1038/msb.2012.55. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]33. Лисица А., Мошковский С., Чернобровкин А.
doi: 10.1021/pr4010103. [PubMed] [CrossRef] [Google Scholar] 30. Копылов А. Т., Згода В. Г., Лисица А. В., Арчаков А. И. Совместное использование технологии необратимого связывания и MRM для обнаружения и количественного определения низко- и сверхнизкокопийных белков. Протеомика .2013;13(5):727–742. doi: 10.1002/pmic.201100460. [PubMed] [CrossRef] [Google Scholar] 31. Арчаков А., Иванов Ю., Лисица А., Згода В. Биоспецифический необратимый фишинг в сочетании с атомно-силовой микроскопией для обнаружения крайне малочисленных белков. Протеомика . 2009;9(5):1326–1343. doi: 10.1002/pmic.200800598. [PubMed] [CrossRef] [Google Scholar] 32. Оливейра А. П., Людвиг К., Пикотти П., Когадеева М., Эберсолд Р., Зауэр У. Регуляция центрального метаболизма дрожжей путем фосфорилирования ферментов. Молекулярно-системная биология . 2012;8, статья 623 doi: 10.1038/msb.2012.55. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]33. Лисица А., Мошковский С., Чернобровкин А. , Пономаренко Е., Арчаков А. Профилирование протеоформ: перспективное развитие протеомики для открытия биомаркеров. Экспертиза протеомики . 2014;11(1):121–129. doi: 10.1586/14789450.2014.878652. [PubMed] [CrossRef] [Google Scholar] 34. Су З.-Д., Сунь Л., Ю Д.-Х. и др. Количественное обнаружение полиморфизмов отдельных аминокислот с помощью целевой протеомики. Журнал молекулярной клеточной биологии . 2011;3(5):309–315. doi: 10.1093/jmcb/mjr024. [PubMed] [CrossRef] [Google Scholar] 35. Ван К., Чаркади Р., Ву Дж. и др. Мутантные белки как канцерспецифические биомаркеры. Труды Национальной академии наук Соединенных Штатов Америки . 2011;108(6):2444–2449. doi: 10.1073/pnas.1019203108. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]36. Лю С., Джин З., О’Брайен Р. и др. Ограниченный мониторинг избранных реакций: количественная оценка выбранных посттрансляционных модификаций и изоформ белков. Методы . 2013;61(3):304–312. doi: 10.1016/j.ymeth.
, Пономаренко Е., Арчаков А. Профилирование протеоформ: перспективное развитие протеомики для открытия биомаркеров. Экспертиза протеомики . 2014;11(1):121–129. doi: 10.1586/14789450.2014.878652. [PubMed] [CrossRef] [Google Scholar] 34. Су З.-Д., Сунь Л., Ю Д.-Х. и др. Количественное обнаружение полиморфизмов отдельных аминокислот с помощью целевой протеомики. Журнал молекулярной клеточной биологии . 2011;3(5):309–315. doi: 10.1093/jmcb/mjr024. [PubMed] [CrossRef] [Google Scholar] 35. Ван К., Чаркади Р., Ву Дж. и др. Мутантные белки как канцерспецифические биомаркеры. Труды Национальной академии наук Соединенных Штатов Америки . 2011;108(6):2444–2449. doi: 10.1073/pnas.1019203108. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]36. Лю С., Джин З., О’Брайен Р. и др. Ограниченный мониторинг избранных реакций: количественная оценка выбранных посттрансляционных модификаций и изоформ белков. Методы . 2013;61(3):304–312. doi: 10.1016/j.ymeth. 2013.03.006. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]37. Ву Дж., Пунгалия П., Крайнов Э., Бейтс Б. Идентификация и количественная оценка вариантов сплайсинга остеопонтина в плазме больных раком легкого с использованием иммуноаффинного захвата и целевой масс-спектрометрии. Биомаркеры . 2012;17(2):125–133. doi: 10.3109/1354750X.2011.643485. [PubMed] [CrossRef] [Google Scholar] 38. Оссола Р., Шисс Р., Пикотти П., Риннер О., Reiter R., Aebersold R. Валидация биомаркеров в образцах крови с помощью масс-спектрометрии мониторинга выбранных реакций N-гликозитов. Методы молекулярной биологии . 2011; 728:179–194. [PubMed] [Google Scholar] 39. Кеттенбах А. Н., Раш Дж., Гербер С. А. Абсолютная количественная оценка белка и количества посттрансляционных модификаций с помощью синтетических пептидов, меченных стабильными изотопами. Природные протоколы . 2011;6(2):175–186. doi: 10.1038/nprot.2010.196. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]40.
2013.03.006. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]37. Ву Дж., Пунгалия П., Крайнов Э., Бейтс Б. Идентификация и количественная оценка вариантов сплайсинга остеопонтина в плазме больных раком легкого с использованием иммуноаффинного захвата и целевой масс-спектрометрии. Биомаркеры . 2012;17(2):125–133. doi: 10.3109/1354750X.2011.643485. [PubMed] [CrossRef] [Google Scholar] 38. Оссола Р., Шисс Р., Пикотти П., Риннер О., Reiter R., Aebersold R. Валидация биомаркеров в образцах крови с помощью масс-спектрометрии мониторинга выбранных реакций N-гликозитов. Методы молекулярной биологии . 2011; 728:179–194. [PubMed] [Google Scholar] 39. Кеттенбах А. Н., Раш Дж., Гербер С. А. Абсолютная количественная оценка белка и количества посттрансляционных модификаций с помощью синтетических пептидов, меченных стабильными изотопами. Природные протоколы . 2011;6(2):175–186. doi: 10.1038/nprot.2010.196. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]40. Пономаренко Е., Поверенная Е., Пятницкий М. и др. Сравнительное ранжирование хромосом человека на основе постгеномных данных. OMICS: Журнал интегративной биологии . 2012;16(11):604–611. doi: 10.1089/omi.2012.0034. [PubMed] [CrossRef] [Google Scholar]41. Кузебаух У., Дойч Э.В., Кэмпбелл Д.С., Сан З., Фарра Т., Мориц Р.Л. Использование PeptideAtlas, SRMAtlas и PASSEL: комплексные ресурсы для обнаружения и целевой протеомики. Текущие протоколы в биоинформатике .2014; 46:1–28. [Бесплатная статья PMC] [PubMed] [Google Scholar]42. Карр С.А., Аббатиелло С.Е., Акерманн Б.Л. и др. Целевые измерения пептидов в биологии и медицине: передовой опыт разработки методов анализа на основе масс-спектрометрии с использованием целевого подхода. Молекулярная и клеточная протеомика . 2014;13(3):907–917. doi: 10.1074/mcp.m113.036095. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]43. Арчаков А., Асеев А., Быков В. и др. Геноцентрический взгляд на проект протеома человека: на примере российской дорожной карты по хромосоме 18.
Пономаренко Е., Поверенная Е., Пятницкий М. и др. Сравнительное ранжирование хромосом человека на основе постгеномных данных. OMICS: Журнал интегративной биологии . 2012;16(11):604–611. doi: 10.1089/omi.2012.0034. [PubMed] [CrossRef] [Google Scholar]41. Кузебаух У., Дойч Э.В., Кэмпбелл Д.С., Сан З., Фарра Т., Мориц Р.Л. Использование PeptideAtlas, SRMAtlas и PASSEL: комплексные ресурсы для обнаружения и целевой протеомики. Текущие протоколы в биоинформатике .2014; 46:1–28. [Бесплатная статья PMC] [PubMed] [Google Scholar]42. Карр С.А., Аббатиелло С.Е., Акерманн Б.Л. и др. Целевые измерения пептидов в биологии и медицине: передовой опыт разработки методов анализа на основе масс-спектрометрии с использованием целевого подхода. Молекулярная и клеточная протеомика . 2014;13(3):907–917. doi: 10.1074/mcp.m113.036095. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]43. Арчаков А., Асеев А., Быков В. и др. Геноцентрический взгляд на проект протеома человека: на примере российской дорожной карты по хромосоме 18. Протеомика . 2011;11(10):1853–1856. doi: 10.1002/pmic.201000540. [PubMed] [CrossRef] [Google Scholar]44. Лисица А. В., Поверенная Е. В., Пономаренко Е. А., Арчаков А. И. Ширина протеома плазмы человека в сравнении с раковой клеточной линией и бактериями. Биомолекулярные исследования и терапия . 2015;4, статья 132 doi: 10.4172/2167-7956.1000132. [CrossRef] [Google Scholar]
Протеомика . 2011;11(10):1853–1856. doi: 10.1002/pmic.201000540. [PubMed] [CrossRef] [Google Scholar]44. Лисица А. В., Поверенная Е. В., Пономаренко Е. А., Арчаков А. И. Ширина протеома плазмы человека в сравнении с раковой клеточной линией и бактериями. Биомолекулярные исследования и терапия . 2015;4, статья 132 doi: 10.4172/2167-7956.1000132. [CrossRef] [Google Scholar]
20 аминокислот, из которых состоят белки | Улучшение жизни с помощью аминокислот | О нас | Глобальный веб-сайт Ajinomoto Group
Как известно, основными компонентами белков являются различные аминокислоты.Аминокислоты составляют отличительную часть человеческого тела и рациона. Они чрезвычайно важны для правильного функционирования человеческого организма; следовательно, важно понимать, сколько аминокислот входит в состав белков. Давайте приступим к выяснению того, из скольких аминокислот состоят белки.
Сколько аминокислот помогает строить белки?
В природе идентифицировано около 500 аминокислот, но только 20 аминокислот составляют белки человеческого тела. Давайте узнаем обо всех этих 20 аминокислотах и типах различных аминокислот.
Давайте узнаем обо всех этих 20 аминокислотах и типах различных аминокислот.
Типы всех аминокислот
Все 20 аминокислот подразделяются на две разные группы аминокислот. Незаменимые аминокислоты и заменимые аминокислоты вместе составляют 20 аминокислот. Из 20 аминокислот 9 являются незаменимыми аминокислотами, а остальные являются заменимыми аминокислотами. Давайте посмотрим на каждую аминокислоту в соответствии с их классификацией.
Незаменимые аминокислоты
BCAA (валин, лейцин и изолейцин)
Аминокислоты с разветвленной цепью (BCAA) представляют собой группу из трех аминокислот (валин, лейцин и изолейцин), которые имеют молекулярную структуру с разветвлением.BCAA в изобилии содержатся в мышечных белках, стимулируют рост мышц в организме и обеспечивают энергию во время тренировок.
Лизин
Лизин — одна из наиболее часто упоминаемых незаменимых аминокислот. Такие продукты, как хлеб и рис, как правило, содержат мало лизина. Например, по сравнению с идеальным аминокислотным составом в пшенице мало лизина. Университет Организации Объединенных Наций провел исследование людей в развивающихся странах, где они зависят от пшеницы как источника белка, и обнаружил недостаток лизина в их рационе.Недостаток лизина и других аминокислот может привести к серьезным проблемам, таким как задержка роста и тяжелые заболевания.
Например, по сравнению с идеальным аминокислотным составом в пшенице мало лизина. Университет Организации Объединенных Наций провел исследование людей в развивающихся странах, где они зависят от пшеницы как источника белка, и обнаружил недостаток лизина в их рационе.Недостаток лизина и других аминокислот может привести к серьезным проблемам, таким как задержка роста и тяжелые заболевания.
Треонин
Незаменимая аминокислота, используемая для создания активного центра ферментов.
Фенилаланин
Незаменимая аминокислота, которая используется для производства многих типов полезных аминов.
Метионин
Незаменимая аминокислота, которая используется для производства множества различных веществ, необходимых организму.
Гистидин
Незаменимая аминокислота, используемая для производства гистамина.
Триптофан
Незаменимая аминокислота, используемая для производства многих типов полезных аминов.
Заменимые аминокислоты
Глютамин
Глютамин является одной из наиболее распространенных аминокислот в организме. Глютамин защищает желудок и желудочно-кишечный тракт. В частности, глютамин используется для производства энергии для желудочно-кишечного тракта. Глютамин способствует метаболизму алкоголя для защиты печени.
Глютамин защищает желудок и желудочно-кишечный тракт. В частности, глютамин используется для производства энергии для желудочно-кишечного тракта. Глютамин способствует метаболизму алкоголя для защиты печени.
Аспартат
Аспартат является одной из аминокислот, наиболее пригодных для получения энергии.Аспартат является одной из аминокислот, наиболее близко расположенных к циклу трикарбоновых кислот (TCA) в организме, который производит энергию. Цикл TCA подобен двигателю, который приводит в движение автомобили. Каждая клетка нашего тела функционирует, чтобы производить энергию.
Глутамат
Бульон комбу, используемый в японской кухне, содержит глутамат. Глутамат является основой умами, а свободные глутаматы содержатся в комбу, помидорах и сыре. В организме глутамат используется как важный источник незаменимых аминокислот.
Аргинин
Аргинин играет важную роль в открытии вен для улучшения кровотока. Оксид азота, открывающий вены, производится из аргинина.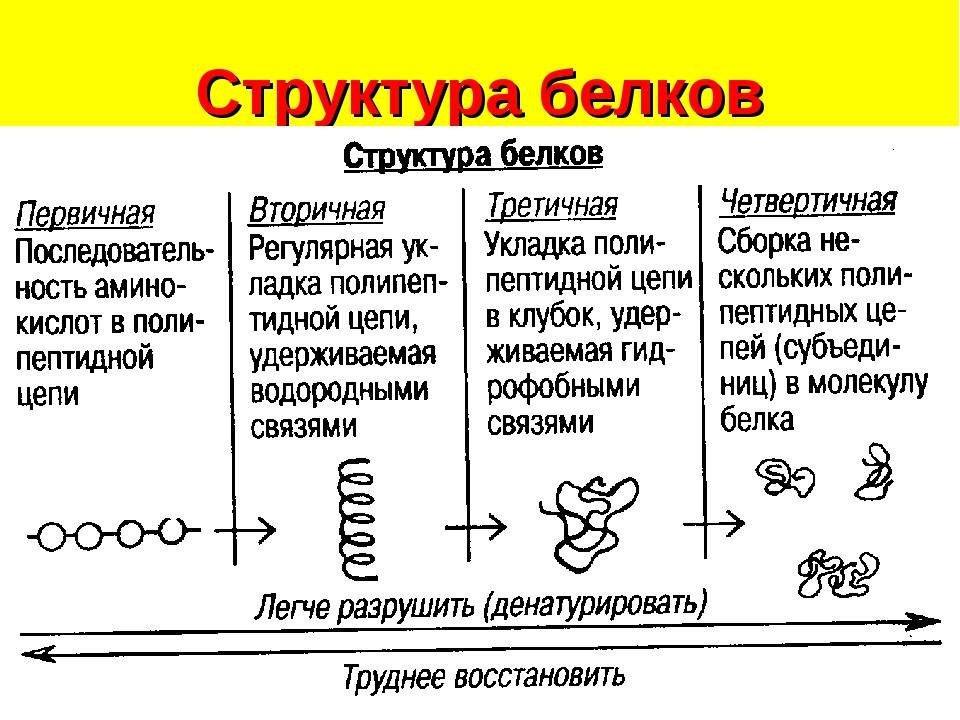 Аргинин – полезная аминокислота для выведения из организма избытка аммиака. Аргинин повышает иммунитет.
Аргинин – полезная аминокислота для выведения из организма избытка аммиака. Аргинин повышает иммунитет.
Аланин
Аланин поддерживает функцию печени. Аланин используется для производства глюкозы, необходимой организму. Аланин улучшает метаболизм алкоголя.
Пролайн
Пролин — одна из аминокислот, содержащихся в коллагене, из которого состоит ткань кожи.Пролин является одной из наиболее важных аминокислот для естественного увлажняющего фактора (NMF), который поддерживает влажность кожи.
Цистеин
Цистеин уменьшает количество черной пигментации меланина. Цистеина много в волосах головы и тела. Цистеин увеличивает количество желтого меланина, вырабатываемого вместо черного меланина.
Аспарагин
Аминокислота, обнаруженная в спарже. И аспарагин, и аспартат расположены близко к циклу трикарбоновых кислот (TCA), производящему энергию.
Серин
Аминокислота, используемая для производства фосфолипидов и глицериновой кислоты.
Глицин
Заменимая аминокислота, которая вырабатывается в организме. Глицина в организме предостаточно. Он действует как передатчик в центральной нервной системе и помогает регулировать такие функции организма, как передвижение и сенсорное восприятие. Глицин составляет одну треть коллагена.
Тирозин
Тирозин используется для получения многих типов полезных аминов. Тирозин входит в группу ароматических аминокислот вместе с фенилаланином и триптофаном.
Контент, который может вам понравиться
Что такое аминокислоты?
Аминокислоты являются незаменимыми соединениями, общими для всех живых существ, от микробов до человека. Все живые тела содержат одни и те же 20 типов аминокислот. Что такое …
Факты об аминокислотах
Часто задаваемые вопросы об аминокислотахОбщие вопросы об аминокислотахВ чем разница между аминокислотой и пептидом? Белки состоят из сотен …
Все, что нужно знать о различных типах белка
Нельзя отрицать, что вам нужен белок. Это питательное вещество насыщает, наращивает мышцы и даже укрепляет кости. Но изобилие продуктов с высоким содержанием белка затрудняет расшифровку его различных форм.
Это питательное вещество насыщает, наращивает мышцы и даже укрепляет кости. Но изобилие продуктов с высоким содержанием белка затрудняет расшифровку его различных форм.
Мы углубились в основы белков, чтобы преобразовать всю эту сложную науку в легко усваиваемую информацию, которая поможет вам достичь ваших целей.
Вы знаете, что белок «полезен для вас», но вот что он делает для вашего тела.
Белок является одним из трех макроэлементов, помимо углеводов и жиров, которые необходимы вам для ежедневного функционирования. Потребности каждого человека в питании уникальны, но, как правило, мужчины должны потреблять от 1,2 до 1,6 грамма белка на каждый килограмм своего целевого веса.
Люди хвалят белок за его влияние на телосложение, но он делает гораздо больше, чем увеличивает ваши результаты. Исследования показывают, что люди, которые едят больше белка, снижают риск развития остеопороза, имеют более высокий метаболизм и более низкое кровяное давление.
Сегодня насытиться можно разными способами: курицей, порошком, водой, печеньем. Несмотря на многочисленные формы, основных форм белка всего две: цельная и дополнительная.
Несмотря на многочисленные формы, основных форм белка всего две: цельная и дополнительная.
Этот контент импортирован из {embed-name}. Вы можете найти тот же контент в другом формате или найти дополнительную информацию на их веб-сайте.
Цельнопищевой белок
Вы, наверное, слышали, что такие питательные вещества, как витамины и минералы, лучше всего получать из пищи, а не из пищевых добавок.То же самое и с белком, говорит Дена Чемпион, доктор медицинских наук из Университета штата Огайо.
«Вы просто не можете разлить по бутылкам или упаковать все преимущества цельных продуктов», — говорит она Men’s Health .
В своей первоначальной форме пища содержит питательные вещества, которые невозможно воспроизвести в лаборатории. Например, брокколи содержит сотни фитохимических веществ, которые невозможно поместить в таблетку. Исследования показывают, что эти вещества, содержащиеся только в пище, помогают снизить риск развития сердечно-сосудистых заболеваний.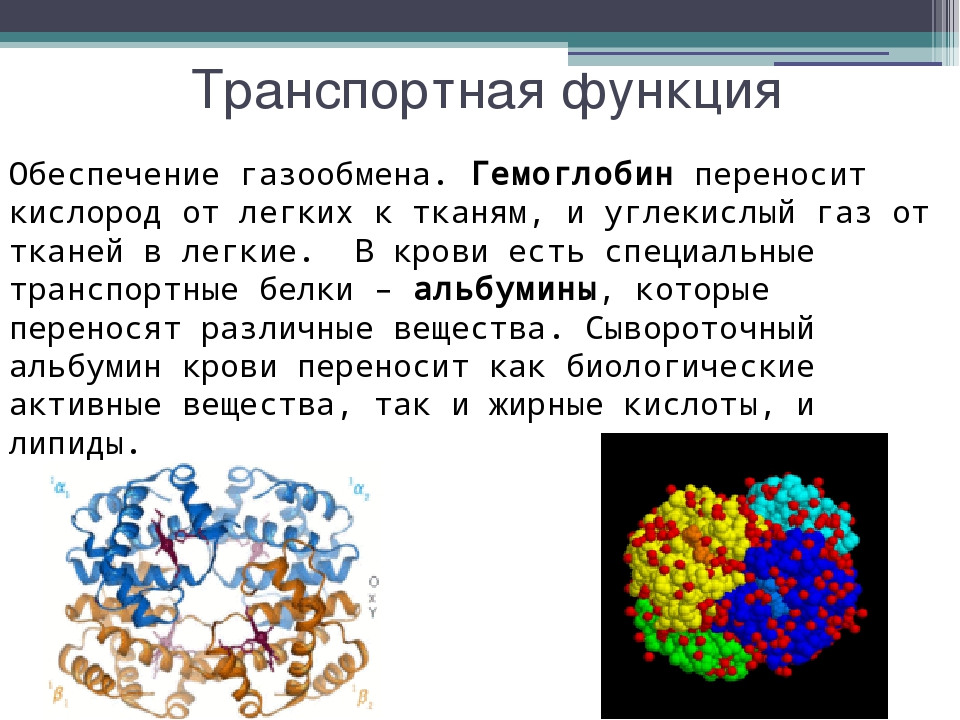 Вы также получите много клетчатки.
Вы также получите много клетчатки.
Вы, наверное, слышали, как люди говорят о полном и неполном белке. Как следует из их названий, полноценный белок содержит все девять незаменимых аминокислот, в которых нуждается наш организм, а неполный — нет.
Растительные белки, как правило, неполные, за некоторыми исключениями, такими как киноа и тофу. Тем не менее, вам не нужно беспокоиться о потреблении достаточного количества полноценных белков, если у вас хорошо сбалансированная диета, — говорит Кристина Вайдман, RDN и спортивный диетолог Северо-Западного университета.
«Если вы едите столько разных продуктов в течение дня, вы восполняете запас незаменимых аминокислот, в которых нуждается ваше тело».
Вот несколько хороших источников белка:
- Курица: одна грудка весом шесть унций содержит приблизительно 53 г
- Индейка: 3 унции содержат 22 г
- Говядина: 4 унции содержат 22 г
- Яйца большое яйцо содержит 6 г
- Греческий обезжиренный йогурт: порция объемом шесть унций содержит 17 г
- Тофу: 3.
 5 унций содержат 10 г
5 унций содержат 10 г - Чечевица: 1 чашка содержит 18 г
- Лебеда: 1 чашка содержит 8 г
Дополнительный белок
Традиционно порошки и коктейли были основным способом увеличить потребление белка помимо пищи. Теперь упакованные закуски наполняют дополнительными белками, такими как соя или сыворотка.
Нет ничего плохого в том, чтобы использовать их для перекуса или удобства, если они не являются вашим единственным источником белка, говорит Чемпион.
Тем не менее, протеиновые добавки не регулируются, поэтому невозможно сказать, что находится внутри упаковки, объясняет она.
«Некоторые из этих порошков содержат примеси, — предупреждает Чемпион. — Я советую людям выбирать чем проще, тем лучше». три аминокислоты с разветвленной цепью, которые помогают в наращивании мышечной массы, потере жира и усталости. Потребление коктейля с высоким содержанием люцеина после тренажерного зала может быть особенно полезным, — говорит Чемпион. «богатые продукты, вы делаете двойную работу по наращиванию мышечной массы», — объясняет она.
«богатые продукты, вы делаете двойную работу по наращиванию мышечной массы», — объясняет она.
Однако, если вы предпочитаете не есть молочные продукты, порошки соевого протеина также являются хорошим источником люцеина.
При выборе порошка обратите внимание на знак NSF International (Национальный санитарный фонд) «Сертифицировано для спорта». Это означает, что продукт был протестирован сторонней компанией и содержит то, что заявлено на этикетке.
А как же любимые белковые сладости?
«Их можно использовать с умом, но они не должны быть единственной вещью, которую вы собираетесь брать в течение дня», — говорит Чемпион.Обязательно выбирайте закуски, содержащие клетчатку, чтобы увеличить потребление питательных веществ.
Мелисса Мэтьюз
Писатель по вопросам здоровья
Мелисса Мэтьюз — автор статей о здоровье в Men’s Health, освещающая последние новости в области продуктов питания, питания и здоровья.
Этот контент создается и поддерживается третьей стороной и импортируется на эту страницу, чтобы помочь пользователям указать свои адреса электронной почты. Вы можете найти больше информации об этом и подобном контенте на фортепиано.ио
Вы можете найти больше информации об этом и подобном контенте на фортепиано.ио
типов белков и их функции | Здоровое питание
Кирстен Нуньес Обновлено 6 декабря 2018 г.
Белок — это основной макроэлемент, состоящий из небольших единиц, называемых аминокислотами, которые находятся в каждой клетке. Фактически, белки часто называют строительными блоками жизни. Аминокислоты классифицируются как незаменимые, заменимые и условные. Наше тело не может производить незаменимые аминокислоты, поэтому мы должны получать их из пищи. Незаменимые аминокислоты вырабатываются организмом, в то время как условные аминокислоты незаменимы только во время болезни.Источники белка считаются полными или неполными в зависимости от содержащихся в них аминокислот. По данным Национальной медицинской библиотеки США, от 10 до 35 процентов ежедневного потребления калорий должно приходиться на белок. Наше тело не хранит белки, как жиры или углеводы, поэтому важно получать их достаточно каждый день.
Полноценные белки
Полноценные белки содержат все девять незаменимых кислот, которые наш организм не может производить. Лучшие источники полноценного белка включают продукты животного происхождения, такие как мясо, птица и морепродукты.Примеры включают стейк, индейку и лосося. Другие продукты животного происхождения, такие как яйца и нежирные молочные продукты, также являются хорошими источниками полноценного белка. Но имейте в виду, что некоторые продукты с высоким содержанием белка также могут содержать много насыщенных жиров. В стейке, например, 40 граммов белка и 12 граммов насыщенных жиров. Чтобы есть больше питательных полноценных белков, Министерство сельского хозяйства США предлагает выбирать постное или нежирное мясо и птицу. Вы также можете есть морепродукты два раза в неделю, чтобы увеличить потребление полезных жиров.Использование здоровых методов приготовления пищи, таких как запекание и приготовление на гриле, позволит избежать добавления лишних жиров.
Неполные белки
В неполных белках отсутствует одна или несколько незаменимых аминокислот. Почти все растительные белки являются неполноценными. Фасоль, горох, семена, орехи, продукты из сои и некоторые злаки являются растительными белками. Примеры фасоли и гороха включают белую фасоль, нут, хумус и зеленый горошек. Семена и орехи включают такие продукты, как миндаль, грецкие орехи и семена подсолнечника. Министерство сельского хозяйства США рекомендует есть несоленые орехи и семена, чтобы избежать лишнего натрия.Примеры соевых продуктов включают тофу, темпе и соевое молоко. Киноа, семена, которые едят в виде зерна, является исключительно богатым источником белка. Если вы не едите продукты животного происхождения, важно есть много разных видов растительных белков, чтобы получать достаточное количество незаменимых аминокислот.
Белковые эквиваленты
Большинству людей требуется от 5 до 7 унций белка каждый день. Одна унция белка может быть получена из 1 унции мяса, птицы или морепродуктов. Для справки: 3 унции мяса или птицы — это размер вашей ладони, а 3 унции рыбы — это размер чековой книжки.Одна унция белка также равна 1 большому яйцу, 1/4 стакана фасоли или гороха, 1 столовой ложке орехового масла, 1/2 унции орехов или семян или 14 арахисам и 27 фисташкам.
Одна унция белка может быть получена из 1 унции мяса, птицы или морепродуктов. Для справки: 3 унции мяса или птицы — это размер вашей ладони, а 3 унции рыбы — это размер чековой книжки.Одна унция белка также равна 1 большому яйцу, 1/4 стакана фасоли или гороха, 1 столовой ложке орехового масла, 1/2 унции орехов или семян или 14 арахисам и 27 фисташкам.
Глава 3. Белки и аминокислоты
Глава 3. Белки и аминокислоты
1. БЕЛКИ
2. ПИЩЕВАРЕНИЕ БЕЛКОВ
И МЕТАБОЛИЗМ
3. ОБЩАЯ ПОТРЕБНОСТЬ В БЕЛКАХ
4. АМИНОКИСЛОТЫ
5. КОЛИЧЕСТВЕННЫЙ
ТРЕБОВАНИЯ К АМИНОКИСЛОТЕ
6.ДОПОЛНЕНИЕ
ДИЕТЫ С АМИНОКИСЛОТАМИ
7. ССЫЛКИ
J. E. Halver
Вашингтонский университет
Сиэтл, Вашингтон
1.1 Классификация
1.2 Структура
1.3 Свойства
1.4 Химическое определение
Белки представляют собой сложные органические соединения, состоящие из множества аминокислот, связанных между собой пептидными связями и сшитых между цепями сульфгидрильными связями, водородными связями и силами Ван-дер-Ваальса. Белки отличаются большим разнообразием химического состава, чем любая другая группа биологически активных соединений. Белки различных животных и растительных клеток придают этим тканям их биологическую специфичность.
Белки отличаются большим разнообразием химического состава, чем любая другая группа биологически активных соединений. Белки различных животных и растительных клеток придают этим тканям их биологическую специфичность.
1.1 Классификация
Белки можно классифицировать как:
(а) Простые белки. При гидролизе они дают только аминокислоты и иногда небольшие углеводные соединения. Примеры: альбумины, глобулины, глютелины, альбуминоиды, гистоны и протамины.
(б) Конъюгированные белки. Это простые белки в сочетании с некоторым небелковым материалом в организме. Примеры: нуклеопротеины, гликопротеины, фосфопротеины, гемоглобины и лецитопротеины.
(c) Производные белки. Это белки, полученные из простых или конъюгированных белков физическими или химическими средствами. Примеры: денатурированные белки и пептиды.
1.2 Структура
Потенциальная конфигурация белковых молекул настолько сложна, что многие типы белковых молекул могут быть сконструированы и обнаружены в биологических материалах с различными физическими характеристиками. Глобулярные белки обнаруживаются в крови и тканевых жидкостях в аморфной глобулярной форме с очень тонкими или отсутствующими мембранами. Коллагеновые белки находятся в соединительной ткани, такой как кожа или клеточные мембраны. Волокнистые белки находятся в волосах, мышцах и соединительной ткани. Примерами кристаллических белков являются хрусталик глаза и подобные ткани. Ферменты представляют собой белки со специфическими химическими функциями и опосредуют большинство физиологических процессов жизни. Несколько небольших полипептидов действуют как гормоны в тканевых системах, контролирующих различные химические или физиологические процессы.Мышечный белок состоит из нескольких форм полипептидов, которые позволяют мышцам сокращаться и расслабляться при физическом движении.
Глобулярные белки обнаруживаются в крови и тканевых жидкостях в аморфной глобулярной форме с очень тонкими или отсутствующими мембранами. Коллагеновые белки находятся в соединительной ткани, такой как кожа или клеточные мембраны. Волокнистые белки находятся в волосах, мышцах и соединительной ткани. Примерами кристаллических белков являются хрусталик глаза и подобные ткани. Ферменты представляют собой белки со специфическими химическими функциями и опосредуют большинство физиологических процессов жизни. Несколько небольших полипептидов действуют как гормоны в тканевых системах, контролирующих различные химические или физиологические процессы.Мышечный белок состоит из нескольких форм полипептидов, которые позволяют мышцам сокращаться и расслабляться при физическом движении.
1.3 Свойства
Белки также можно охарактеризовать по их химическим реакциям. Большинство белков растворимы в воде, спирте, разбавленных основаниях или растворах солей различных концентраций. Белки имеют характерную спиральную структуру, которая определяется последовательностью аминокислот в первичной полипептидной цепи и стереоконфигурацией радикальных групп, присоединенных к альфа-углероду каждой аминокислоты. Белки термолабильны, демонстрируя различную степень лабильности в зависимости от типа белка, раствора и профиля температуры. Белки могут быть обратимыми или необратимыми, денатурировать нагреванием, концентрацией соли, замораживанием, ультразвуковым воздействием или старением. Белки подвергаются характерному связыванию с другими белками в так называемой пластеиновой реакции и объединяются со свободными альдегидными и гидроксильными группами углеводов с образованием соединений типа Майяра.
Белки термолабильны, демонстрируя различную степень лабильности в зависимости от типа белка, раствора и профиля температуры. Белки могут быть обратимыми или необратимыми, денатурировать нагреванием, концентрацией соли, замораживанием, ультразвуковым воздействием или старением. Белки подвергаются характерному связыванию с другими белками в так называемой пластеиновой реакции и объединяются со свободными альдегидными и гидроксильными группами углеводов с образованием соединений типа Майяра.
1.4 Химическое определение
Содержание азота в большинстве белков, обнаруженных в тканях животных, орехов и зерна, составляет около 16 процентов; поэтому содержание белка обычно выражается как содержание азота × 6.25.
Проглоченные белки сначала расщепляются на более мелкие фрагменты пепсином в желудке или трипсином или химотрипсином из поджелудочной железы. Затем эти пептиды восстанавливаются под действием карбоксипептидазы, которая гидролизует одну аминокислоту за раз, начиная со свободного карбокси-конца молекулы, или аминопептидазы, которая отщепляет одну аминокислоту за раз, начиная со свободного амино-конца полипептида. цепь. Свободные аминокислоты, выбрасываемые в пищеварительную систему, затем всасываются через стенки желудочно-кишечного тракта в кровоток, где они затем ресинтезируются в новые тканевые белки или катаболизируются для получения энергии или фрагментов для дальнейшего тканевого метаболизма.
цепь. Свободные аминокислоты, выбрасываемые в пищеварительную систему, затем всасываются через стенки желудочно-кишечного тракта в кровоток, где они затем ресинтезируются в новые тканевые белки или катаболизируются для получения энергии или фрагментов для дальнейшего тканевого метаболизма.
Потребность в валовом белке была определена для нескольких видов рыб (см. Таблицу 1). Имитация цельнояичного белкового компонента тестируемых рационов содержит избыток незаменимых аминокислот. Эти диеты поддерживали приблизительно изокалорийными, регулируя общий белок плюс легкоусвояемые углеводные компоненты до фиксированного количества, поскольку лечение белковой диетой варьировалось в тестируемых диапазонах. Тесты по кормлению мальков, мальков и годовалых рыб показали, что общие потребности в белке являются самыми высокими у первоначальных кормящихся мальков и что они уменьшаются по мере увеличения размера рыбы.Чтобы расти с максимальной скоростью, у мальков должна быть диета, в которой почти половина усваиваемых ингредиентов состоит из сбалансированного белка; в возрасте 6-8 недель эта потребность снижается примерно до 40 процентов рациона лосося и форели и примерно до 35 процентов рациона годовалых лососевых, выращенных при стандартной температуре окружающей среды (SET). См. рис. 1 и 2. Потребность в валовом белке у молодых сомов меньше, чем у лососевых. Для первоначального кормления мальков требуется, чтобы около 50 процентов усваиваемых компонентов рациона составляли белки, и потребность уменьшается с увеличением размера.Некоторые испытания кормления лосося показали прямую связь между изменениями потребности в белке молоди рыб и изменениями температуры воды. Чавычи в воде с температурой 7°С для максимального роста требуется около 40% цельного яичного белка; той же рыбе в 15 C воде требуется около 50 процентов белка. Лосось, форель и сом могут потреблять больше белка, чем требуется для максимального роста, благодаря эффективности выведения азотистых отходов в виде растворимых соединений аммиака через жаберную ткань непосредственно в водную среду.Эта система устранения азота более эффективна, чем у птиц и млекопитающих. Птицы и млекопитающие потребляют энергию для синтеза мочевины, мочевой кислоты или других соединений азота, которые выделяются через ткани почек и выводятся с мочой.
См. рис. 1 и 2. Потребность в валовом белке у молодых сомов меньше, чем у лососевых. Для первоначального кормления мальков требуется, чтобы около 50 процентов усваиваемых компонентов рациона составляли белки, и потребность уменьшается с увеличением размера.Некоторые испытания кормления лосося показали прямую связь между изменениями потребности в белке молоди рыб и изменениями температуры воды. Чавычи в воде с температурой 7°С для максимального роста требуется около 40% цельного яичного белка; той же рыбе в 15 C воде требуется около 50 процентов белка. Лосось, форель и сом могут потреблять больше белка, чем требуется для максимального роста, благодаря эффективности выведения азотистых отходов в виде растворимых соединений аммиака через жаберную ткань непосредственно в водную среду.Эта система устранения азота более эффективна, чем у птиц и млекопитающих. Птицы и млекопитающие потребляют энергию для синтеза мочевины, мочевой кислоты или других соединений азота, которые выделяются через ткани почек и выводятся с мочой. Усвояемые углеводы и жиры будут избавлять от избытка белка в рационе до тех пор, пока будет удовлетворяться потребность в белке для максимального роста (рис. 1 и 2).
Усвояемые углеводы и жиры будут избавлять от избытка белка в рационе до тех пор, пока будет удовлетворяться потребность в белке для максимального роста (рис. 1 и 2).
Таблица 1. Расчетная потребность в пищевом белке для некоторых рыб 1/
Виды | Уровень сырого протеина в рационе для оптимального роста (г/кг) |
Радужная форель ( Salmo gairdneri ) | 400-460 |
Карп ( Cyprinus carpio ) | 380 |
Чавыча ( Oncorhynchus tshawytscha ) | 400 |
Угорь ( Ангилья japonica ) | 445 |
Камбала ( Pleuronectes пластины ) | 500 |
Дорада ( Chrysophrys aurata ) | 400 |
Белый амур ( Ctenopharyngodon idella ) | 410-430 |
Брайкон сп. | 356 |
Красный морской лещ ( Chrysophrys major ) | 550 |
Желтохвост ( Seriola quinqueradiata ) | 550 |
1/ По материалам C. B. Cowey, 1978
Рис. 1. Потребность чавычи в белке при температуре 47°F. Верхняя кривая: начальный индивидуальный средний вес рыбы, 1.5г. Нижняя кривая: начальный индивидуальный средний вес рыбы 5,6 г.
Рис. 2. Потребность чавычи в белке при температуре 58°F. Верхняя кривая: начальный индивидуальный средний вес рыбы 2,6 г. Нижняя кривая: начальный индивидуальный средний вес рыбы 5,8 г.
Нижняя кривая: начальный индивидуальный средний вес рыбы 5,8 г.
.
В основном рыба должна получать диету, содержащую градуированные уровни высококачественного белка и энергии и адекватный баланс незаменимых жирных кислот, витаминов и минералов в течение длительного периода времени.Из полученной кривой доза/реакция потребность в белке обычно получается с помощью графика Альмквиста. Считается, что эти различия в очевидной потребности в белке связаны с различиями в методах культивирования и составе рациона.
Относительно высокие уровни пищевого белка, необходимые для максимального роста некоторых рыб, таких как белый амур, Ctenopharyngodon idella, и Brycon spp. удивительны, так как эти рыбы всеядны. Brycon spp.выращиваются на нежелательных фруктах и другом растительном материале с низким содержанием белка, и в этих условиях предположительно существенный вклад в потребление ими белка вносится из естественной пищевой цепи.
Потребность в белке эвриталинных рыб, таких как радужная форель, Salmo gairdneri, и кижуч, Oncorhynchus kisutch, , выращенных в воде с соленостью 20 ppt, примерно такая же, как потребность в пресной воде. Данных о потребностях этих видов в белке в насыщенной морской воде нет.(35 п.л.).
4.1 Основные
и заменимые аминокислоты
4.2 Заменимые
Аминокислоты и качество белка
Аминокислоты являются строительными блоками белков; около 23 аминокислот были выделены из природных белков. Десять из них незаменимы для рыб. Животное не способно синтезировать незаменимые аминокислоты и поэтому должно получать их с пищей.
4.1 Заменимые и незаменимые аминокислоты
Лосось, форель и канальный сом, которым давали корм, лишенный аргинина, гистидина, изолейцина, лейцина, лизина, метионина, фенилаланина, треонина, триптофана или валина, не росли (рис.3). Те же самые рыбы, которых кормили рационами, лишенными других L-аминокислот, росли так же, как и рыбы, получавшие все 18 протестированных аминокислот (рис. 4). Азотистый компонент в тестируемых рационах состоял из 18 L-аминокислот по схеме, характерной для цельного яичного белка. Все испытуемые рыбы быстро восстанавливались, когда недостающую аминокислоту заменяли в рационе. Наклон кривой роста группы восстановления был идентичен наклону кривой роста рыб, получавших полноценный тестируемый рацион аминокислот.
4). Азотистый компонент в тестируемых рационах состоял из 18 L-аминокислот по схеме, характерной для цельного яичного белка. Все испытуемые рыбы быстро восстанавливались, когда недостающую аминокислоту заменяли в рационе. Наклон кривой роста группы восстановления был идентичен наклону кривой роста рыб, получавших полноценный тестируемый рацион аминокислот.
Исследуемые незаменимые аминокислоты: аланин, аспарагиновая кислота, цистин, глутаминовая кислота, глицин, пролин, серин и тирозин.Было обнаружено, что эти аминокислоты не являются необходимыми для роста лосося, форели и канального сома.
Количественные исследования потребности в 10 незаменимых аминокислотах проводились с использованием смеси казеина и желатина с добавлением кристаллических L-аминокислот. Тестовая диета содержала 40 процентов цельного яичного белка в качестве азотного компонента. Опыты, проведенные с карпом и угрем, показали аналогичное отсутствие роста при отсутствии в рационе незаменимой аминокислоты.
Рис. 3. Рост рыбы с дефицитом аргинина. Группа с дефицитом была разделена через шесть недель на рационе с дефицитом, и недостающая аминокислота была заменена в одной из двух частей.
Рис. 4. Рост рыб с дефицитом цистина.
(Оба рисунка адаптированы из: DeLong, D.C., J.E. Halver and E.T. Mertz, 1958, J. Nutr., 65:589-99)
Если известны потребности рыбы в незаменимых аминокислотах, должна быть возможность удовлетворить эти потребности в системах культивирования различными способами за счет различных пищевых белков или комбинаций пищевых белков.
Фенилаланин защищен от тирозина. Неизвестно, что он химически модифицируется или становится недоступным из-за суровых условий, которым обычно подвергаются белки кормов во время обработки. Измерение фенилаланина в белках несложно, так что обеспечение и оценка фенилаланина в белках в практических рационах не представляет особых трудностей.
Лизин является основной аминокислотой. В дополнение к а-аминокислотной группе, обычно связанной с пептидной связью, она также содержит вторую, а-аминогруппу.Эта -аминогруппа должна быть свободной и реакционноспособной, иначе лизин, хотя и поддающийся химическому измерению, не будет биологически доступен. Во время обработки белков корма α-аминогруппа лизина может реагировать с небелковыми молекулами, присутствующими в корме, с образованием дополнительных соединений, которые делают лизин биологически недоступным.
Метионин щадит цистин. Однако измерить содержание метионина в кормовых белках непросто, так как аминокислота подвергается окислению во время обработки.После обработки метионин может присутствовать как таковой, или в виде сульфоксида, или в виде сульфона. Сульфоксид может образовываться из метионина во время кислотного гидролиза кормового белка перед измерением его бескислотного состава. Кислотный гидролиз белков перед анализом нарушает первоначальное равновесие между двумя соединениями, так что состав гидролизата больше не отражает состав белка. При определении содержания метионина в чистых белках окисление аминокислоты до метионинсульфона обычно является количественным.Однако в случае кормовых белков это не покажет, сколько метионина или сульфоксида метионина присутствовало в белке до окисления перфторатом и гидролиза.
При определении содержания метионина в чистых белках окисление аминокислоты до метионинсульфона обычно является количественным.Однако в случае кормовых белков это не покажет, сколько метионина или сульфоксида метионина присутствовало в белке до окисления перфторатом и гидролиза.
Сульфоксид метионина может иметь некоторую биологическую ценность для рыбы, которая может иметь некоторую способность обратно преобразовывать его в метионин и, таким образом, частично восполнять часть метионина, окисленного во время обработки.
Недавно были опубликованы методы измерения метионина в белках с использованием йодоплатинатного реагента до и после восстановления трихлоридом титана, чтобы получить значения как метионина, так и сульфоксида в исходном белке.Также был описан метод измерения метионина, в частности, путем расщепления бромидом циана. Оба метода еще предстоит оценить независимо друг от друга. Микробиологический анализ метионина в кормовых белках является ценным инструментом, хотя существует опасность того, что оксиды метионина могут различаться по своей активности в отношении микроорганизмов и искажать значения.
Количественные потребности лососевых в десяти незаменимых аминокислотах определяли путем скармливания линейных приращений по одной аминокислоте за один раз в тестовом рационе, содержащем аминокислотный профиль, идентичный цельному яичному белку, за исключением тестируемой аминокислоты.Повторные группы рыб получали диетические обработки до тех пор, пока не появлялись существенные различия в росте тестируемых партий. График реакции роста Альмквиста указывал на уровень аминокислот, необходимый для максимального роста в этих конкретных условиях испытаний. Рационы были разработаны таким образом, чтобы содержание белка было на уровне или немного ниже оптимальной потребности в белке для данного вида и условий испытаний, чтобы гарантировать максимальное использование лимитирующей аминокислоты. Сравнение потребностей в десяти незаменимых аминокислотах между видами показано в таблице 2.
Недавней инновацией стало использование в тестовых рационах белков с относительно низким содержанием данной незаменимой аминокислоты. Таким образом, комбинации рыбной муки и зеина использовались в тестовых рационах для определения потребности радужной форели в аргинине. Рационы, содержащие разное относительное количество казеина и желатина, показали, что увеличение уровня связанного с белком аргинина с 11 до 17 г/кг приводило к значительному увеличению роста канального сома.
Таким образом, комбинации рыбной муки и зеина использовались в тестовых рационах для определения потребности радужной форели в аргинине. Рационы, содержащие разное относительное количество казеина и желатина, показали, что увеличение уровня связанного с белком аргинина с 11 до 17 г/кг приводило к значительному увеличению роста канального сома.
Таблица 2 Потребность в аминокислотах семи животных 1/
Аминокислота | Молодь угря | Молодь карпа | Канальный сом | Молодь чавычи | Цыпленок | Молодой поросенок | Крыса |
Аргинин | 3. | 4,3 (1,65/38,5) | 6,0 (2,4/40) | 6,1 (1,1/18) | 1,5 (0,2/13) | 1,0 (0,2/19) | |
Гистидин | 1,9 (0,8/42) | 1,8 (0,7/40) | 1,7 (0,3/18) | 1. | 2,1 (0,4/19) | ||
Изолейцин | 3,6 (1,5/42) | 2,6 (1,0/38,5) | 2,2 (0,9/41) | 4,4 (0,8/18) | 4,6 (0,6/13) | 3,9 (0,5/13) | |
Лейцин | 4.1 (1,7/42) | 3,9 (1,5/38,5) | 3,9 (1,6/41) | 6,7 (1,2/18) | 4,6 (0,6/13) | 4,5 (0,9/19) | |
Лизин | 4,8 (2,0/42) | 5,1 (1,23/24,0) | 5,0 (2,0/40) | 6. | 4,7 (0,65/13) | 5,4 (1,0/19) | |
Метионин 2/ | 4,5 (2,1/42) 3/ | 3,1 (1,2/38,5) | 2,3 (0,56/24,0) | 4,0 (1,6/40) 3/ | 4.4 (0,8/18) | 3,0 (0,6/20) | 3,0 (0,6/20) |
Фенилаланин 4/ | 5,1 (2,1/41) 5/ | 7,2 (1,3/18) | 3. | 5,3 (0,9/17) | |||
Треонин | 3,6 (1,5/42) | 2,2 (0,9/40) | 3,3 (0,6/18) | 3,0 (0,4/13) | 3,1 (0,2/19) | ||
Триптофан | 1,0 (0,4/42) | 0. | 1,1 (0,2/18) | 0,8 (0,2/25) | 1,0 (0,2/19) | ||
Валин | 3,6 (1,5/42) | 3,2 (1,3/40) | 4,4 (0,8/18) | 3,1 (0,4/13) | 3,1 (0,4/13) |
1/ Выражается в процентах от пищевого белка.В скобках числители — это потребности в процентах от сухого рациона, а знаменатели — это проценты общего белка в рационе.
2/ При отсутствии цистина
3/ Метионин плюс цистин
4/ В отсутствие тирозина
5/ Фенилаланин плюс тирозин
(Адаптировано: Национальный исследовательский совет, 1977 г.)
Потребность радужной форели в аргинине была определена по стандартной кривой зависимости доза/реакция (рост), а также путем измерения уровней свободного аргинина в тканях (крови и мышцах) в группах форели, получавших увеличивающееся количество аргинина в рационе.После того, как диетическая потребность форели в аргинине была удовлетворена, любое дальнейшее увеличение потребления аргинина приводило к увеличению концентрации свободного аргинина в крови и мышцах. Было получено хорошее согласие между двумя методами.
Данные, представленные в Таблице 2, позволяют предположить, что между видами рыб существуют реальные различия в их потребностях в определенных аминокислотах. Это приводит к трудностям в составлении белкового компонента практических рационов для тех видов, потребности которых в аминокислотах еще не известны. Возможным решением является использование для каждой аминокислоты самого высокого уровня, необходимого для любого из тех видов, по которым имеются данные. Необходимость в дополнительных количественных данных о потребностях рыб в аминокислотах, особенно тех, которые фактически или потенциально могут быть использованы в качестве сельскохозяйственных животных, очевидна.
Возможным решением является использование для каждой аминокислоты самого высокого уровня, необходимого для любого из тех видов, по которым имеются данные. Необходимость в дополнительных количественных данных о потребностях рыб в аминокислотах, особенно тех, которые фактически или потенциально могут быть использованы в качестве сельскохозяйственных животных, очевидна.
Одним из решений проблемы использования белков с относительным дефицитом одной или нескольких аминокислот является добавление к белку соответствующих количеств аминокислот, необходимых в практическом рационе. Рыба использует свободные аминокислоты с разной степенью эффективности.
Молодь карпа, Cyprinus carpio, не могут расти на рационах, в которых белковый компонент (казеин, желатин) заменен смесью аминокислот, сходной по общему составу. Трипсиновый гидролизат казеина был столь же неэффективен. Однако, если рацион, содержащий свободные аминокислоты в качестве белкового компонента, тщательно нейтрализовать NaOH до рН 6,5-6,7, то некоторый рост молоди карпа все же происходит. Этот рост был заметно ниже, чем на сопоставимой казеиновой диете в тех же условиях.
Этот рост был заметно ниже, чем на сопоставимой казеиновой диете в тех же условиях.
Канальный сом также не может утилизировать свободные аминокислоты, введенные в качестве добавок к дефицитным белкам. Когда соевая мука была заменена изонитрогенной мукой из менхадена, рост и эффективность кормления канального сома существенно снизились. Добавление свободного метионина, цистина или лизина, наиболее лимитирующих аминокислот, к этим замещенным соей диетам не увеличивало прибавку в весе.
Повышение уровня аргинина в рационе сомов с 11 до 17 г/кг за счет изоазотной замены желатина на казеин значительно увеличило прирост веса, но добавление свободного аргинина, цистина, триптофана или метионина к казеину мало повлияло на рост или конверсию пищи.
Лососевые способны использовать свободные аминокислоты для роста. Было показано, что зеин-желатиновый рацион, дополненный лизином и тритофаном, значительно превосходит зеин-желатиновый рацион без добавок для радужной форели, когда в качестве критериев использовались увеличение веса и использование белка.
Несколько исследователей продемонстрировали возможность добавления белков с дефицитом аминокислот с ограниченным содержанием аминокислот в рационах лососевых. Казеин, дополненный шестью аминокислотами, обеспечивает коэффициент конверсии корма для атлантического лосося, аналогичный коэффициенту, полученному при использовании изолированного рыбьего белка в качестве источника диетического белка.Соевый шрот, обогащенный пятью или более аминокислотами (включая метионин и лизин), был лучшим источником белка по сравнению с одним только соевым шротом для радужной форели. Однако однократное добавление метионина и лизина не улучшало ценность соевого шрота. Эти результаты позволяют предположить, что аминокислотный спектр выделенного белка рыбы, который они использовали, возможно, приближается к потребности в аминокислотах радужной форели. Пищевая ценность изолята соевого белка может быть повышена путем добавления в него первой лимитирующей аминокислоты; я.д., метионин.
Рацион, содержащий в качестве белкового компонента рыбную муку, мясокостную муку, а также дрожжевую и соевую муку, можно улучшить, добавив вместе цистин (10 г/кг) и триптофан (5 г/кг). Рыбная мука может быть полностью заменена без снижения коэффициента конверсии корма в рационах для радужной форели смесью муки из побочных продуктов домашней птицы и перьевой муки вместе с 17 г гидрохлорида лизина/кг, 4,8 г DL-метионина/кг и 1,44 г DL. -триптофан/кг.
Рыбная мука может быть полностью заменена без снижения коэффициента конверсии корма в рационах для радужной форели смесью муки из побочных продуктов домашней птицы и перьевой муки вместе с 17 г гидрохлорида лизина/кг, 4,8 г DL-метионина/кг и 1,44 г DL. -триптофан/кг.
Коуи, К.Б. и Дж. Р. Сарджент, 1972 г. Питание рыб. Adv.Mar.Biol., 10:383-492
Cowey, C.B., 1979 Потребность рыб в белках и аминокислотах. In Питание рыб и технология кормления рыб, под редакцией J.E. Halver и K. Tiews. Материалы Всемирного симпозиума, спонсируемого EIFAC/FAO, ICES и IUNS, Гамбург, 20–23 июня 1978 г. Schr . Bundesforschungsanst . Фиш ., Хамб ., (14/15)т. 1:3-16
Мерц, Э.Т., 1972 Потребности в белках и аминокислотах. В Питание рыб, под редакцией Дж. Э. Халвера. Нью-Йорк, Academic Press, стр. 106–43.
Национальный исследовательский совет, 1977 Подкомитет по тепловодным рыбам, Требования к питательным веществам тепловодных рыб. Вашингтон, округ Колумбия, Национальная академия наук (Потребности домашних животных в питательных веществах) 78 стр.
Вашингтон, округ Колумбия, Национальная академия наук (Потребности домашних животных в питательных веществах) 78 стр.
Белок и тело | Университет штата Оклахома
Опубликовано в апр.2021|Идентификатор: Т-3163
От
Дженис Р. Германн
Белок является питательным веществом
Белок — это питательное вещество, необходимое организму для роста и поддержания себя. Рядом с водой,
Белок является наиболее обильным веществом в нашем организме. Почти все знают, что
мышцы состоят из белка.На самом деле, каждая отдельная клетка в организме содержит некоторое количество белка.
Кроме того, другие важные части тела, такие как волосы, кожа, глаза и органы тела
все сделаны из белка.
Многие вещества, контролирующие функции организма, такие как ферменты и гормоны, также
сделанный из белка. Другие важные функции белка включают формирование клеток крови.
и создание антител для защиты от болезней и инфекций.
Аминокислоты
Белки состоят из более простых веществ, называемых аминокислотами. Существует 20 аминокислот
в белке, который мы едим каждый день. Организм берет эти аминокислоты и связывает их
вместе в очень длинные строки. Вот как организм вырабатывает все разные белки
он должен функционировать должным образом.Девять аминокислот называются незаменимыми , потому что организм не может их вырабатывать. Эти незаменимые аминокислоты должны поступать из продуктов.
Эти незаменимые аминокислоты должны поступать из продуктов.
мы едим.
На рис. 1 представлена схема гормона инсулина, который регулирует уровень глюкозы (сахара) в крови.
Инсулин — очень маленький белок. Многие белки состоят из тысяч аминокислот
связаны вместе.Буквы в кружках — это аббревиатуры аминокислот.
то есть в том месте. Белки могут быть очень сложными из-за всех комбинаций
аминокислот, из которых состоят цепи.
Продукты, содержащие белок
Белки содержатся как в растительной, так и в животной пище.Продукты, которые обеспечивают все необходимое
аминокислоты называют высококачественными белками . Продукты животного происхождения, такие как мясо, рыба, птица, яйца и молочные продукты, являются
Продукты животного происхождения, такие как мясо, рыба, птица, яйца и молочные продукты, являются
высококачественные источники белка. Это продукты, о которых люди обычно думают, когда
хочу есть белок. Незаменимые аминокислоты в продуктах животного происхождения находятся в правильном
остаток средств.
Продукты, которые не обеспечивают хороший баланс всех незаменимых аминокислот, называются
белков более низкого качества.Растительная пища содержит белки более низкого качества. Большинство фруктов и овощей являются
плохие источники белка. Другие растительные продукты, такие как печеная фасоль, горох и чечевица,
арахис и другие орехи, семена и злаки, такие как пшеница, являются лучшими источниками. Они вносят свой вклад
много к нашему потреблению белка. Однако в каждом типе растительного белка мало одного или
Однако в каждом типе растительного белка мало одного или
больше незаменимых аминокислот. Это делает их белком более низкого качества.Животное
Белки содержат лучший баланс незаменимых аминокислот, чем растительные белки.
Люди, которые не едят продукты животного происхождения, должны вместе есть разные виды растительной пищи.
или в течение того же дня, чтобы получить правильный баланс и количество незаменимых аминокислот
их тела нуждаются. Сочетание бобов и риса, или бобов и кукурузы, или арахисового масла и
хлеб обеспечит вас всеми незаменимыми аминокислотами в нужном количестве.Эти продукты
комбинации смешивают продукты из разных групп растений, чтобы дополнить предоставленные аминокислоты
по каждому.
Сочетание продуктов из любых двух из следующих групп растений позволит получить более высокое качество
белок:
- Бобовые , такие как сухие бобы, горох, арахис, чечевица и соевые бобы
- Зерновые , такие как пшеница, рожь, рис, кукуруза, овес и ячмень
- Семена и орехи , такие как семена подсолнечника и тыквы, орехи пекан и грецкие орехи
Сочетание небольшого количества животного белка с большим количеством растительного продукта может
также удовлетворить потребности человека в белке. Таким образом, сочетание небольшого количества любого из следующих
Таким образом, сочетание небольшого количества любого из следующих
продукты животного происхождения с любой из групп растений, перечисленных выше, будут иметь более высокое качество
белок.
- Яйца
- Молочные продукты , такие как молоко, сыр и йогурт
- Мясо , такое как говядина, птица, рыба, баранина и свинина
Рисунок 1 .Аминокислоты в составе белка инсулина.
Другое применение белка
Три основных питательных вещества обеспечивают нас калориями: белки, углеводы и жиры. Каждый грамм
белка и углеводов обеспечивает 4 калории.Белок лучше всего использовать для восстановления
и сохранить ткани тела. Если люди потребляют больше белка, чем им нужно для поддержания тканей
и ремонт, их тела используют его для получения энергии. Если он не нужен для энергии, их
тела используют дополнительный белок, чтобы сделать жир. Затем он становится частью жировых клеток. Если люди
не потребляют достаточно калорий, белок в пище и в их телах будет использоваться для получения энергии.
Если это происходит, белок не используется по своему основному назначению — поддержанию
тело.Получение достаточного количества белка и сбалансированная диета с достаточным количеством калорий
важный. Таким образом, белок будет использоваться для тканей и других функций белка.
Жиры и углеводы будут использоваться для удовлетворения энергетических потребностей.
Потребность в белке
Каждый человек должен есть белок.Сколько белка ему нужно, зависит от его
или ее размер тела и особые потребности, такие как рост. Детям нужно больше белка на фунт
массы тела больше, чем у взрослых, потому что они растут и строят новую белковую ткань.
Беременным и кормящим женщинам требуется больше белка для роста ребенка и выработки
молоко. Диетическое эталонное потребление (DRI) говорит нам о среднем количестве белка.
Диетическое эталонное потребление (DRI) говорит нам о среднем количестве белка.
человек нуждается каждый день.Рассчитайте потребность в белке по формуле 0,8 грамма
белка на каждый килограмм массы тела. Чтобы найти вес в килограммах, разделите вес
в фунтах на 2,2.
Пример :
Вес человека = 165 фунтов
165 фунтов/2.2 фунта
за килограмм
75 кг X 0,8 грамма
за килограмм
Потребность этого человека в белке составляет 60 граммов в день.
Другой простой сокращенный подход — умножить массу тела в фунтах на 0.4. Это
является грубой оценкой, требующей меньшего количества вычислений.
Пример :
165 фунтов X 0,4 = 66 граммов в день.
Важно иметь в виду, что дополнительный белок не дает особых преимуществ.
Люди не откладывают дополнительный пищевой белок в виде мышц тела. Дополнительный белок помимо
ежедневная потребность не сделает дополнительные мышцы или не ускорит рост волос или защитит от
болезни. Белок сверх того, что необходимо, либо расщепляется и используется для получения энергии,
или он превращается в жир и хранится в жировых клетках. Слишком мало белка приведет к
Слишком мало белка приведет к
постепенный распад белковых тканей организма и потеря мышечной ткани.Тело будет
не сможет нормально функционировать в этих условиях.
Наилучший способ удовлетворить потребность в белке – съедать рекомендуемое количество пищи с каждого
из пищевых групп USDA MyPlate Plan. Рекомендуемые суммы по каждому плану USDA MyPlate Plan
Группа продуктов питания каждый день для эталонной диеты на 2000 калорий:
- 6 унций.зерна
- 21/2 чашки овощей
- 2 чашки фруктов
- 3 стакана молочных продуктов
- 5 1/2 унции.
 белковых продуктов
белковых продуктов - 6 чайных ложек масла
В таблице 1 показано содержание белков и жиров в различных распространенных продуктах питания.
Чтобы получить необходимый белок без лишнего жира или насыщенных жиров, выбирайте нежирные куски.
мяса и нежирной рыбы и снять кожу с птицы. Вареные зерна и бобы, горох
а чечевица с низким содержанием жира, если не добавлять жир при приготовлении и стоит недорого
источники белка. Орехи и арахисовое масло являются хорошими источниками белка, но также
с высоким содержанием жира.Яйца также являются недорогим источником белка. Выбирайте обезжиренные молочные продукты
продуктов часто и не добавляйте жир при приготовлении или подаче этих продуктов.
Наблюдая за источниками белка и придерживаясь диеты в соответствии с планом USDA MyPlate Plan, люди
могут быть уверены, что они получают достаточно белка для удовлетворения своих потребностей без
получить лишний жир, который им не нужен.
Таблица 1. Белок в обычных продуктах питания, грамм на порцию
| Еда и порции | Белок | Жир |
|---|---|---|
| Цыпленок, светлое мясо, без кожи 3 унции, приготовленное | 26. 3 3 | 3,0 |
| Жаркое из свинины, 3 унции, приготовленное | 23,9 | 8,9 |
| Цыпленок, темное мясо, 3 унции, приготовленное | 23,3 | 9,3 |
| Говядина, круглый стейк, 3 унции, приготовленный | 22.6 | 4,9 |
| Сыр чеддер, 3 унции | 21,1 | 28,2 |
| Творог с низким содержанием жира 1/2 стакана | 15. 6 6 | 2,2 |
| Молоко обезжиренное, 1 стакан | 8,4 | 0,4 |
| Яйцо, 1 целое | 6,3 | 5,3 |
| Арахисовое масло, 2 столовые ложки | 7. 9 9 | 16,0 |
| Запеченная фасоль, 1/2 стакана | 6,6 | 1,3 |
| Семена подсолнечника, 1/4 стакана | 6,2 | 15,9 |
| Пекан, 1/4 стакана | 2.3 | 20,2 |
| Овсянка, 3/4 стакана | 4,6 | 1,8 |
| Рис 1/2 стакана | 2. 8 8 | 0,3 |
| Цельнозерновой хлеб, 1 ломтик | 2,6 | 1,5 |
| Белый хлеб, 1 горка | 2,5 | 0,9 |
| Яблоко, 1 шт. | 0. 3 3 | 0,5 |
| Зеленая фасоль, 1/2 стакана | 0,9 | 0,1 |
| Брокколи, 1/2 стакана | 2,3 | 0,1 |
Каталожные номера
Уитни, Э.Н. и Рольфес, С.Р. (2015) Понимание питания , 14-е изд. Wadsworth Cengage Learning, Белмонт, Калифорния.




 5 унций содержат 10 г
5 унций содержат 10 г
 9 (1,7/42)
9 (1,7/42) 5 (0,2/13)
5 (0,2/13) 1 (1.1/18)
1 (1.1/18) 6 (0,45/13)
6 (0,45/13) 5 (0,2/40)
5 (0,2/40)
 белковых продуктов
белковых продуктов