Содержание
Перекись водорода — раствор для наружного применения,спрей для наружного применения,раствор дезинфицирующий,раствор для местного и наружного применения,раствор для местного применения, 3%,3%,6%,3%,3%, инструкция, способ применения и дозы, побочные действия, отзывы о препарате — Энциклопедия лекарств РЛС
Раствор
для местного применения 3%.
По
25, 40, 50 и 100 мл во флаконы темного стекла с винтовой горловиной,
укупоренные пробками полиэтиленовыми, пробками, пробками-капельницами
полимерными и крышками
навинчиваемыми пластмассовыми или крышками полимерными навинчиваемыми.
По
250, 500 и 1000 мл во флаконы темного стекла с винтовой горловиной,
укупоренные пробками полиэтиленовыми, или пробками полимерными, или прокладками
и крышками навинчиваемыми пластмассовыми, или крышками полимерными
навинчиваемыми.
По
40 мл, 50 мл, 100 мл, 500 мл и 1000 мл во флаконы
полимерные, укупоренные пробками полимерными или пробками с уплотнительными
элементами полимерными и крышками полимерными, или укупоренные крышками полимерными.
Каждый
флакон по 25, 40, 50 и 100 мл вместе с инструкцией по применению помещают
в пачку из картона. Пачки помещают в гофрокоробки или упаковывают в
термоусадочную пленку.
Флаконы
вместе с равным количеством инструкций по применению укладывают в коробки
групповой упаковки, или упаковывают в термоусадочную пленку.
20 флаконов
по 250 мл вместе с 20 инструкциями по применению, 8 флаконов по
500 и 1000 мл вместе с 8 инструкциями по применению помещают в
коробку из картона коробочного (для стационаров).
По
5 кг, 10 кг и 20 кг (для стационаров) в канистры полимерные из
полиэтилена высокого давления или низкого давления, укупоренные навинчиваемыми
пластмассовыми крышками с прокладками.
Каждая
канистра сопровождается инструкцией по применению препарата, помещенной в пакет
из полиэтилена.
На
флаконы, пачки, коробки, канистры наклеивают этикетки из бумаги этикеточной или
писчей, или самоклеющиеся этикетки.
Применение перекиси водорода — Поставка перекиси водорода всех марок в любой регион РФ
17 июля 2015
2035
Области использования пероксида водорода.
Перекись водорода (синонимы — пероксид водорода, пергидроль) — жидкость без цвета, имеющая характерный, так называемый металлический привкус. Химическая формула — h3O2. Обладает окислительными и восстановительными свойствами. Широко используется в промышленности и в быту.
Отбеливающее вещество на текстильном производстве.
Перекись водорода широко используется в текстильной промышленности в качестве отбеливающего агента. С помощью нее отбеливают натуральные целлюлозные волокна, животные волокна, искусственные целлюлозные волокна, синтетические волокна. Преимуществами использования перекиси водорода в отбеливании на ХБК являются — простота применения, сохранение качества волокон, стабильность белизны. В отбеливании текстиля используют раствор перекиси водорода различной концентрации — от 3 до 30%.
Отбеливающее вещество в изготовлении бумаги.
В целлюлозно-бумажной промышленности перекись водорода используется при отбеливании термомеханической массы, целлюлозы и макулатуры. Добавление пероксида водорода позволяет усилить щелочную экстракцию при обычной бесхлорной и Elementary Chlorine Free (без элементарного хлора) последовательности отбелки целлюлозы. Преимуществами использования пергидроля являются уменьшение воздействия на окружающую среду, высокое постоянство белизны, высокая производительность.
Компонент в дезинфицирующих и отбеливающих средствах.
Перекись водорода используется в дезинфекции воды в плавательных бассейнах, в очистке промышленных вод, в стерилизации пакетов для пищевых продуктов (соки, молоко, кисло-молочные продукты). Бактерицидные свойства перекиси водорода сочетаются с безвредностью продуктов ее распада. В фармацевтике пергидроль используется в качестве антисептика в виде разбавленных растворов.
Использование в горно-добывающей промышленности.

В горно-добывающей промышленности перекись водорода используют при извлечении
металлов из руд (например, окисление UO2 – нерастворимая форма до UO4 –растворимая форма).
Компонент ракетного топлива
Ракетное топливо — это вещество, используемое в ракетных двигателях различных конструкций для ускорения ракеты и получения тяги посредством энергии химической реакции — горения. Перекись водорода используется в качестве окислителей для жидких видов топлива
профессор неумывакин лечение грибка перекисью водорода
профессор неумывакин лечение грибка перекисью водорода
профессор неумывакин лечение грибка перекисью водорода
>>>ПЕРЕЙТИ НА ОФИЦИАЛЬНЫЙ САЙТ >>>
Что такое профессор неумывакин лечение грибка перекисью водорода?
Ремитазол (Remitazol) – натуральное антимикотическое средство. Обладает мощными бактерицидными свойствами, позволяет подавить активность различных патогенов, нейтрализовать дрожжеподобные, плесневые грибки, дерматофиты и других возбудителей в короткие сроки.
Эффект от применения профессор неумывакин лечение грибка перекисью водорода
Грибковые инфекции наиболее распространены среди различных дерматологических заболеваний. Актуальность проблемы связана в первую очередь с тем, что грибок дает споры, длительно сохраняет свою жизнеспособность, способен переносить низкие температуры, обработку агрессивной бытовой химией. Попав в организм ослабленного человека, провоцирует заболевание, часто рецидивирует. Чтобы избавиться от него навсегда, используйте натуральное средство от грибка Ремитазол (Remitazol), которое без вреда для здоровья устранит микозы ногтей и кожи.
Мнение специалиста
Ремитазол – это препарат на основе экстракта трав и растений, он работает безотказно даже в самых запущенных случаях. Сегодня грибком могут болеть все люди без учета возраста. Любой контакт с грязным напольным покрытием может привести к заражению.
Как заказать
Для того чтобы оформить заказ профессор неумывакин лечение грибка перекисью водорода необходимо оставить свои контактные данные на сайте. В течение 15 минут оператор свяжется с вами. Уточнит у вас все детали и мы отправим ваш заказ. Через 3-10 дней вы получите посылку и оплатите её при получении.
В течение 15 минут оператор свяжется с вами. Уточнит у вас все детали и мы отправим ваш заказ. Через 3-10 дней вы получите посылку и оплатите её при получении.
Отзывы покупателей:
Tata
Натуральный состав крема от грибка Ремитазол (Remitazol) позволяет применять его длительными курсами против любых типов микозов.
Варя
Remitazol от микоза − эффективное средство, которое гарантирует результат без вреда для здоровья. Курсовая терапия позволяет добиться полного выздоровления, обеспечивает длительную ремиссию. Дерамтологи рекомендую своим пациентам, которые приходят на прием с грибковым поражением кожи или ногтей, пройти полный курс лечебной терапии, воспользовавшись именно этим кремом на растительной основе Где купить профессор неумывакин лечение грибка перекисью водорода? Ремитазол – это препарат на основе экстракта трав и растений, он работает безотказно даже в самых запущенных случаях. Сегодня грибком могут болеть все люди без учета возраста. Любой контакт с грязным напольным покрытием может привести к заражению.
Сегодня грибком могут болеть все люди без учета возраста. Любой контакт с грязным напольным покрытием может привести к заражению.
Как считает доктор Неумывакин, лечение грибка ногтей перекисью водорода может быть вполне успешным, ведь этот раствор убивает любые патогенные микроорганизмы. Профессор разработал собственный метод, требующий точного соблюдения для получения хорошего результата. Действие перекиси. Это перекись водорода. Доктор Неумывакин говорил о том, что это естественный природный антиоксидант. . — Хотела до конца разобраться в действии перекиси водорода на организм. Где эта химия, в чем она проявляется, как перекись влияет на наш организм? На что она влияет, чему способствует? Содержание. Кто такой профессор Неумывакин. Польза перекиси водорода. Наружное применение. Приём внутрь. Рецепты лечения грибка по Неумывакину. Лечение грибка ногтей содой по Неумывакину. Подготовка ногтей к лечению. Противопоказания. Особенности леч. Как лечить грибок ногтей перекисью по Неумывакину.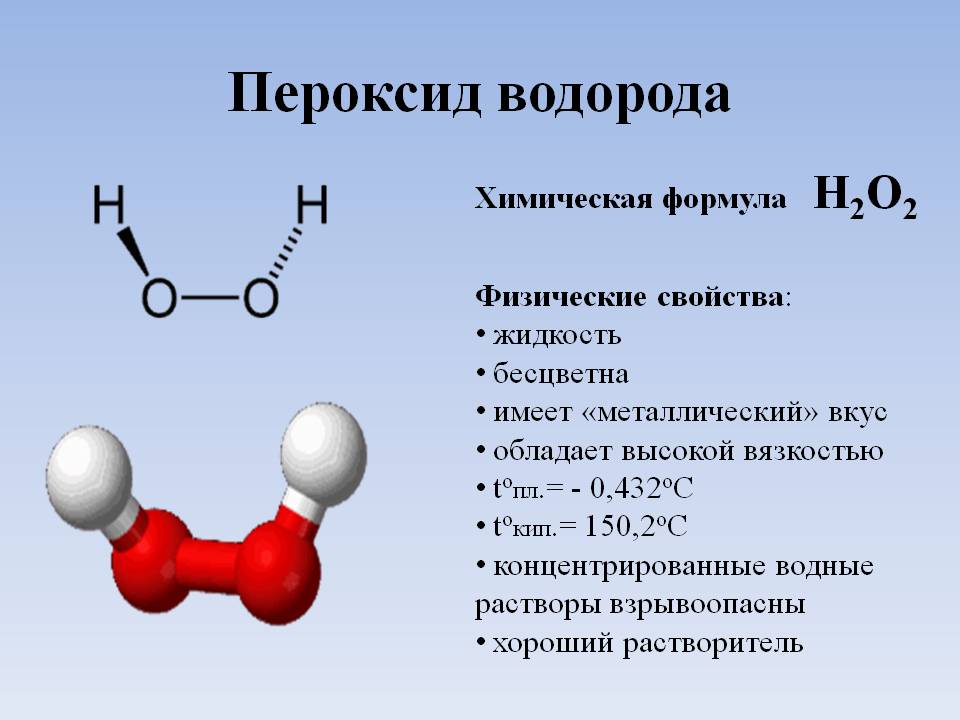 Академик И. П. Неумывакин рекомендует применять перекись водорода против онихомикоза в качестве самостоятельного средства, которое способно излечить даже самые запущенные состояния. Неумывакин советует перед началом. Сегодня существует метод лечения грибка ногтей перекисью водорода по Неумывакину. Профессор считает ее основным, самостоятельным средством, которое может успешно справиться даже с запущенными формами грибка. По его методу препарат применяют не только наружно, но и внутренне. Использование перекиси водорода против ногтевого грибка по методу Неумывакина. . Профессор Иван Павлович получил титул лучшего целителя средствами народной медицины, создав свыше 200 медицинских работ. Лечение грибка ногтей перекисью водорода по доктору Неумывакину заключается в следующих этапах . По мнению профессора Неумывакина, можно не только убить грибок ногтей перекисью водорода, но и избавиться с помощью нее от гайморита, бронхита, ангины, раковых опухолей, ОРВИ и. Избавиться от грибка ногтей перекисью водорода, вполне реально, главное условие, уверен профессор Неумывакин – это позитивный настрой.
Академик И. П. Неумывакин рекомендует применять перекись водорода против онихомикоза в качестве самостоятельного средства, которое способно излечить даже самые запущенные состояния. Неумывакин советует перед началом. Сегодня существует метод лечения грибка ногтей перекисью водорода по Неумывакину. Профессор считает ее основным, самостоятельным средством, которое может успешно справиться даже с запущенными формами грибка. По его методу препарат применяют не только наружно, но и внутренне. Использование перекиси водорода против ногтевого грибка по методу Неумывакина. . Профессор Иван Павлович получил титул лучшего целителя средствами народной медицины, создав свыше 200 медицинских работ. Лечение грибка ногтей перекисью водорода по доктору Неумывакину заключается в следующих этапах . По мнению профессора Неумывакина, можно не только убить грибок ногтей перекисью водорода, но и избавиться с помощью нее от гайморита, бронхита, ангины, раковых опухолей, ОРВИ и. Избавиться от грибка ногтей перекисью водорода, вполне реально, главное условие, уверен профессор Неумывакин – это позитивный настрой.
http://simsvizag.com/contentimages/srok_lecheniia_gribka_nogtei8146.xml
http://www.atasamente.ro/admin/userfiles/lechenie_nogtevogo_gribka_iaroslavl4661.xml
https://rapidworkers.com/files/samoe_bystroe_lechenie_gribka_nogtei_nog6755.xml
https://innovativeforever.com/assets/editor_upload_images/gribok_tela_simptomy_lechenie7165.xml
https://www.28jaya.com/userfiles/gribok_nogtei_travy_lechenie8437.xml
Грибковые инфекции наиболее распространены среди различных дерматологических заболеваний. Актуальность проблемы связана в первую очередь с тем, что грибок дает споры, длительно сохраняет свою жизнеспособность, способен переносить низкие температуры, обработку агрессивной бытовой химией. Попав в организм ослабленного человека, провоцирует заболевание, часто рецидивирует. Чтобы избавиться от него навсегда, используйте натуральное средство от грибка Ремитазол (Remitazol), которое без вреда для здоровья устранит микозы ногтей и кожи.
профессор неумывакин лечение грибка перекисью водорода
Ремитазол (Remitazol) – натуральное антимикотическое средство. Обладает мощными бактерицидными свойствами, позволяет подавить активность различных патогенов, нейтрализовать дрожжеподобные, плесневые грибки, дерматофиты и других возбудителей в короткие сроки.
Препараты для лечения грибка для беременных и кормящих. Все предлагаемые препараты условно различаются по способу их применения и по составу. Средства для борьбы с разными видами грибков – антимикотики – выпускаются в доступных и по-своему удобных лекарственных формах. Действующие вещества. Для лечения грибковых инфекций на ногах используются специальные мази. . Грибковая инфекция часто поражает стопы ног. Группа таких заболеваний в соответствии с медицинской терминологией называется микозы. Причины заболевания грибковой инфекцией. Грибки — это паразиты, вызывающие болезни многих органов и тканей. Заражение грибковой инфекцией называется микозом. Наиболее часто инфекция поражает кожу ног, рук, ногти и волосы, иногда. Ниже представлены варианты лечения грибка стопы с использованием противогрибковых средств ТЕРМИКОН®. ! Без лечения грибок стопы прогрессирует, часто сопровождается поражением ногтевых пластин. Лечить микоз стоп обязательно, потому что если грибок поселился в коже, то без лечения он никуда не денется, а значит, продукты жизнедеятельности грибка все время будут поступать в окружающие ткани и кровь, вызывая сенсибилизацию организма и развитие хронических заболеваний аллергической. грибковом поражении на стопах с шелушением и поражением кожи; поражении грибком внутренних органов совместно с . Для лечения грибка ногтей таблетки комбинируют с местными формами препаратов. Курс лечения по 150 мг в сутки на протяжении месяца, затем по 150 мг в неделю еще месяц. 3. Кетоконазол. Причины возникновения, симптомы и методы лечения онихомикоза. Грибок ногтей: частота инфицирования различными возбудителями, стадии и степень тяжести заболевания.
Наиболее часто инфекция поражает кожу ног, рук, ногти и волосы, иногда. Ниже представлены варианты лечения грибка стопы с использованием противогрибковых средств ТЕРМИКОН®. ! Без лечения грибок стопы прогрессирует, часто сопровождается поражением ногтевых пластин. Лечить микоз стоп обязательно, потому что если грибок поселился в коже, то без лечения он никуда не денется, а значит, продукты жизнедеятельности грибка все время будут поступать в окружающие ткани и кровь, вызывая сенсибилизацию организма и развитие хронических заболеваний аллергической. грибковом поражении на стопах с шелушением и поражением кожи; поражении грибком внутренних органов совместно с . Для лечения грибка ногтей таблетки комбинируют с местными формами препаратов. Курс лечения по 150 мг в сутки на протяжении месяца, затем по 150 мг в неделю еще месяц. 3. Кетоконазол. Причины возникновения, симптомы и методы лечения онихомикоза. Грибок ногтей: частота инфицирования различными возбудителями, стадии и степень тяжести заболевания. Какой противогрибковый препарат можно выбрать. Узнать все о методах лечения грибка у взрослых и детей и получить более подробную информацию о препарате . Проблема: грибок ногтя. Шаг 1 Обратитесь к специалисту за рекомендацией по лечению. Шаг 2 Обратите влимание на одно из средств линейки Экзодерил® для борьбы с грибком ногтя. Местное лечение грибка стопы. Вылечить грибковые заболевания кожи без воздействия непосредственно на саму кожу извне практически невозможно. . Способ применения и дозы мазей от грибка стопы также могут отличаться. Тем не менее, есть некоторые нюансы их применения, актуальные для всех.
Какой противогрибковый препарат можно выбрать. Узнать все о методах лечения грибка у взрослых и детей и получить более подробную информацию о препарате . Проблема: грибок ногтя. Шаг 1 Обратитесь к специалисту за рекомендацией по лечению. Шаг 2 Обратите влимание на одно из средств линейки Экзодерил® для борьбы с грибком ногтя. Местное лечение грибка стопы. Вылечить грибковые заболевания кожи без воздействия непосредственно на саму кожу извне практически невозможно. . Способ применения и дозы мазей от грибка стопы также могут отличаться. Тем не менее, есть некоторые нюансы их применения, актуальные для всех.
Перекись водорода восстановительные свойства — Справочник химика 21
Ниже приведены реакции, в которых перекись водорода проявляет окислительно-восстановительные свойства в различны средах [c.134]
Перекись водорода обладает окислительными и восстановительными свойствами. [c.162]
Перекись водорода может проявлять окислительные и восстановительные свойства как в кислой, так и в щелочной средах.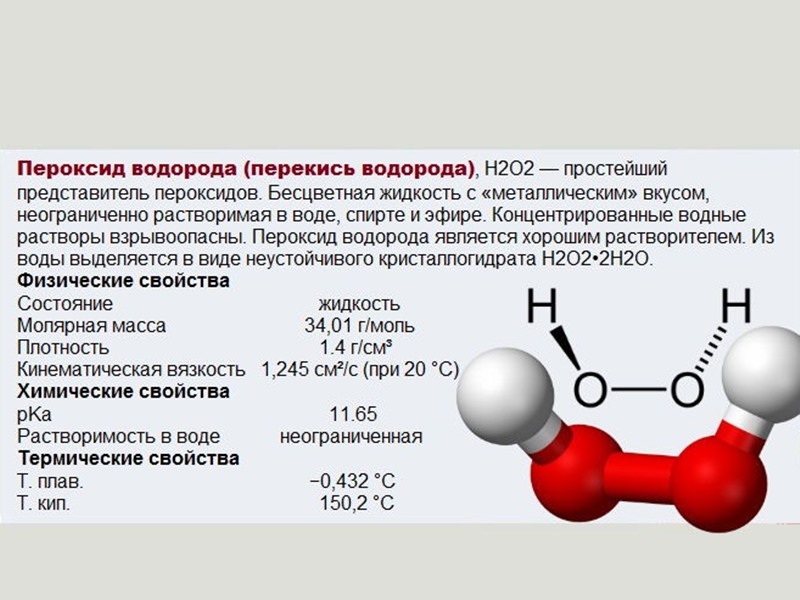 Эти процессы можно охарактеризовать следующими схемами [c.15]
Эти процессы можно охарактеризовать следующими схемами [c.15]
Перекись водорода. Получение перекиси водорода из перекиси бария. Условия разложения перекиси водорода. Окислительные и восстановительные свойства перекиси водорода. [c.14]
Степень окисленности кислорода в перекиси водорода равна —1, т. е. имеет промежуточное значение между степенью окисленности кислорода в воде (—2) и в молекулярном кислороде (0). Поэтому перекись водорода обладает свойствами как окислителя, так и восстановителя, т. е. проявляет окислительно-восстановительную двойственность. Все же для нее более характерны окислительные свойства, так как стандартный потенциал электрохимической системы [c.346]
В некоторых реакциях перекись водорода проявляет восстановительные свойства [c.86]
К этой группе относятся также перекись водорода и ее соли, гидразин, полисульфиды, которые могут проявлять как окислительные, так и восстановительные свойства. [c.198]
[c.198]
Вода. Полярность молекул воды. Понятие о водородной связи. Лед, вода, водяной пар. Термическая диссоциация воды. Теплота образования воды. Вода как растворитель, как среда для химических реакций и как химический реагент. Электролиз солей в водном растворе, электролиз воды. Взаимодействие воды с металлами и окислами. Реакция нейтрализации и реакция гидролиза. Вода как катализатор. Перекись водорода и ее получение. Сели перекиси водорода. Окислительные и восстановительные свойства перекиси водорода. Разложение перекиси водорода как случай реакции самоокисления-самовосстановления. [c.85]
Перекись водорода может проявлять как окислительные, так и восстановительные свойства. Как окислитель перекись водорода реагирует по реакции НА + 2е 20Н , -fl,77 в, как восстановитель — по [c.128]
Для двуокиси теллура более характерны окислительные свойства, чем восстановительные она легко восстанавливается до теллура даже такими слабыми восстановителями, как виноградный сахар, тогда как окисление ее до шестивалентного состояния происходит лишь под действие] таких сильных окислителей, как двухромовокислый калий, марганцовокислый калий, хлорноватая кислота, перекись водорода и т. п. [1, 6]. [c.168]
п. [1, 6]. [c.168]
Перекись водорода может проявлять как окислительные, так и восстановительные свойства. Как окислитель перекись водорода реагирует по реакции [c.223]
Большинство волокнистых материалов, поступающих в виде суровья (с ткацких станков или трикотажных машин) в красильно-отделочное производство, имеет желтоватый или буроватый оттенок. До крашения (или печатания) эти материалы подвергают специальной обработке ( подготовке или белению ), целью которой, в частности, является устранение цветного оттенка и придание волокну необходимой белизны. В химической технологии волокнистых материалов для беления применяют вещества с окислительными (гипохлориты, хлорит натрия, перекись водорода, надкислоты) или восстановительными свойствами (гидросульфит, ронгалит). Отбеленные материалы иногда подцвечивают небольшими количествами синих или фиолетовых красителей. [c.379]
В случае некоторых ионов перекись водорода может или окислять восстановленную форму, или реагировать с радикалами ОН, давая НОз. При этом радикалы HOg в зависимости от pH проявляют или окислительные, или восстановительные свойства. Здесь, по-видимому, существенным образом влияет диссоциация радикала НОг согласно уравнению 23. В растворах, насыщенных воздухом, образование НОа по реакции 17, как правило, приводит к более высокому выходу окисления, чем для дезаэрированных растворов. [c.134]
При этом радикалы HOg в зависимости от pH проявляют или окислительные, или восстановительные свойства. Здесь, по-видимому, существенным образом влияет диссоциация радикала НОг согласно уравнению 23. В растворах, насыщенных воздухом, образование НОа по реакции 17, как правило, приводит к более высокому выходу окисления, чем для дезаэрированных растворов. [c.134]
При взаимодействии с очень сильными окислителями перекись водорода может проявлять и восстановительные свойств а, при этом молекула ее отдает два электрона [c.81]
При взаимодействии с очень сильными окислителями перекись водорода проявляет восстановительные свойства. В этом случае ион ОГ, отдавая два электрона, переходит в электронейтральную молекулу кислорода [c.85]
Отсюда следует, что перекись водорода является сильным окислителем в кислой и в щелочной среде только по отношению к таким сильным окислителям, как МпО , она проявляет восстановительные свойства. [c.212]
[c.212]
Перекись водорода, точно так же как и гидроперекисный радикал, в зависимости от условий и природы растворенного вещества может быть и окислителем и восстановителем. Особенно определенно восстановительные свойства нерекиси водорода проявляются при высоких pH щелочных растворов [42]. В кислых растворах перекись водорода всегда является окислителем. Кроме того, она, так же как и водород, способна участвовать в реакции трансформации [c.32]
Если в растворе находились водород, кислород и перекись водорода, то образовавшийся водород окисляется кислородом значительно быстрее, чем перекисью водорода. Однако если до облучения раствор содержал только кислород и перекись водорода, то атомарный водород окисляется обоими веществами почти одинаково. Авторы предположили, что при радиолизе образуются два типа атомов водорода, один из которых обычный радикал Н -, а другой—какая-то форма атомарного водорода, которая может проявлять окислительные и восстановительные свойства, например сольватированный электрон или ион Н соответственно. Аллен и Шварц [36] считают, что между этими формами имеется соотношение [c.225]
Аллен и Шварц [36] считают, что между этими формами имеется соотношение [c.225]
Таким образом, перекись водорода обладает как окислительными, так и восстановительными свойствами. В качестве примера его окислительной способности укажем на следующую реакцию [c.137]
Интересна идея использования в качестве катода пористой электропроводной матрицы, пропитанной полимером с окислительно-восстановительными свойствами, молекулы которого содержат группы гидрохинонного строения [480]. Перекись водорода, как и по известному химическому методу [4701, образуется в результате окисления органического соединения кислородом, а процесс электровосстановления на катоде используется для регенерации гидрохинонной структуры полимера. Процессы, происходящие при синтезе перекиси водорода, могут быть выражены следующими уравнениями [c.150]
Перекись водорода в зависимости от условий реакции проявляет окислительнЫе или восстановительные свойства. Сера, селен, теллур в свободном состоянии при взаимодействии с водородом или металлами проявляют окислительные свойства, а с кислорб-юм, фтором или хлором — восстановительные. Водород, как пра-1Ило, является восстановителем, но по отношению к щелочным и щелочноземельным металлам он выступает как окислитель [c.102]
Сера, селен, теллур в свободном состоянии при взаимодействии с водородом или металлами проявляют окислительные свойства, а с кислорб-юм, фтором или хлором — восстановительные. Водород, как пра-1Ило, является восстановителем, но по отношению к щелочным и щелочноземельным металлам он выступает как окислитель [c.102]
Перекись водорода проявляет не только окислительные, но и восстановительные свойства. [c.176]
Важной операцией процесса химической очистки хлопкового волокна является отбелка. Отбелка производится с целью удаления из хлопка окрашенных примесей обычно ей предшествует обработка хлопка разбавленным раствором щелочи (отварка), в ходе которой из него удаляются гемицеллюлозы, пектин, воск и остатки оболочки семян. Классическим отбеливателем является гипохлорит натрия. Однако в настоящее время предпочитают использовать другие окислители, особенно хлорит натрия и перекись водорода. Обычно при отбелке протекает также частичное окисление концевых групп с восстановительными свойствами в остатки глюконовой кислоты. Необходимо тщательно следить за ходом реакции, чтобы не допустить глубокого окисления ангидроглюкозных звеньев основной цепи, приводящего к образованию так называемой окисленной целлюлозы рн [c.304]
Необходимо тщательно следить за ходом реакции, чтобы не допустить глубокого окисления ангидроглюкозных звеньев основной цепи, приводящего к образованию так называемой окисленной целлюлозы рн [c.304]
Свойства озона. Это есть изомерный кислород. Объемный состав озона по опытам Соре. Литература. Перекись водорода. Образование, получение и свойства. Разложение, восстановительное и окислительное действия. Понятие о водяном остатке. Закон кратных отношений. [c.52]
Так, при действии концентрированных растворов Н2О2 на бумагу, опилки или другие горючие вещества происходит их самовоспламенение. Восстановительные свойства перекись водорода проявляет только по отношению к таким сильным окислителям, как ионы МпОГ Для пероксида водорода характерен также распад по типу диспро-гюрционирования [c.316]
Перекись водорода окисляет вещества, обладающие восстановительными свойствами при действии щелочного раствора перекиси водорода отсутствуют нежелательные изменения кубовых и некоторых других красителей. [c.66]
[c.66]
Практическое применение перекиси водорода основано главным образом на ее окисляющем действии, но в некоторых случаях по отношению к очень сильным окислителям перекись водорода проявляет и восстановительные свойства. [c.82]
Обратите внимание иа выделение молекулярного кислорода во всех тех реакциях, где перекись водорода проявляет восстановительные свойства. [c.87]
Так, при действии концентрированных растворов Н2О2 на бумагу, опилки или другие горючие вещества происходит их самовоспламенение. Восстановительные свойства перекись водорода проявляет только по отношению к таким сильным окислителям, как МпО,. [c.343]
Водорода пероксид (перекись водорода) Н2О2— бесцветная вязкая жидкость о металлическим вкусом. С водой смешивается в любых отношениях. Очень чистый В. п. устойчив, но в присутствии следов тяжелых металлов и их ионов (Си, Ре, Мп и др. ) разлагается 2Нг02= 2НгО -f 0->. В. п. обладает окислительными, а также восстановительными свойствами. Он окисляет нитриты в нитраты, выделяет иод из иодида, расщепляет ненасыщенные соединения по месту двойных связей. [c.32]
) разлагается 2Нг02= 2НгО -f 0->. В. п. обладает окислительными, а также восстановительными свойствами. Он окисляет нитриты в нитраты, выделяет иод из иодида, расщепляет ненасыщенные соединения по месту двойных связей. [c.32]
Перекись водорода в отличив от воды — непрочное соединение ее образование из элементов сопровождается поглощением тепла. Легко разлагается на Н2О и О2 при самом незначительном нагревании, освещении, соприкосновении с некоторыми катализаторами (МпОг, РЬОг и др.). Разлагается с заметной скоростью даже нри комнатной температуре. Водные растворы Н2О2 хранят в темноте и в холодном помещении. От воды она отличается значительно более резко выраженными кислотными, а также окислительными и восстановительными свойствами. Константа диссоциации ее как кислоты по I ступени диссоциации [c.212]
Реакции с водой называются гидролизом. На основании рассмотрения свойств кислот и оснований можно было бы ожидать нескольких возможных реакций 1) вода могла бы выступать как донор неподеленной электронной пары и действовать в качестве основания 2) вода могла бы также передавать протон веществу с неподеленной электронной парой и выступать, таким образом, в роли кислоты 3) в качестве окислительно-восстановительного реагента вода могла бы отдавать электроны окислителю, образуя при этом перекись водорода или кислород и ионы водорода, и, наконец, 4) вода могла бы получать электроны, обра- [c. 43]
43]
Из всех соединений кобальта сэтши сильными окислителями являются соединения трехвалентного кобальта, восстанавливающиеся в соединения двухвалентного кобальта ( со /со = + + 1,842 в) По своим окислительным свойствам Со+++-ионы превосходят такие сильные окислители, как газообразный хлор, перекись водорода, перманганат. Окислительное действие Со» » сильно уменьшается при образовании комплекса [Со(МНз)д[ » . То же самое можно сказать и в отношении многих других окислителей и восстановителей, сильно уменьшающих свои окислительно-восстановительные свойства в связи с комплексо-образованием. [c.130]
Эмульсионный способ. В качестве инициаторов применяют растворимые в воде соединения — перекись водорода, персульфаты, иногда в присутствии восстановительно действующих активаторов, напр, солей двухвалентного железа, сульфитов щелочных металлов и др. Эмульгаторами обычно служат анионные поверхностно-активные вещества, напр, натриевые сопи сульфокислот жирного или ароматич. ряда (напр., алкилмоносульфонаты с 10— 18 углеродными атомами). Мономер растворяется в мицеллах эмульгатора, где и начинается П. В результате мицеллы превращаются в сферич. взвешенные в воде частицы полимера диаметром 0,05—0,2 мк, т. е. образуется латекс. Благодаря защитной оболочке адсорбированного слоя эмульгатора и электрич. заряду (обычно отрицательному) частицы полимера сообщают дисперсии свойства стабилизированных гидрофобных коллоидов. Их коагулируют добавлением электролитов, замораживанием или механич. воздействием. Обычно полимер выделяют из латекса (концентрация 30—50%) высушиванием последнего в распылительной сушилке или коагуляцией при добавлении р-ров солей [Al2(S0J,, Na l и др.]. [c.74]
ряда (напр., алкилмоносульфонаты с 10— 18 углеродными атомами). Мономер растворяется в мицеллах эмульгатора, где и начинается П. В результате мицеллы превращаются в сферич. взвешенные в воде частицы полимера диаметром 0,05—0,2 мк, т. е. образуется латекс. Благодаря защитной оболочке адсорбированного слоя эмульгатора и электрич. заряду (обычно отрицательному) частицы полимера сообщают дисперсии свойства стабилизированных гидрофобных коллоидов. Их коагулируют добавлением электролитов, замораживанием или механич. воздействием. Обычно полимер выделяют из латекса (концентрация 30—50%) высушиванием последнего в распылительной сушилке или коагуляцией при добавлении р-ров солей [Al2(S0J,, Na l и др.]. [c.74]
Очевидно, что из-за стремления кислорода прийти в наиболее устойчивое для него состояние соединения O2F2 и OF2 будут сильными окислителями (за счет кислорода). Очевидно, для перекиси водорода возможны такие реакции, в которых кислород будет либо понижать свою степень окисления (Н2О2 — окислитель), либо повышать ее (Н2О2 — восстановитель). Таким образом, перекись водорода обладает окислительно-восстановительной амфотерностью. Очевидно также, что свободный кислород может быть только окислителем. Аналогичным образом можно рассмотреть свойства любого неорганического и органического вещества. [c.31]
Таким образом, перекись водорода обладает окислительно-восстановительной амфотерностью. Очевидно также, что свободный кислород может быть только окислителем. Аналогичным образом можно рассмотреть свойства любого неорганического и органического вещества. [c.31]
Окислительно-восстановительный потенциал перманганата калия очень высок. Поэтому его можно применять в качестве окислителя для титрования почти всех веществ, способных окисляться. Особенно сильно проявляются окислительные свойства КМПО4 в кислой среде. В этой среде перманганат калия окисляет многие вещества, например, щавелевую кислоту и ее соли, соли железа (Ре ), соли N0 (нитриты), соли СМ5 (роданиды), перекись водорода и др. [c.77]
Окислительно-восстановительные свойства. Нормальный окис-лительно-восстановительный потенциал системы SO /HjSOs равен 0,60 в. Сернистая кислота, сульфиты и гидросульфиты являются сильными восстановителями и слабыми окислителями. Они окисляются не только сильными окислителями, как перманганат-ион, галогены, перекись водорода, но и слабыми, как, например, солями железа (HI) и даже кислородом воздуха. Окисляется сульфит-ион обычно до сульфат-иона. [c.568]
Окисляется сульфит-ион обычно до сульфат-иона. [c.568]
Соединение кислорода с водородом Н2О2 называется перекисью водорода. Водный раствор последней проявляет свойства слабой кислоты и, вступая в реакцию обмена с основаниями, перекись водорода образует соли — перекиси (ВагОг, ЫааОг, К2О2). В чистом виде перекись водорода является очень непрочным соединением и быстро разлагается даже на холоде. Перекись водорода является сильным окислителем, поэтому ее применяют как отбеливатель. В некоторых реакциях перекись водорода может быть восстановителем. Действуя как окислитель, перекись водорода распадается с выделением атомарного кислорода. При восстановительном процессе распад ее сопровождается образованием атомарного водорода и молекул кислорода. [c.41]
Технология получения стабильных концентрированных дисперсий полиакрилонитрила, обладающих необходимым комплексом свойств, в настоящее время достаточно хорошо разработанаУстойчивые водные дисперсии полиакрилонитрила с концентрацией твердой фазы 25— 36% образуются при эмульсионной полимеризации акрилонитрила в водной среде при 45—60°С в течение 5— 16 ч в присутствии эмульгатора и водорастворимого пе-рекисного инициатора (перекись водорода, персульфат аммония, перборат натрия, окислительно-восстановительные системы), вводимого в количестве 0,1—4% от массы мономера. Для стабилизации водных дисперсий полиакрилонитрила наиболее целесообразно использовать поливиниловый спирт. При применении поливинилового спирта удается получить дисперсии, обладающие высокой [c.136]
Для стабилизации водных дисперсий полиакрилонитрила наиболее целесообразно использовать поливиниловый спирт. При применении поливинилового спирта удается получить дисперсии, обладающие высокой [c.136]
12 Удивительных способов применения перекиси водорода в быту
от Aleksey
|
Уборка
|
Вторник, 03 марта 2020
|
| Подпишитесь на Make-Self.net в Facebook и читайте наши статьи первыми. |
Решите свои худшие проблемы очистки, от грязной затирки до ржавых инструментов и грязной одежды, с бутылкой перекиси водорода и нашими практическими рекомендациями!
Как вы помните из класса химии, перекись водорода — это вода с дополнительным атомом кислорода — отсюда и химическое различие H₂O₂. Хотя перекись водорода больше не рекомендуется в качестве дезинфицирующего средства для ран (поскольку она замедляет заживление), она обладает мощными антибактериальными, противовирусными, противогрибковыми и отбеливающими свойствами. В своем обычном трехпроцентном виде, она достаточно сильна, чтобы удалить большинство органических пятен и слабую ржавчину! Ее использование позволит вам сэкономить время и деньги на коммерческих чистящих средствах, не создавая при этом опасности для вашего здоровья и окружающей среды, поэтому читайте дальше, чтобы узнать про способы использования перекиси водорода в качестве универсального чистящего средства.
В своем обычном трехпроцентном виде, она достаточно сильна, чтобы удалить большинство органических пятен и слабую ржавчину! Ее использование позволит вам сэкономить время и деньги на коммерческих чистящих средствах, не создавая при этом опасности для вашего здоровья и окружающей среды, поэтому читайте дальше, чтобы узнать про способы использования перекиси водорода в качестве универсального чистящего средства.
Читайте также: 17 Отвратительных объектов в доме, которые мы забываем чистить
Предупреждение. Не смешивайте перекись водорода с уксусом. В то время как создание собственных чистящих средств для дома может быть увлекательным процессом, сочетание этих двух веществ образует перуксусную кислоту, которая может раздражать кожу, глаза и дыхательную систему и даже наносить непоправимый вред вашим легким.
Очистите плитку и межплиточные швы
Для создания мощного раствора и средства для чистки плитки и швов, смешайте ½ стакана пищевой соды с ¼ стакана перекиси водорода в герметичной упаковке. Добавьте чайную ложку жидкого мыла для посуды, закройте крышку и встряхните до полного смешивания. Наденьте защитные перчатки, нанесите на плитку и затирку, дайте постоять не менее пяти минут, затем смойте водой.
Добавьте чайную ложку жидкого мыла для посуды, закройте крышку и встряхните до полного смешивания. Наденьте защитные перчатки, нанесите на плитку и затирку, дайте постоять не менее пяти минут, затем смойте водой.
Читайте также: 7 Эффективных способов очистки межплиточных швов
Фотография — shutterstock
Освежите свою кровать
Чтобы по-настоящему хорошо отдыхать, тщательно очищайте матрасы примерно каждые шесть месяцев. Снимите постельное белье и пропылесосите сам матрас. Для любых пятен, вызванных органическими веществами, такими как еда, напитки, жидкости организма, создайте мягкий раствор, содержащий половину воды и половину трехпроцентного раствора перекиси водорода. Используя чистую мягкую зубную щетку или губку, нанесите эту жидкость на пятно, оставьте на пять минут, и при необходимости повторите. После того, как пятна потускнели, используйте фен, чтобы испарить лишнюю влагу, прежде чем застелить постель.
Читайте также: 10 Отвратительных фактов о нашей спальне
Фотография — shutterstock
Удалите пятна от вина, шоколада, травы и пота
Смешайте две части перекиси водорода и одну часть жидкости для мытья посуды, чтобы создать собственное средство для удаления пятен с белья. Нанесите его на пятно с помощью мягкой щетки и дайте немного впитаться. Затем промойте под холодной водой. Если вы все еще видите следы пятен, повторите процедуру, пока пятно не пропадет. Позже постирайте свою одежду. Этот способ можно использовать также на мебели и ковровых покрытиях.
Фотография — shutterstock
Обновите ванну
Плесень и грязь в душе и ванной — это недопустимо! Но многие коммерческие чистящие средства для ванн и плитки включают такие химические вещества, как отбеливатель, аммиак и искусственные ароматизаторы, которые могут быть вредными для здоровья органов дыхания, едкими для кожи и в целом вредными для окружающей среды. Для более безопасного решения, сделайте раствор из 2/3 пищевой соды и 1/3 перекиси водорода. Нанесите на ванну и душ, подождите 30 минут, затем тщательно смойте.
Для более безопасного решения, сделайте раствор из 2/3 пищевой соды и 1/3 перекиси водорода. Нанесите на ванну и душ, подождите 30 минут, затем тщательно смойте.
Читайте также: 8 Способов предотвратить рост плесени в ванной комнате
Фотография — shutterstock
Избавьтесь от ржавчины
Хотя перекись водорода может ускорить процесс ржавления, она также может удалить ржавчину, если вы выполните эти простые шаги. В миску добавьте ложку лимонного сока, пищевую соду и несколько капель перекиси водорода, этого достаточно, чтобы образовалась паста. Втирайте пасту в ржавые предметы, подождите час, затем промойте водой. Этот метод лучше всего подходит для легких и умеренно ржавых предметов, таких как инструменты и игрушки. Это также полезно для оранжевых пятен в вашей раковине или ванне.
Читайте также: 5 Простых способов удалить следы ржавчины в домашних условиях
Фотография — shutterstock
Дезинфицируйте разделочные доски
На деревянных разделочных досках могут образовываться небольшие порезы и трещины на поверхности, в которых собираются вредные микробы. Но, в отличие от пластика, древесина пористая, деформируется и даже трескается при нагревании в посудомоечной машине. Чтобы безопасно очистить и продезинфицировать, распылите белый уксус, подождите пять минут, а затем протрите, налейте трехпроцентный раствор перекиси водорода по всей разделочной доске, равномерно распределив ее чистой губкой, оставьте на 5-10 минут.
Но, в отличие от пластика, древесина пористая, деформируется и даже трескается при нагревании в посудомоечной машине. Чтобы безопасно очистить и продезинфицировать, распылите белый уксус, подождите пять минут, а затем протрите, налейте трехпроцентный раствор перекиси водорода по всей разделочной доске, равномерно распределив ее чистой губкой, оставьте на 5-10 минут.
Затем посыпьте солью поверхность и аккуратно втирайте ее в деревянную доску при помощи половинки лимона (он впитает все оставшиеся запахи). Дайте лимонному соку впитаться в деревянную поверхность минимум 10 минут или оставьте на ночь, протрите влажной тряпкой и высушите. Для достижения наилучших результатов отполируйте древесину пищевым маслом миндаля или грецкого ореха и подождите шесть часов перед использованием.
Читайте также: Как очистить деревянную разделочную доску?
Фотография — unsplash
Изгоните микробы из унитаза
Держите ваш туалет свободным от микробов и лучше всего с этим справится перекись водорода. Просто налейте в унитаз полстакана перекиси водорода, оставьте на 30 минут, затем почистите щеткой для унитаза. Хотя это мощное средство, оно не причинит вреда системам водоснабжения. Чтобы освежить щетку, налейте немного перекиси водорода на щетинки и дайте высохнуть на воздухе, прежде чем вернуть ее в чашу.
Просто налейте в унитаз полстакана перекиси водорода, оставьте на 30 минут, затем почистите щеткой для унитаза. Хотя это мощное средство, оно не причинит вреда системам водоснабжения. Чтобы освежить щетку, налейте немного перекиси водорода на щетинки и дайте высохнуть на воздухе, прежде чем вернуть ее в чашу.
Читайте также: 10 Вещей, которые разрушают вашу сантехнику
Фотография — unsplash
Освежите растения
Мягкий спрей перекиси водорода может быть лучшим другом ваших растений. Дополнительный атом кислорода в H₂O₂ способствует процессу роста и может также лечить ряд заболеваний, включая вредителей, корневую гниль и грибок. Однако при чрезмерном применении перекись водорода может навредить растениям. Сначала протестируйте небольшое количество раствора, описанного ниже, на листьях или почве, прежде чем распылять на большие участки. Прекратите использование, если вы видите такие эффекты, как увядание или чрезмерная сухость.
Читайте также: 8 Советов по уходу за комнатными растениями зимой
Фотография — unsplash
- Для комнатных растений — смешайте одну столовую ложку трехпроцентной перекиси водорода и одну чашку воды в бутылке с распылителем и смочите почву раствором один или два раза в неделю (до полного высыхания почвы перед второй обработкой). Вы должны увидеть улучшение корневой системы после одной или двух обработок, в то время как вредители должны уменьшить свою разрушительную деятельность в течение недели.
- Чтобы уменьшить количество клещей, тли и грибков в вашем саду, смешайте ½ стакана трехпроцентного раствора перекиси водорода и 5 литров воды в большом распылителе. При опрыскивании листвы обязательно обрабатывайте не только верхушки, но и нижнюю сторону листьев, где могут скрываться вредители. Более мягкий раствор перекиси водорода в одной столовой ложке на 5 литров воды может уменьшить количество токсинов и кислотность в почве.

Удалите следы жесткой воды на граните
На гранитных столешницах слишком легко появляются неприятные пятна, но небольшое количество перекиси водорода мгновенно изгонит их. В маленькую миску засыпьте полстакана пищевой соды и смешайте с несколькими каплями трехпроцентной перекиси водорода, чтобы получить пасту. Распространите по загрязненной области и оставьте в течение 5-10 минут, и вытрите влажной тряпкой. Для более сильных пятен накройте смесь полиэтиленовой пленкой и скотчем по краям. Оставьте на ночь, затем вымойте насухо и вытрите мягким полотенцем.
Фотография — unsplash
Удалите пятна на мраморе
Знание того, как очищать пятна на мраморных столешниц, является обязательным условием для поддержания в хорошем состоянии ваших элитных поверхностей. Если пятно имеет органическую природу (пищевые пятна обычно розовато-коричневые в сухом виде), смешайте чашку с 12% перекисью водорода с несколькими каплями нашатырного спирта в аэрозольном распылителе. Обязательно работайте в хорошо проветриваемом помещении (используйте вытяжку над плитой или откройте окна), наденьте перчатки и защитные очки. Распылите эту смесь на пятно, оставьте на минуту или две, затем протрите полотенцем или замшей. Повторяйте, пока пятно не исчезнет, затем хорошо промойте водой и вытрите насухо чистым полотенцем.
Обязательно работайте в хорошо проветриваемом помещении (используйте вытяжку над плитой или откройте окна), наденьте перчатки и защитные очки. Распылите эту смесь на пятно, оставьте на минуту или две, затем протрите полотенцем или замшей. Повторяйте, пока пятно не исчезнет, затем хорошо промойте водой и вытрите насухо чистым полотенцем.
Фотография — unsplash
Освежите садовую мебель
Очистите садовую мебель без использования агрессивных химикатов и моющих средств. Налейте 5 литров теплой воды в большой распылитель. Добавьте ¼ чашки трехпроцентного раствора перекиси водорода, несколько капель моющего средства для посуды и ложку буры (минеральный порошок на основе натрия). Распылите раствор на металлические стулья и столы и дайте ему поработать от 10 до 15 минут. Протрите мягкой нейлоновой щеткой или губкой и затем промойте шлангом.
Читайте также: Лучшая краска для металла
Фотография — unsplash
Очистите стекла и зеркала
Прикрутите распылитель сверху прямо к бутылке с перекисью водорода и используйте его так же, как обычный очиститель для стекла и зеркал. Это удивительно эффективно и не оставляет разводы!
Это удивительно эффективно и не оставляет разводы!
Фотография — unsplash
Подписывайтесь на нас в Pinterest, где вы найдете еще больше интересных статей.
Полезные короткие видео от Make-Self.net
Подписывайтесь на наш уютный Telegram канал
СВЕЖИЕ СТАТЬИ
ПОПУЛЯРНЫЕ СТАТЬИ
Перекись водорода — доступный помощник для гигиены полости рта.
Перекись водорода является отличным антисептиком, который часто используется для обработки небольших ран. Благодаря своей универсальности и доступности, пероксид можно обнаружить практически в каждой домашней аптечке.
Перекись содержит молекулы кислорода – О и водорода – Н, что обуславливает ее окислительные свойства, которые позволяют ей справляться с большим количеством бактерий. Это недорогое средство помогает защитить зубы и десна, а также предупредить развитие простудных заболеваний.
Наиболее распространенная концентрация перекиси водорода доступная в аптеках — 3% раствор. Более высокие концентрации характерны для промышленного производства.
Из-за своих антибактериальных свойств перекись водорода помогает в лечении заболевания десен.
Зубной налет образующийся на зубах, формирует прочную защитную пленку из бактерий, называемую биопленкой. Перекись водорода благодаря содержанию кислорода помогает разрушить эту защиту и уничтожить налет.
Недавние проведенные исследования 2017 года показали преимущества применения перекиси водорода в качестве дополнительного средства нехирургического лечения пародонтита. Были проведены исследования в которых предлагалось дополнительно к стандартному лечению пародонтита применять препарат на основе пероксида для обработки десен. Результаты показали, что к концу исследования в группе с перекисью водорода было значительно меньше признаков заболевания десен, по сравнению с группой, которая получала только стандартную обработку.
Перекись водорода сохраняет белизну зубов.
На самом деле, многие виды зубной пасты и жидкости для полоскания рта уже содержат это соединение в своем составе.
Необычные исследования проведенные на бычьих зубах окрашенных чаем показали, что с течением времени жидкость с содержанием перекиси водорода значительно увеличивает белизну зубов. Безусловно, при сравнении быстроты и глубины отбеливания, специальные средства показывают значительно лучшие результаты, но они в свою очередь требуют аккуратного подхода и контроля стоматолога для избежания повреждения эмали.
Полоскания для отбеливания противопоказаны в случае истончения эмали и сильном повреждении зубов.
Облегчение боли в горле.
Одной из причин заболеваний горла являются бактериальные инфекции. Полоскание горла раствором перекиси водорода может облегчить дискомфорт, уменьшив количество бактерий во рту и помогая подавить инфекцию. Как уже написано выше, кислород, содержащийся в пероксиде, изменяет среду анаэробных бактерий и препятствует их росту.
Перекись водорода справляется с запахом изо рта.
При полоскании данным раствором образуется пена с большим количеством пузырьков наполненных кислородом. Это позволяет эффективно очищать самые труднодоступные места в полости рта, удаляя мертвые клетки и значительно уменьшая количество бактерий. Полоскание обеспечивает гибель микробов, которые вызывают неприятный запах.
Как использовать перекись водорода для полосканий полости рта и горла.
Важно знать как правильно использовать раствор перекиси водорода, чтобы получить максимальную пользу и избежать нежелательных побочных эффектов.
Чтобы полоскать горло перекисью водорода нужно предварительно развести ее с водой следуя прилагаемой инструкции. Как правило, 3% раствор перекиси водорода разводят водой в соотношении 1:11, либо следуя инструкции врача. Если добавить в получившейся раствор несколько капель эфирного масла, например мятного, то это значительно улучшит вкус ополаскивателя.
Не нужно делать более концентрированный раствор для полосканий, так как это может привести к ожогу слизистой. Также, во избежании возможного раздражения десен ограничьте полоскания до нескольких раз в неделю.
Также, во избежании возможного раздражения десен ограничьте полоскания до нескольких раз в неделю.
Избегайте проглатывания перекиси водорода. Хотя проглатывание небольших количеств 3% концентрации обычно не вызывает серьезных проблем, это может привести к расстройству желудка и рвоте.
Дети не должны полоскать горло раствором перекиси водорода, если есть вероятность его проглатывания. Взрослые всегда должны контролировать процесс полоскания ребенка.
Если после полоскания горла развивается раздражение и не проходит через несколько часов, прекратите использование перекиси водорода.
В редких случаях возможны более серьезные индивидуальные побочные эффекты.
В любом случае если человеку склонному к аллергическим реакциям необходимо проконсультироваться со своим врачом по поводу применения полосканий с перекисью водорода.
При посещении врача-стоматолога нужно обязательно сообщить ему о том, что вы применяете домашние полоскания раствором пероксида, чтобы получить рекомендации и оценку эффективности полосканий от специалиста.
Про перекись водорода и жука-ракетчика / Хабр
Тема этой заметки назревала давно. И хотя по просьбе читателей канала
LAB-66
, я просто хотел написать про безопасную работу с перекисью водорода, но в итоге, по непонятным (
вот, да!
) мне причинам, образовался очередной лонгрид. Смесь из popsci, ракетного топлива, «коронавирусной дезинфекции» и перманганатометрического титрования. Как
правильно
хранить перекись водорода, какие использовать средства защиты при работе и как спасаться при отравлениях — ищем под катом.
p.s. жук с картинки на самом деле называется “бомбардир”. И он там тоже где-то затерялся среди химикатов 🙂
«детям пероксида» посвящается…
Полюбился нашему брату пероксид водорода, ох как полюбился. Думаю я об этом каждый раз, когда встречаю вопрос вроде «бутылку с перекисью водорода раздуло. что делать?» Встречаю, кстати, достаточно часто 🙂
Не удивительно, что на пост-советских пространствах перекись водорода (3% раствор) — это один из любимых “народных” антисептиков. И на рану полить, и воду обеззараживать, и коронавирус вот уничтожать (с недавних пор). Но несмотря на кажущуюся простоту и доступность, реагент это достаточно неоднозначный, о чем я дальше и расскажу.
И на рану полить, и воду обеззараживать, и коронавирус вот уничтожать (с недавних пор). Но несмотря на кажущуюся простоту и доступность, реагент это достаточно неоднозначный, о чем я дальше и расскажу.
По биологическим «вершкам» пройдясь…
Сейчас модно все с приставкой эко-: экологичные продукты, экологичные шампуни, экологичные вещи. Как я понял, люди хотят этими прилагательными отличать вещи биогенные (т.е. встречающиеся в живых организмах изначально) от вещей сугубо синтетических («жесткая химия»). Поэтому вначале небольшое введение, которое я надеюсь, подчеркнет экологичность пероксида водорода и добавит оному доверия в народных массах 🙂
Итак, что же такое перекись водорода. Это простейшее перекисное соединение, которое имеет в своем составе сразу два атома кислорода (они соединены связью -O-O-). Там где такой вид связи, там вам и нестабильность, там и атомарный кислород, и сильные окислительные свойства и все все все. Но несмотря на суровость атомарного кислорода, перекись водорода присутствует во множестве живых организмов, в т. ч. и в человеке. Образуется она в микро количествах во время протекания сложных биохимических процессов и окисляет белки, мембранные липиды и даже ДНК (за счет образующихся пероксидных радикалов). Наш организм в процессе эволюции научился с перекисью довольно эффективно бороться. Делает он это с помощью фермента надпероксиддисмутазы, который перекисные соединения разрушает до кислорода и перекиси водорода, плюс фермента каталазы которая перекись на раз-два преобразует в кислород и воду.
ч. и в человеке. Образуется она в микро количествах во время протекания сложных биохимических процессов и окисляет белки, мембранные липиды и даже ДНК (за счет образующихся пероксидных радикалов). Наш организм в процессе эволюции научился с перекисью довольно эффективно бороться. Делает он это с помощью фермента надпероксиддисмутазы, который перекисные соединения разрушает до кислорода и перекиси водорода, плюс фермента каталазы которая перекись на раз-два преобразует в кислород и воду.
Ферменты прекрасны в трехмерных моделях
Спрятал под спойлер. Я люблю на них смотреть, но вдруг кому-то да не нравится…
Кстати, именно благодаря действию каталазы, которая присутствует в тканях нашего организма, “вскипает” кровь при обработке ран (про раны ниже будет отдельная ремарка).
Есть у перекиси водорода внутри нас и важная «охранная функция». У многих живых организмов присутствует такая интересная органелла (структура нужная для функционирования живой клетки) как пероксисома. Эти структуры представляют собой липидные пузырьки внутри которых находится кристаллоподобное ядро, состоящее из биологических трубчатых «микрореакторов». Внутри ядра происходят различные биохимические процессы, в результате которых из кислорода воздуха и сложных органических соединений липидной природы образуется….перекись водорода!
Эти структуры представляют собой липидные пузырьки внутри которых находится кристаллоподобное ядро, состоящее из биологических трубчатых «микрореакторов». Внутри ядра происходят различные биохимические процессы, в результате которых из кислорода воздуха и сложных органических соединений липидной природы образуется….перекись водорода!
Но здесь интереснее всего, для чего потом эта перекись используется. Например в клетках печени и почек образующаяся H
2
O
2
идет на то, чтобы разрушать и нейтрализовать поступающие в кровь токсины. Ацетальдегид, который образуется при метаболизме алкогольных напитков (
и который ответственен за похмелье
) — это тоже заслуга наших маленьких неутомимых тружеников пероксисом, и «матушки» перекиси водорода.
Чтобы все не казалось уж таким радужным с перекисями, внезапно напомню про механизм действия радиации на живую ткань. Молекулы биологических тканей поглощают энергию излучения и ионизируются, т.е. переходят в состояние способствующее образованию новых соединений (чаще всего совершенно не нужных в рамках организма). Чаще и проще всего подвергается ионизации вода, происходит ее радиолиз. В присутствии кислорода под воздействием ионизирующей радиации возникают различные свободные радикалы (OH— и иже с ними) и перекисные соединения (H2O2 в частности).
Чаще и проще всего подвергается ионизации вода, происходит ее радиолиз. В присутствии кислорода под воздействием ионизирующей радиации возникают различные свободные радикалы (OH— и иже с ними) и перекисные соединения (H2O2 в частности).
Образующиеся пероксиды активно вступают во взаимодействие с химическими соединениями организма. Хотя если взять в качестве примера иногда образующийся в процессе радиолиза надпероксидный анион (О2
—
), то стоит сказать что этот ион образуется и в обычных условиях, в абсолютно здоровом организме, без свободных радикалов
нейтрофилы
и
макрофаги
нашего иммунитета не могли бы уничтожать бактериальные инфекции. Т.е. совсем без этих
свободных радикалов
никак нельзя — они сопровождают биогенные реакции окисления. Проблема возникает когда их становится слишком много.
Именно для борьбы с “слишком много” пероксидных соединений и придуманы человеком такие штуки, как антиоксиданты. Они ингибируют процессы окисления сложной органики с образованием пероксидных и т. п. свободных радикалов и тем самым снижают уровень окислительного стресса.
п. свободных радикалов и тем самым снижают уровень окислительного стресса.
Окислительный стресс — это процесс повреждения клетки в результате окисления (= в организме слишком много свободных радикалов)
Хотя по сути, ничего нового эти соединения не дают, к тому, что уже имеется, т.е. “внутренних антиоксидантов” — надпероксиддисмутазы и каталазы. Да и вообще, при неправильном использовании синтетические антиоксиданты не только не помогут, а этот самый окислительный стресс еще и усилят.
Ремарка про “перекись и раны”. Несмотря на то, что перекись водорода является завсегдатаем домашних (и производственных аптечек), есть данные, говорящие о том, что использование H2O2 препятствует заживлению раны и вызывает образование рубцов, потому что перекись разрушает новообразованные клетки кожи. Положительный эффект дают только очень низкие концентрации (0,03% раствор, это значит надо разбавить 3% аптечный в 100 раз), и только при однократном применении. Кстати, “коронавирус ready” 0,5% раствор тоже препятствует заживлению. Так что, как говорится, доверяй, но проверяй.
Кстати, “коронавирус ready” 0,5% раствор тоже препятствует заживлению. Так что, как говорится, доверяй, но проверяй.
Перекись водорода в быту и «против коронавируса»
Если перекись водорода может даже этанол в печени превратить в ацетальдегид, то было бы странно эти ее замечательные окислительные свойства не использовать в повседневной жизни. Они и используются в таких вот пропорциях:
Половина всей производимой химической промышленностью перекиси водорода идет для отбеливания целлюлозы и различных видов бумаги. Второе место (20%) по востребованности занимает получение различных отбеливателей на основе неорганических пероксидов (перкарбонат натрия, перборат натрия и т.д. и т.п.). Эти пероксиды (часто в комбинации с
ТАЕД
для снижения температуры отбеливания, т.к. пероксосоли не работают при температуре ниже 60 градусов) используются во всяких “Персоль” и т.п. (подробнее можно посмотреть
здесь
). Потом идет с небольшим отрывом отбеливание тканей и волокон (15%) и очистка воды (10%). Ну и наконец доля которая остается — поровну делится между сугубо химическими вещами и использовании перекиси водорода для медицинских целей. На последних остановлюсь подробнее ибо скорее всего пандемия коронавируса цифры на диаграмме изменит (если уже не изменила).
Ну и наконец доля которая остается — поровну делится между сугубо химическими вещами и использовании перекиси водорода для медицинских целей. На последних остановлюсь подробнее ибо скорее всего пандемия коронавируса цифры на диаграмме изменит (если уже не изменила).
Перекись водорода активно используется для стерилизации различных поверхностей (в т.ч. хирургических инструментов) а в последнее время еще и в виде пара (т.н. VHP — vaporized hydrogen peroxide) для стерилизации помещений. На рисунке ниже пример такого генератора пара перекиси. Очень перспективное направление, которое до отечественных больниц пока не добралось…
В целом перекись демонстрирует высокую эффективность дезинфекции для широкого спектра вирусов, бактерий, дрожжей и бактериальных спор. Стоит отметить, что для сложных микроорганизмов, из-за присутствия в них ферментов, разлагающих перекись (т.н. пероксидазы, частным случаем которых является и упомянутая выше каталаза) может наблюдаться толерантность (~устойчивость). Особенно это характерно для растворов с концентрацией ниже 1%. Но против 3%, а уж тем более 6–10% не может устоять пока ничего, ни вирус, ни бактериальная спора.
Особенно это характерно для растворов с концентрацией ниже 1%. Но против 3%, а уж тем более 6–10% не может устоять пока ничего, ни вирус, ни бактериальная спора.
Фактические, наравне с этиловым и изопропиловым спиртом да гипохлоритом натрия, пероксид водорода входит в список “жизненно-важных” экстренных антисептиков для дезинфекции поверхностей от COVID-19. Хотя не только от COVID-19. в В начале всей коронавирусной вакханалии мы с читателями телеграм-канала активно пользовались при выборе антисептиков рекомендациями из статьи. Рекомендации применимы к коронавирусам в целом, ну и COVID-19 в частности. Так что статью рекомендую скачать и распечатать (для интересующихся этим вопросом).
Важная табличка для юного дезинфектолога
За то время, что прошло с момента начала эпидемии, особенно ничего не поменялось в плане работающих концентраций. Зато поменялось, например, в отношении форм, в которых может использоваться перекись водорода. Здесь сразу хотелось бы вспомнить документ
EPA’s Registered Antimicrobial Products for Use Against Novel Coronavirus SARS-CoV-2, the Cause of COVID-19
с составами рекомендуемых для дезинфекции средств. Меня в этом списке традиционно заинтересовали салфетки (традиционно, потому что дезсалфетки мне нравятся, гипохлоритные я
Меня в этом списке традиционно заинтересовали салфетки (традиционно, потому что дезсалфетки мне нравятся, гипохлоритные я
уже делал
, и доволен ими на все 100%). В данном случае меня заинтересовал такой американский продукт как
Oxivir Wipes
(или его аналог
Oxivir 1 Wipes
) от компании Diversey Inc.
В активных ингредиентах там указано немногое:
Hydrogen Peroxide 0.5%
Простенько и со вкусом. Но тем, кто захочет повторить такой состав и пропитать свои custom-ные влажные салфетки скажу, что кроме перекиси водорода в пропиточном растворе присутствуют еще и:
Phosphoric acid (фосфорная кислота — стабилизатор) 1–5%
2-Hydroxybenzoic Acid (салициловая кислота) 0,1–1,5%
Зачем все эти “примеси” станет ясно, когда дочитаете до раздела про стабильность.
Помимо состава хотелось бы также напомнить, что гласит инструкция на упомянутые Oxivir. Ничего принципиально нового (относительно первой таблицы), но мне понравился спектр дезинфицируемых вирусов.
Какие вирусы перекись в силах побороть
И не был бы я собой, если бы еще раз не напомнил про экспозицию при обработке. Как и раньше (=как и всегда) рекомендуется делать так, чтобы
при протирании влажными салфетками все твердые, НЕпористые поверхности оставались визуально влажными на протяжении как минимум 30 секунд
(а лучше минута!) для дезактивации всего и вся (и этого вашего COVID-19 тоже).
Перекись водорода как химикат
Вокруг да около прошлись, теперь пришло время написать про перекись водорода, с точки зрения химика. Благо именно этот вопрос (а не то, как пероксисома выглядит) чаще всего интересует неискушенного пользователя, который решил использовать H
2
O
2
для своих целей. Начнем с трехмерной структуры (как ее вижу я):
Как структуру видит девочка Саша, которая боится что перекись может взорваться (об этом ниже)
«бегущий петушок вид снизу»
Чистый пероксид представляет собой прозрачную (с голубоватым оттенком для высоких концентраций) жидкость. Плотность разбавленных растворов близка к плотности воды (1 г/см
Плотность разбавленных растворов близка к плотности воды (1 г/см
3
), концентрированные более плотные (35% — 1,13 г/см
3
…70% — 1,29 г/см
3
и т.д.). По плотности (при наличии ареометров) можно достаточно точно определить концентрацию своего раствора (информация из
статьи
).
Отечественная техническая перекись водорода может быть трех марок: А=концентрация 30–40%, Б=50–52%, В=58–60%. Часто встречается такое наименование как “пергидроль” (было когда-то даже выражение «пергидрольная блондинка»). По сути ж — все та же “марка А”, т.е. раствор перекиси водорода с концентрацией около 30%.
Ремарка про отбеливание. Раз уж про блондинок вспомнили, то можно отметить, что в качестве отбеливающего состава для “опергидроливания” волос использовали разбавленную перекись водорода (2–10%) и нашатырный спирт. Сейчас это уже редко практикуется. Зато встречается перекисное отбеливание зубов. Кстати, побеление кожи рук после контакта с перекисью — это тоже своеобразное “опергидроливание”, вызванное тысячами микроэмболий, т. е. закупорок капилляров образовавшимися при разложении перекиси пузырьками кислорода.
е. закупорок капилляров образовавшимися при разложении перекиси пузырьками кислорода.
Медицинской техническая перекись становится, когда к перекиси концентрацией 59–60% добавляют обессоленную воду, разбавляя концентрат до нужного уровня (3% на отечественных просторах, 6% в США).
Помимо плотности, важным параметром является уровень pH. Пероксид водорода является слабой кислотой. На картинке ниже показана зависимость рН раствора перекиси водорода от массовой концентрации:
Чем более разбавленный раствор, тем ближе его рН к рН воды. Минимальный рН (=самый кислый) приходится на концентрации 55–65 % (марка В по отечественной классификации).
Хотя здесь скрепя сердце стоит отметить, что рН нельзя использовать для количественной оценки концентрации по нескольким причинам. Во-первых, практически вся современная перекись получается с помощью окисления антрахинонов. В этом процессе образуются кислотные побочные продукты, которые могут попадать в готовую перекись. Т.е. рН может отличаться от того, который указан в таблице выше в зависимости от степени чистоты H2O2. Сверхчистая перекись (например, которая идет для ракетного топлива и о которой я еще скажу отдельно) примесей не содержит. Во-вторых, в продажную перекись водорода часто добавляют кислотные стабилизаторы (перекись более стабильна при низких рН), которые будут “смазывать” показания. Ну и в-третьих, стабилизаторы-хелаты (для связывания примесей металлов, о них подробнее ниже) тоже могут быть щелочными или кислотными и влиять на рН итогового раствора.
Сверхчистая перекись (например, которая идет для ракетного топлива и о которой я еще скажу отдельно) примесей не содержит. Во-вторых, в продажную перекись водорода часто добавляют кислотные стабилизаторы (перекись более стабильна при низких рН), которые будут “смазывать” показания. Ну и в-третьих, стабилизаторы-хелаты (для связывания примесей металлов, о них подробнее ниже) тоже могут быть щелочными или кислотными и влиять на рН итогового раствора.
Лучший способ определения концентрации — титрование (как и в случае гипохлорита натрия ~ “Белизна”). Методика абсолютно та же, но только все реактивы, необходимые для проведения испытания — очень легкодоступны. Нужна концентрированная серная кислота (аккумуляторный электролит) да обычная марганцовка. Как кричал когда-то Б. Гейтс “640 кб памяти хватит всем!”, так же воскликну и я сейчас “Титровать перекись могут все!” :). Несмотря на то, что интуиция мне подсказывает, что если покупать перекись водорода в аптеке и не хранить ее десятилетиями — то колебания концентрация навряд ли превысят ± 1%, все-таки методику проверки изложу, благо реактивы доступные и алгоритм достаточно прост.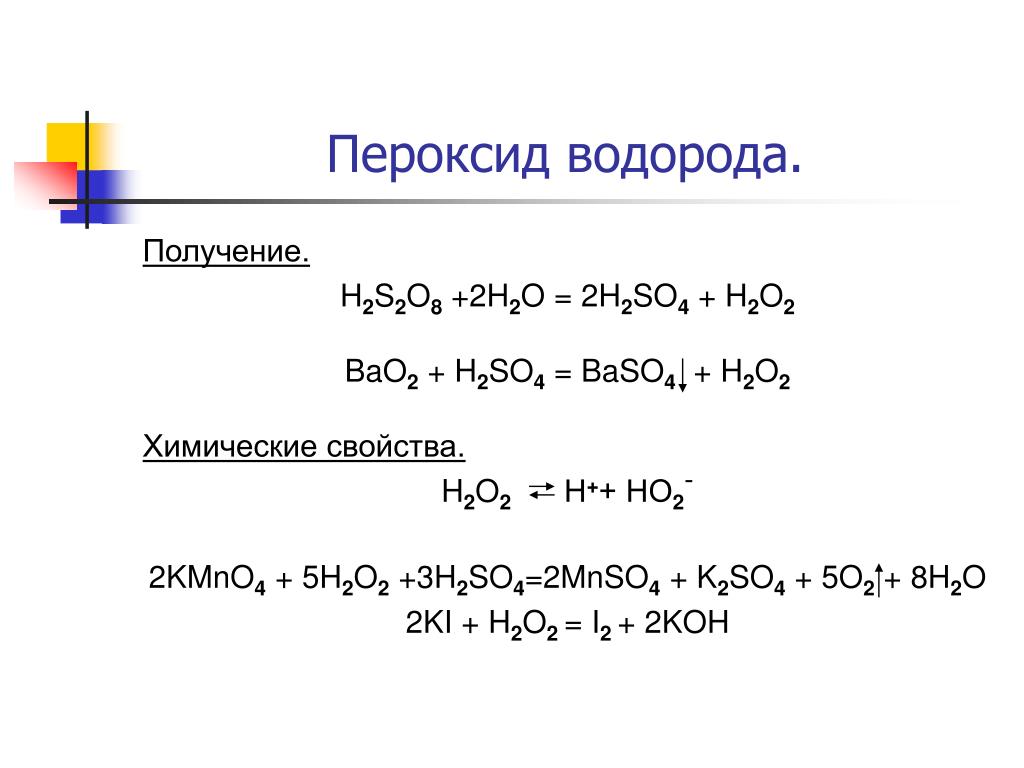
Проверяем продажную перекись водорода на вшивость
Как несложно догадаться проверять будем с помощью титрования. Методика позволяет достаточно точно определять концентрации от 0,25 до 50%.
Алгоритм проверки следующий:
1. Готовим 0,1N раствор перманганата калия. Для этого растворяем 3,3 грамма марганцовки в 1 л воды. Раствор нагреваем до кипения и кипятим 15 минут.
2. Отбираем требуемый объем исследуемой перекиси (в зависимости от предполагаемой концентрации, т.е. если у вас было 3%, ожидать что там внезапно стало 50% — глупо):
Переносим отобранный объем в бутылочку и взвешиваем на весах (не забыв нажать кнопку Тара, чтобы не учитывать вес самой бутылки)
3. Переливаем наш образец в мерную колбу на 250 мл (или детскую бутылочку с маркировкой объема) и доливаем до метки (“250”) дистиллированной водой. Перемешиваем.
4. В коническую колбу на 500 мл (=”поллитровая банка”) наливаем 250 мл дистиллированной воды, добавляем 10 мл концентрированной серной кислоты и 25 мл нашего раствора из п. 3
3
5. Капаем по каплям (желательно из пипетки, на которой нанесена маркировка объема) раствор 0,1N марганцовки в нашу поллитровую банку из п.4. Капнули — перемешали, капнули — перемешали. И так продолжаем до тех пор, пока прозрачный раствор не приобретет слабо розоватый оттенок. В результате реакции перекись разлагается с образованием кислорода и воды, а марганец (VI) в марганцовке восстанавливается до марганца (II).
5H2O2 + 2KMnO4 + 4H2SO4 = 2KHSO4 +2MnSO4 + 5O2 + 8H2O
6. Считаем концентрацию нашей перекиси: С h3O2 (масс.%) =[Объем раствора марганцовки в мл*0,1*0,01701*1000]/[масса образца в граммах, из п.2]
PROFIT!!!
Свободные рассуждения на тему стабильности при хранении
Перекись водорода считается соединением нестабильным, которое склонно к самопроизвольному разложению. Скорость разложения увеличивается с повышением температуры, концентрации и pH. Т.е. в общем работает правило:
Т.е. в общем работает правило:
…холодные, разбавленные, кислые растворы демонстрируют наилучшую стабильность…
Разложению способствуют: повышение температуры (увеличение скорости в 2,2 раза на каждые 10 градусов Цельсия, а при температуре около 150 градусов концентраты вообще
лавинообразно разлагаются со взрывом
), увеличение рН (особенно при рН> 6–8)
Ремарка про стекло: хранить в стеклянных бутылках можно только подкисленную перекись, т.к. стекло имеет свойство при контакте с чистой водой давать щелочную среду, а значит будет способствовать ускоренному разложению.
Влияет на скорость разложения и наличие примесей (особенно переходных металлов, таких как медь, марганец, железо, серебро, платина), воздействие ультрафиолета. Чаще всего основная комплексная причина — это рост рН и наличие примесей. В среднем, при STP условиях 30% перекись водорода теряет примерно 0,5% основного компонента в год.
Для удаления примесей используют ультратонкую фильтрацию (исключение частиц) или хелаты (комплексообразователи), связывающие ионы металлов.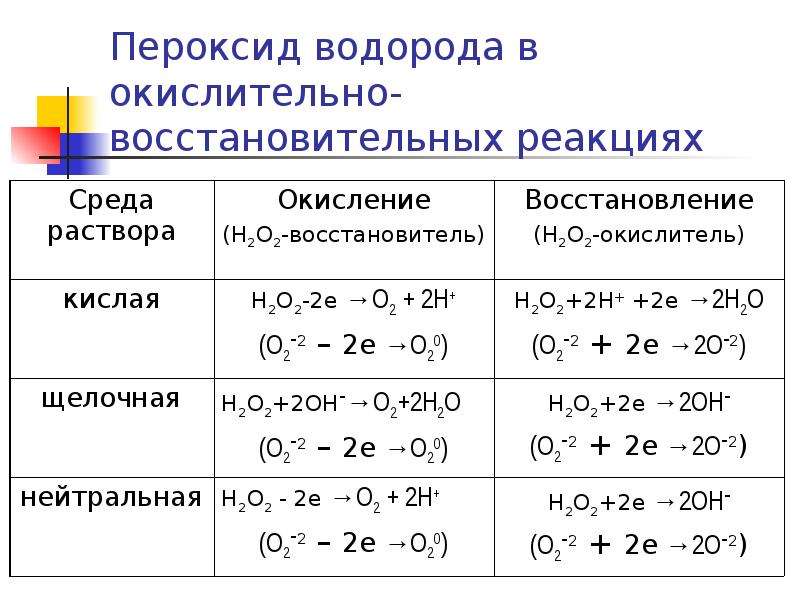 В качестве хелатов могут использоваться ацетанилид, коллоидный станнат или пирофосфат натрия (25–250 мг/л), органофосфонаты, нитраты (+регуляторы рН и ингибиторы коррозии), фосфорную кислоту (+регулятор рН), силикат натрия (стабилизатор).
В качестве хелатов могут использоваться ацетанилид, коллоидный станнат или пирофосфат натрия (25–250 мг/л), органофосфонаты, нитраты (+регуляторы рН и ингибиторы коррозии), фосфорную кислоту (+регулятор рН), силикат натрия (стабилизатор).
Влияние ультрафиолета на скорость разложения не так выражено, как для рН или температуры, но тоже имеет место быть (см. картинку):
Видно, что коэффициент молекулярной экстинкции растет с уменьшением длины волны ультрафиолета.
Коэффициент молярной экстинкции является характеристикой того, насколько сильно химическое вещество поглощает свет на заданной длине волны.
Кстати, этот процесс разложения, инициированный фотонами называется фотолиз:
Фотолиз (он же фотодиссоциациея и фоторазложение) представляет собой химическую реакцию, в которой химическое вещество (неорганическое или органическое) расщепляется фотонами после их взаимодействия с молекулой-мишенью. Вызвать разложение может любой фотон с достаточной энергией (более высокой, чем энергия диссоциации целевой связи).
Эффект, аналогичный эффекту ультрафиолета могут давать также рентгеновские лучи и γ-лучи.
Что можно сказать в целом. А то, что перекись следует хранить в непрозрачном контейнере, а лучше вообще в бутылках из коричневого стекла, которые блокируют лишний свет (несмотря на то, что «поглощает» != «сразу разлагается»). Рядом с рентген-аппаратом бутылочку перекиси также держать не стоит 🙂 Ну и от такого вот (УР 203Ех (?):
… от «
такого вот
” перекись (
да и себя любимого, если уж начистоту
) тоже держать нужно подальше.
Важно, что помимо непрозрачности, контейнер/бутылка должен быть из “перекисьустойчивых” материалов, вроде нержавеющей стали или стекла (ну + некоторые пластмассы и алюминиевые сплавы). Для ориентировки может пригодится табличка (пригодится в т.ч. врачам, которые собираются обрабатывать свое оборудование):
Легенда таблички следующая: А — отличная совместимость, B — хорошая совместимость, незначительное воздействие (микрокоррозия или изменение цвета), С — слабая совместимость (не рекомендуется для длительного использования, возможна потеря прочности и т. п.), D- совместимость отсутствует (=использовать нельзя). Прочерк означает “информация отсутствует”. Цифровые индексы: 1 — удовлетворительно при 22° C, 2 — удовлетворительно при 48° C, 3 — удовлетворительно, при использовании в прокладках и уплотнениях.
п.), D- совместимость отсутствует (=использовать нельзя). Прочерк означает “информация отсутствует”. Цифровые индексы: 1 — удовлетворительно при 22° C, 2 — удовлетворительно при 48° C, 3 — удовлетворительно, при использовании в прокладках и уплотнениях.
Техника безопасности при работе с перекисью водорода
Каждому кто дочитал до этого раздела скорее всего ясно, что перекись — это сильный окислитель, а значит ее крайне необходимо хранить вдали от легковоспламеняющихся/горючих веществ и восстановителей. H2O2 как в чистом, так и в разбавленном виде может образовывать взрывоопасные смеси при контакте с органическими соединениями. Учитывая все выше сказанное, можно написать так
Перекись водорода несовместима с горючими материалами, любыми горючими жидкостями и металлами и их солями (в порядке снижения каталитического действия) — осмий, палладий, платина, иридий, золото, серебро, марганец, кобальт, медь, свинец
Говоря про металлические катализаторы разложения нельзя отдельно не сказать про осмий. Это не только самый плотный металл на Земле, он еще и лучшее в мире оружие для разложения перекиси водорода.
Это не только самый плотный металл на Земле, он еще и лучшее в мире оружие для разложения перекиси водорода.
Эффект ускорения разложения перекиси водорода для этого металла наблюдается в количествах, которые даже не каждым аналитическим методом возможно обнаружить — чтобы очень эффективно (х3-х5 раз относительно перекиси без катализатора) перекись разложить на кислород и воду нужен всего лишь 1 грамм осмия на 1000 тонн пероксида водорода.
Ремарка про «взрывной характер»: (сразу хотел написать “я-перекись”, но постеснялся). В случае перекиси водорода, сферическая девочка Саша, которой с этой перекисью приходится работать, чаще всего боится взрыва. И в принципе, в опасениях Александры есть здравый смысл. Ведь перекись может взорваться по двум причинам. Во-первых от того, что в герметичном контейнере будет протекать постепенное разложение H2O2, выделение и накопление кислорода. Давление внутри контейнера будет расти, расти и в итоге БУМ! Во-вторых есть вероятность того, что при контакте перекиси водорода с какими-то веществами произойдет образование неустойчивых пероксидных соединений, которые могут сдетонировать от удара, нагрева и т. п. В классном пятитомнике Sax’s Dangerous Properties of Industrial Materials по этому поводу сказано столько, что я даже решил это спрятать под спойлер. Информация применима для концентрированной перекиси водорода >= 30% и <50%:
п. В классном пятитомнике Sax’s Dangerous Properties of Industrial Materials по этому поводу сказано столько, что я даже решил это спрятать под спойлер. Информация применима для концентрированной перекиси водорода >= 30% и <50%:
Абсолютная несовместимость
взрывается при контакте с: спирты+серная кислота, ацеталь+уксусная кислота+нагрев, уксусная кислота+N-гетероциклы (выше 50 °C), ароматические углеводороды+трифторуксусная кислота, азелаиновая кислота+серная кислота (около 45 °C), трет-бутанол+серная кислота, карбоксильные кислоты (муравьиная, уксусная, винная), дифенилдиселенид (выше 53 °C), 2-этоксиэтанол+полиакриламидный гель+толуол+нагрев, галий+соляная кислота, сульфат железа (II)+азотная кислота+карбоксиметилцеллюлоза, азотная кислота + кетоны (2-бутанон, 3-пентанон, циклопентанон, циклогексанон), азотистые основания (аммиак, гидразин гидрат, диметилгидразин), органические соединения (глицерин, уксусная кислота, этанол, анилин, хинолин, целлюлоза, угольная пыль), органические материалы + серная кислота (особенно в ограниченном пространстве), вода + кислородсодержащая органика (ацетальдегид, уксусная кислота, ацетон, этанол, формальдегид, муравьиная кислота, метанол, пропанол, пропаналь), винилацетат, спирты+хлорид олова, оксид фосфора (V), фосфор, азотная кислота, антимонит, трисульфид мышьяка, хлор+гидроксид калия+хлорсульфоновая кислота, сульфид меди, сульфид железа (II), муравьиная кислота+органические загрязнения, селенид водорода, ди- и моноксид свинца, сульфид свинца (II), диоксид марганца, оксид ртути (I), дисульфид молибдена, иодат натрия, оксид ртути (II)+ азотная кислота, диэтиловый эфир, этилацетат, тиомочевина+уксусная кислота
загорается при контакте с: фурфуриловым спиртом, порошкообразные металлы (магний, цинк, железо, никель), древесные опилки
бурная реакция с: изопропоксид алюминия+соли тяжелых металлов, древесный уголь, каменный уголь, тетрагидроалюминат лития, щелочные металлы, метанол+фосфорная кислота, ненасыщенные органические соединения, хлорид олова (II), оксид кобальта, оксид железа, гидроксид свинца, оксид никеля
В принципе, если относится к концентрированной перекиси уважительно, и не комбинировать с указанным выше веществами, то можно годами комфортно работать и ничего не бояться. Но береженого и бог бережет, поэтому плавно переходим к средствам индивидуальной защиты.
Но береженого и бог бережет, поэтому плавно переходим к средствам индивидуальной защиты.
СИЗ и ликвидация последствий
Идея написания статьи возникла когда я решил сделать заметку в
канал
, посвященную вопросам безопасной работы с концентрированными растворами H
2
O
2
. Благо очень многие читатели приобрели себе канистры с пергидролем (на случай «в аптеке ничего нет»/«до аптеки не дойдем») и даже успели сгоряча получить химические ожоги. Поэтому большая часть написанного ниже (да и выше) относится в основном к растворам с концентрацией выше 6%. Чем выше концентрации — тем актуальнее наличие СИЗ.
Для безопасной работы, в качестве средств индивидуальной защиты всего-то нужны перчатки из поливинилхлорида/бутилкаучука, полиэтилена, полиэфирных и других пластиков для защиты кожи рук, очки или защитные маски из прозрачных полимерных материалов для защиты глаз. Если образуются аэрозоли — добавляем к комплекту респиратор с противоаэрозольной защитой (а лучше вообще угольный ABEK фильтропатрон с P3 защитой). При работе со слабыми растворами (up to 6%) достаточно перчаток.
При работе со слабыми растворами (up to 6%) достаточно перчаток.
На «поражающих эффектах» остановлюсь подробнее. Перекись водорода это умеренно опасное вещество, при попадании на кожу и в глаза вызывает химические ожоги. Вреден при вдыхании и проглатывании. См. картинку из SDS («Окислитель»-«Корродирует»-«Раздражитель»):
Чтобы не ходить вокруг да около — сразу и напишу о том, что делать, если перекись водорода концентрацией >6% вступила в контакт с неким сферическим человеком без средств индивидуально защиты.
При попадании на кожу — стереть сухой тряпкой, или тампоном смоченным спиртом. Затем необходимо промывать поврежденную кожу обильной струей воды в течении 10 минут.
При попадании в глаза — немедленно промыть широко раскрытые глаза, а также под веками слабой струей воды (или 2% раствором питьевой соды) не менее 15 минут. Обратится к врачу-офтальмологу.
При проглатывании — обильное питье (=простая вода литрами), активированный уголь (1 таблетка на 10 кг веса), солевое слабительное (сульфат магния).Не вызывать рвоту (=промывание желудка ТОЛЬКО врачом, с помощью зонда, и никаких привычных уже «два пальца в рот»). Не давать что либо через рот человеку без сознания.
Вообще
проглатывание особенно опасно
, так как при разложении в желудке образуется большое количество газа (в 10 раз больше объема 3% раствора), что приводит к вздутию живота и сдавливанию внутренних органов. Для этого и нужен активированный уголь…
Если с лечением последствий для организма все более или менее понятно, то стоит еще пару слов сказать и про утилизацию лишней/старой/разлитой по неопытности перекиси водорода.
… утилизация перекиси водорода производится либо а)разбавлением водой и сливом в канализацию, либо б)разложением с помощью катализаторов (пиросульфит натрия и т.п.), либо в)разложением нагревом (в т.ч. кипячение)
Как это все выглядит на примере. Например в лаборатории разлил я нечаянно литр 30% перекиси водорода. Ничего не вытираю, а засыпаю жидкость смесью равных количеств (1:1:1)
кальцинированной соды
+песка+
бентонита
(=”бентонитовый наполнитель для лотков”). Затем эту смесь смачиваю водой до образования кашицы, кашицу совком собираю в контейнер, и переношу в ведро с водой (заполнены две трети). И уже в ведро с водой я постепенно добавляю раствор пиросульфита натрия с 20% избытком. Чтобы все это дело нейтрализовать по реакции:
Затем эту смесь смачиваю водой до образования кашицы, кашицу совком собираю в контейнер, и переношу в ведро с водой (заполнены две трети). И уже в ведро с водой я постепенно добавляю раствор пиросульфита натрия с 20% избытком. Чтобы все это дело нейтрализовать по реакции:
Na2S2O5 + 2H2O2 = Na2SO4 + H2SO4 + H2O
Если соблюдать условия задачи (литр 30% раствора) то выходит что для нейтрализации нужно 838 грамм пиросульфита (с избытком выходит килограмм соли). Растворимость этого вещества в воде ~ 650 г/л, т.е. примерно полтора литра концентрированного раствора понадобится. Мораль такова — либо не разливайте пергидроль на пол, либо разводите его посильнее, а то не наберетесь нейтрализаторов 🙂
При поиске возможных замен пиросульфиту, Капитан Очевидность рекомендует использовать те реагенты, которые при реакции с перекисью водорода не дают аховые объемы газа. Это может быть например сульфат железа (II). Он продается в хозяйственных магазинах и даже в РБ. Для нейтрализации h3O2 требуется подкисленный серной кислотой раствор:
Это может быть например сульфат железа (II). Он продается в хозяйственных магазинах и даже в РБ. Для нейтрализации h3O2 требуется подкисленный серной кислотой раствор:
2FeSO4 + H2O2 + H2SO4 = Fe2(SO4)3 + 2H2O
Можно использовать и иодид калия (тоже подкисленный серной кислотой):
2KI + H2O2 + H2SO4 = I2 + 2H2O + K2SO4
Напомню, что все рассуждения строятся на вводных задачи (30% р-р), если вы разлили перекись концентрациями пониже (3–7%) то можно использовать и подкисленный серной кислотой перманганат калия. Если кислород там даже и выделяется, то благодаря низким концентрациям “наворотить дел” он не сможет при всем желании.
Про жука
А я не забыл про него, родимого. Будет в качестве награды тем, кто дочитал очередной мой
longread
. Не знаю задумывался ли 30 лет назад уважаемый Алексей JetHackers Стаценко aka
Не знаю задумывался ли 30 лет назад уважаемый Алексей JetHackers Стаценко aka
MagisterLudi
о своих реактивных ранцах, но вот у меня точно какие-то такие мысли возникали. Особенно, когда на VHS кассете доводилось смотреть (а то и пересматривать) светлую диснеевскую сказку-фильм “
Ракетчик
” (в оригинале
Rocketeer
).
Связь здесь следующая. Как я писал ранее, перекись водорода высоких концентраций (вроде отечественной марки В) с высокой степенью очистки (прим. — т.н. high-test peroxide или
HTP
) может использоваться в качестве топлива в ракетах (и торпедах). Притом использоваться она может как в виде окислителя в двухкомпонентных двигателях (например, как замена жидкого кислорода), так и в виде т.н. монотоплива. В последнем случае H
2
O
2
закачивается в “камеру сгорания”, где разлагается на металлическом катализаторе (любой из металлов, упомянутых ранее в статье, например, серебро или платина) и под давлением, в виде пара с температурой около 600 °C, выходит из сопла, создавая тягу.
Самое интересное, что такое же внутреннее устройство (“камера сгорания”, сопла и т.п.) имеет внутри своего тельца небольшой жук из подсемейства жужелиц. Жук-бомбардир он называется официально, но мне вот его внутреннее устройство (=картинка в начале статьи) напоминает агрегат из упомянутого выше фильма 1991 года 🙂
Бомбардиром жучок называется потому как способен более или менее прицельно выстреливать из желёз в задней части брюшка кипящей жидкостью с неприятным запахом.
Температура выброса может достигать 100 градусов по Цельсию, а скорость выброса 10 м/с. Один выстрел длится от 8 до 17 мс, и состоит из 4–9 непосредственно следующих друг за другом импульсов. Чтобы не пришлось перематывать в начало, повторю здесь картинку (она вроде взята из журнала
Science за 2015 год
из «одноименной» статьи).
Жук продуцирует внутри себя два “компонента ракетного топлива” (т.е. он все ж не “монотопливный”). Сильный восстановитель —
гидрохинон
(использовался ранее как проявитель в фотографии). И сильный окислитель — перекись водорода. При угрозе жук сокращает мышцы, которые выталкивают два реагента через клапанные трубки в смесительную камеру, содержащую воду и смесь ферментов (пероксидаз) разлагающих перекись. В сочетании, реагенты дают бурную экзотермическую реакцию, жидкость закипает и превращается в газ (= “аннигиляция”). В общем, жук обваривает потенциального врага струей кипятка (но для первой космической тяги явно недостаточно). Но…По крайней мере жука вполне можно считать иллюстрацией к разделу
И сильный окислитель — перекись водорода. При угрозе жук сокращает мышцы, которые выталкивают два реагента через клапанные трубки в смесительную камеру, содержащую воду и смесь ферментов (пероксидаз) разлагающих перекись. В сочетании, реагенты дают бурную экзотермическую реакцию, жидкость закипает и превращается в газ (= “аннигиляция”). В общем, жук обваривает потенциального врага струей кипятка (но для первой космической тяги явно недостаточно). Но…По крайней мере жука вполне можно считать иллюстрацией к разделу
Техника безопасности при работе с перекисью водорода
. Мораль следующая:
%USERNAME%, не будь как жук-бомбардир, не смешивай без понимания перекись с восстановителем! 🙂
Дополнение о
т
drWhy
: «Похоже, земной жук-бомбардир стал прообразом плазменного жука из «Звёздного десанта». Вот у него как раз импульса (не тяги!) хватает для развития первой космической скорости, механизм выработался в ходе эволюции и использовался для забрасывания спор на орбиту с целью расширения ареала, а также пригодился в качестве оружия против неповоротливых крейсеров противника»
Ну вот и про жука рассказал и с перекисью разобрались. На этом пока и остановимся.
На этом пока и остановимся.
Важно!
Все остальное (в том числе обсуждение заметок, промежуточные черновики и абсолютно все мои публикации) — можно найти в телеграм-канале
LAB66
. Подписывайтесь и следите за анонсами.
Следующий в очереди на рассмотрение — дихлоизоцианурат натрия и “хлорные таблетки”.
ДОПОЛНЕНИЕ от 05.06.2020: проведена «контрольная закупка» аптечной перекиси. Результаты — смотреть в статье на Patreon. Проверяем, что продается в наших аптеках (картинка кликабельна)!
Благодарности: автор выражает глубокую признательность всем активным участникам комьюнити LAB-66 — людям которые активно финансово поддерживают наш «научно-технический уголок» (= телеграм-канал), наш чат (и экспертов в нем, которые оказывают круглосуточную (!!!) техподдержку), и конечного самого автора. За все это спасибо, ребята, от steanlab!
«осмиевый катализатор» для роста и развития упомянутого выше комьюнити: ===>
1.
мастер кард 5536 0800 1174 5555
2. яндекс деньги 410018843026512
3. веб мани 650377296748
4. крипта BTC: 3QRyF2UwcKECVtk1Ep8scndmCBoRATvZkx, ETH: 0x3Aa313FA17444db70536A0ec5493F3aaA49C9CBf
5. Стать патроном канала LAB-66
Использованные источникиHydrogen Peroxide Technical Library
Decomposition of Hydrogen Peroxide — Kinetics and Review of Chosen Catalysts
Material Compatibility with Hydrogen Peroxide
Шандала М.Г. Актуальные вопросы общей дезинфектологии. Избранные лекции. — М.: Медицина, 2009. 112 с.
Lewis, R.J. Sr. Sax’s Dangerous Properties of Industrial Materials. 12th Edition. Wiley-Interscience, Wiley & Sons, Inc. Hoboken, NJ. 2012., p. V4: 2434
Haynes, W.M. CRC Handbook of Chemistry and Physics. 95th Edition. CRC Press LLC, Boca Raton: FL 2014-2015, p. 4-67
W.T. Hess «Hydrogen Peroxide». Kirk-Othmer Encyclopedia of Chemical Technology. 13 (4th ed.). New York: Wiley. (1995). pp. 961–995.
(1995). pp. 961–995.
C. W. Jones, J. H. Clark. Applications of Hydrogen Peroxide and Derivatives. Royal Society of Chemistry, 1999.
Ronald Hage, Achim Lienke; Lienke Applications of Transition-Metal Catalysts to Textile and Wood-Pulp Bleaching. Angewandte Chemie International Edition. 45 (2): 206–222. (2005).
Schildknecht, H.; Holoubek, K. The bombardier beetle and its chemical explosion. Angewandte Chemie. 73: 1–7. (1961).
Jones, Craig W. Applications of hydrogen peroxide and its derivatives. Royal Society of Chemistry (1999)
Goor, G.; Glenneberg, J.; Jacobi, S. Hydrogen Peroxide. Ullmann’s Encyclopedia of Industrial Chemistry. Ullmann’s Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. (2007).
Ascenzi, Joseph M., ed. Handbook of disinfectants and antiseptics. New York: M. Dekker. p. 161. (1996).
Rutala, W. A.; Weber, D. J. Disinfection and Sterilization in Health Care Facilities: What Clinicians Need to Know. Clinical Infectious Diseases. 39 (5): 702–709. (2004).
39 (5): 702–709. (2004).
Block, Seymour S., ed. Chapter 9: Peroxygen compounds. Disinfection, sterilization, and preservation (5th ed.). Philadelphia: Lea & Febiger. pp. 185–204. (2000).
O’Neil, M.J. The Merck Index — An Encyclopedia of Chemicals, Drugs, and Biologicals. Cambridge, UK: Royal Society of Chemistry, 2013., p. 889
Larranaga, M.D., Lewis, R.J. Sr., Lewis, R.A.; Hawley’s Condensed Chemical Dictionary 16th Edition. John Wiley & Sons, Inc. Hoboken, NJ 2016., p. 735
Sittig, M. Handbook of Toxic and Hazardous Chemicals and Carcinogens, 1985. 2nd ed. Park Ridge, NJ: Noyes Data Corporation, 1985., p. 510
Larranaga, M.D., Lewis, R.J. Sr., Lewis, R.A.; Hawley’s Condensed Chemical Dictionary 16th Edition. John Wiley & Sons, Inc. Hoboken, NJ 2016., p. 735
Сборник важнейших официальных материалов по вопросам дезинфекции, стерилизации, дезинсекции, дератизации: В 5 т. / Информ.-изд. центр Госкомсанэпиднадзора Рос. Федерации, НИИ профилакт. токсикологии и дезинфекции; Под общ. ред. М. Г. Шандалы. — М.: ТОО «Рарогъ», 1994
токсикологии и дезинфекции; Под общ. ред. М. Г. Шандалы. — М.: ТОО «Рарогъ», 1994
И чуть не забыл, предупреждение для несознательных товарищей 🙂
Disclaimer: вся информация, изложенная в статье, предоставлена сугубо с информационными целями и не является прямым призывом к действию. Все манипуляции с химическими реактивами и оборудованием вы проводите на свой страх и риск. Автор не несет никакой ответственности за небрежное обращение с агрессивными растворами, безграмотность, отсутствие базовых школьных знаний и т.п. Если не чувствуете в себе уверенности понять написанное — попросите проконтролировать ваши действия родственника/друга/знакомого который имеет профильное образование. И обязательно используйте СИЗ с максимально точным соблюдением техники безопасности.
Физические и химические свойства перекиси водорода
Физические свойства перекиси водорода
(i) Перекись водорода представляет собой сиропообразную жидкость бледно-голубого цвета.
(ii) Перекись водорода кипит и разлагается при 150 C и замерзает примерно при -0,9 C
(iii) Перекись водорода растворяется в воде с образованием очень слабого кислого раствора.
перекись водорода и химикаты в пробирках.
Химические свойства перекиси водорода
(i) Разложение: Пероксид водорода разлагается с образованием воды и кислорода при контакте с воздухом. Это разложение является экзотермическим и ускоряется нагреванием, добавлением щелочей и введением тонкоизмельченных металлов, таких как платина, золото и оксид марганца (IV), который действует как катализатор.
2H 2 O 2 (л) → 2H 2 O(л) + O 2 (г)
Минеральные кислоты и пропан-1,2,3-триол ингибируют разложение перекиси водорода. Эти соединения часто добавляют к промышленной перекиси водорода, чтобы свести к минимуму ее разложение.
Эти соединения часто добавляют к промышленной перекиси водорода, чтобы свести к минимуму ее разложение.
(ii) Перекись водорода в качестве окислителя: Перекись водорода является сильным окислителем, поскольку она может легко отдавать кислород или принимать электроны.В этом процессе он превращается в воду. Его окислительные свойства можно увидеть в его реакции с раствором йодида калия, который был подкислен тетраоксосульфатной (VI) кислотой, где он высвобождает йод. Тетраоксосульфатная (VI) кислота сначала реагирует с йодидом с образованием йодной кислоты HI, которая затем окисляется перекисью водорода с выделением йода. Процесс окисления, осуществляемый перекисью водорода, осуществляется за счет того, что он принимает электроны от иодид-иона и сам восстанавливается до воды.
2KI(водн.) + H 2 O(водн.) +H 2 SO 4 (водн.) →K 2 SO 4 (водн.) + 2H 2 O(l) + 2H 2 O(l) + 2 (водный)
(iii) Перекись водорода в качестве восстановителя: Перекись водорода также может вести себя как восстановитель, когда она реагирует с более сильными окислителями, отдавая электроны или принимая кислород. Процесс восстановления приводит к тому, что сама перекись водорода превращается в газообразный кислород.Например, перекись водорода восстанавливает подкисленный раствор тетраоксоманганата калия (VII), делая его бесцветным, поскольку фиолетовый ион тетраоксоманганата (VII) превращается в бледно-розовый ион марганца (II).
Процесс восстановления приводит к тому, что сама перекись водорода превращается в газообразный кислород.Например, перекись водорода восстанавливает подкисленный раствор тетраоксоманганата калия (VII), делая его бесцветным, поскольку фиолетовый ион тетраоксоманганата (VII) превращается в бледно-розовый ион марганца (II).
2kmno 4 (AQ) + 3H 2 SO 4 (AQ) + 5H 2 O 2 (AQ) → K 2 SO 4 (AQ) + 2MNSO 4 ( водн.) 8H 2 O(ж) + 5O 2 (г)
Перекись водорода может в равной степени восстанавливать хлор до соляной кислоты и оксид серебра до металла.
Cl 2 (г) + H 2 O 2 (водн.) → 2HCl (водн.) + O 2
Ag 2 O(s) + H 2 O 2 (водн.) → 2Ag(s) + H 2 O(l) O 2
Перекись водорода – обзор
5.
 1 Введение
1 Введение
Перекись водорода – универсальный и широко используемый окислительный отбеливатель в целлюлозно-бумажной промышленности (Anderson, 1992; Anderson and Amini, 1996; Gullichsen, 2000; Troughton and Sarot, 1992; Нельсон и др., 1995, 1998; Лашеналь и др., 1992, 1996; Рив, 1996; Пикка и др., 2000; Биман и Райхерт, 1953 г .; Холладей и Солари, 1963 г .; Эндрюс и Сингх, 1979). Он разлагается только с образованием воды и кислорода, поэтому он идеально подходит для применений, где воздействие сточных вод на окружающую среду должно быть минимальным. В области отбеливания химической целлюлозы перекись водорода используется в основном в качестве усиления на существующих стадиях отбеливания (Андерсон, 1992; Андерсон и Амини, 1996). Многие заводы используют перекись водорода в качестве усиления на стадии экстракции после хлорирования, с дополнительным кислородным усилением или без него, а также на второй стадии экстракции.Перекись водорода в щелочной экстракции позволяет сократить использование хлорированных соединений, а также обеспечивает ряд улучшений качества целлюлозы и стоков отбеливающих установок (Walsh et al. , 1991). Заводы также используют пероксид для уменьшения общего количества применяемого диоксида хлора на последней стадии D. На заключительном этапе или в отбеленном контейнере для хранения высокой плотности перекись является хорошим отбеливающим агентом и может обеспечить повышенную стабильность яркости. Когда пероксид используется для усиления стадии экстракции, условия процесса относительно мягкие, и разложение не является основным фактором.Однако, когда пероксид используется в качестве основного реагента для отбеливания и делигнификации, обычно необходимо проводить стадию пероксида при более высоких температурах (> 100 °C) и под давлением (Lachenal et al., 1992; Carlos et al., 1980). . В этих условиях необходимо управлять двумя конкурирующими реакциями (отбеливание целлюлозы и разложение пероксида). Поскольку переходные металлы катализируют разложение перекиси водорода, эту нежелательную реакцию необходимо свести к минимуму за счет снижения содержания металлов в пульпе.Специально разработанные ступени с перекисью водорода под давлением (PO) были установлены в коммерческих предприятиях и привели к улучшению реакции отбеливания при более низком потреблении перекиси водорода (Tibbling and Dillner, 1993; Dillner and Tibbling, 1994; Germgard and Norden, 1994).
, 1991). Заводы также используют пероксид для уменьшения общего количества применяемого диоксида хлора на последней стадии D. На заключительном этапе или в отбеленном контейнере для хранения высокой плотности перекись является хорошим отбеливающим агентом и может обеспечить повышенную стабильность яркости. Когда пероксид используется для усиления стадии экстракции, условия процесса относительно мягкие, и разложение не является основным фактором.Однако, когда пероксид используется в качестве основного реагента для отбеливания и делигнификации, обычно необходимо проводить стадию пероксида при более высоких температурах (> 100 °C) и под давлением (Lachenal et al., 1992; Carlos et al., 1980). . В этих условиях необходимо управлять двумя конкурирующими реакциями (отбеливание целлюлозы и разложение пероксида). Поскольку переходные металлы катализируют разложение перекиси водорода, эту нежелательную реакцию необходимо свести к минимуму за счет снижения содержания металлов в пульпе.Специально разработанные ступени с перекисью водорода под давлением (PO) были установлены в коммерческих предприятиях и привели к улучшению реакции отбеливания при более низком потреблении перекиси водорода (Tibbling and Dillner, 1993; Dillner and Tibbling, 1994; Germgard and Norden, 1994).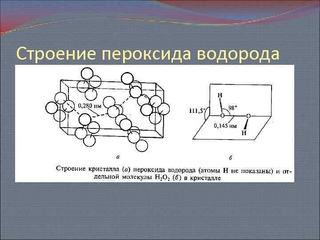 Коммерческие последовательности, сочетающие стадию озона и стадию (PO), приняли форму OZQ (PO).
Коммерческие последовательности, сочетающие стадию озона и стадию (PO), приняли форму OZQ (PO).
Условия этих усиленных ступеней экстракции обычно такие же, как и исходные ступени экстракции на мельнице.К счастью, перекись водорода хорошо работает в обычных условиях экстракции в обычной последовательности, а использование хлора и отбеливающих химикатов на основе хлора можно сократить при умелом применении умеренных количеств перекиси водорода. Необходимость сокращения использования газообразного хлора для отбеливания целлюлозы больше не является предметом споров. Давление рынка все чаще заставляет целлюлозные заводы сокращать выбросы всех сточных вод с конечной целью полностью закрыть завод.Закрытие мельницы будет затруднено, если рециркуляционные потоки содержат ионы хлорида из-за их высокой коррозионной активности. Как следствие, одним из этапов на пути к закрытию завода является разработка жизнеспособной последовательности, полностью не содержащей хлора (TCF). В краткосрочной перспективе последовательность TCF позволит заводам работать с наименьшим загрязнением окружающей среды, пока осуществляется разработка необходимых процессов рециклинга. Кроме того, процесс отбеливания TCF не вызывает образования хлорорганических веществ в целлюлозе.
Кроме того, процесс отбеливания TCF не вызывает образования хлорорганических веществ в целлюлозе.
Перекись водорода является сильным кандидатом для использования в последовательностях TCF (van Lierop et al., 1993; Troughton et al., 1994; Lapierre et al., 1995b). Перекись водорода наиболее известна своими реакциями отбеливания при щелочных значениях pH при механической и химической отбеливании целлюлозы, а также при удалении краски. Перекись водорода также может быть использована в качестве исходного химиката для производства пероксикислот. Пероксикислоты, обладающие более высоким окислительным потенциалом, чем перекись водорода, способны избирательно окислять лигнин (Basta et al., 1994а; Амини и Вебстер, 1994 г.; Либерготт, 1994; Андерсон и др., 1995; Секкомб и др., 1994; Генг и др., 1993; Девенинс и др., 1993, 1994а, б; Поппиус-Левлин и др., 1991; Лай и Сарканен, 1968). Пероксикислоты могут повысить порог белизны TCF целлюлозы на 3–4 балла при применении в начале последовательности отбеливания крафт-TCF (Basta et al. , 1994a). Они также исследуются в качестве средств активации кислородных стадий и стадий отбеливания перекисью водорода (Amini and Webster, 1994; Liebergott, 1994).
, 1994a). Они также исследуются в качестве средств активации кислородных стадий и стадий отбеливания перекисью водорода (Amini and Webster, 1994; Liebergott, 1994).
При работе с последовательностями, не содержащими хлора, условия, при которых используется перекись водорода, должны быть подобраны так, чтобы она работала наиболее эффективно. Эти условия часто можно легко найти на существующих целлюлозно-бумажных комбинатах. Недавние успехи в отбеливании перекисью водорода стали возможными благодаря лучшему пониманию роли ионов металлов в разложении перекиси (Lapierre et al., 1995b). Перекись водорода не является хорошим делигнифицирующим агентом, и в обычных условиях для крафт-целлюлозы ее остаточное количество остается в растворе.При использовании более жестких условий пероксид разлагается ионами металлов в пульпе. Если используется правильная процедура обращения с металлом, температура и время отбеливания могут быть увеличены, чтобы получить более выгодное потребление перекиси водорода и более высокую конечную белизну.
Refraction — New World Encyclopedia
Соломинка, смоченная в цветном растворе, кажется сломанной из-за преломления света при переходе из раствора в воздух.
Преломление — это изменение направления волны вследствие изменения ее скорости, наблюдаемое при переходе волны из одной среды в другую.Наиболее распространенным примером является преломление света, как это происходит при образовании радуги на небе или радужных полос, когда белый свет проходит через стеклянную призму. Преломлению подвергаются и другие типы волн, например, при переходе звуковых волн из одной среды в другую.
Преломление волн в среде количественно определяется так называемым показателем преломления (или показателем преломления ). Показатель преломления среды — это мера того, насколько скорость света (или других волн) уменьшается внутри среды по сравнению со скоростью света в вакууме или воздухе.Например, если образец стекла имеет показатель преломления 1,5, это означает, что скорость света, проходящего через стекло, в 1/1,5 = 0,67 раз больше скорости света в вакууме или воздухе. .
.
На основе знаний о свойствах преломления и показателя преломления был разработан ряд приложений. Например, изобретение линз и телескопов-рефракторов основано на понимании преломления. Также знание показателя преломления различных веществ используется для оценки чистоты вещества или измерения его концентрации в смеси.При проверке зрения, проводимой офтальмологами или оптометристами, свойство рефракции лежит в основе метода, известного как рефрактометрия .
Объяснение
В оптике преломление происходит, когда световые волны распространяются из среды с определенным показателем преломления во вторую среду с другим показателем преломления. На границе сред фазовая скорость волны изменяется, она меняет направление, длина волны увеличивается или уменьшается, но частота остается постоянной.Например, световой луч будет преломляться, когда он входит и выходит из стекла. Понимание этой концепции привело к изобретению линз и телескопа-рефрактора.
Преломление световых волн в воде. Темный прямоугольник представляет фактическое положение карандаша в миске с водой. Светлый прямоугольник представляет видимое положение карандаша. Обратите внимание, что конец (X) выглядит так, как будто он находится в (Y), положение, которое значительно меньше, чем (X).
Темный прямоугольник представляет фактическое положение карандаша в миске с водой. Светлый прямоугольник представляет видимое положение карандаша. Обратите внимание, что конец (X) выглядит так, как будто он находится в (Y), положение, которое значительно меньше, чем (X).
Преломление можно увидеть, глядя в чашу с водой.Воздух имеет показатель преломления около 1,0003, а вода имеет показатель преломления около 1,33. Если человек смотрит на прямой предмет, например, на карандаш или соломинку, который находится под наклоном частично в воде, кажется, что этот предмет изгибается у поверхности воды. Это происходит из-за искривления световых лучей при переходе из воды в воздух. Как только лучи достигают глаза, глаз прослеживает их обратно в виде прямых линий (линий взгляда). Линии обзора (показанные пунктирными линиями) пересекаются в более высоком положении, чем место, где исходят фактические лучи.Это приводит к тому, что карандаш кажется выше, а вода кажется более мелкой, чем она есть на самом деле. Глубина, которой кажется вода, если смотреть сверху, известна как кажущаяся глубина,
Глубина, которой кажется вода, если смотреть сверху, известна как кажущаяся глубина,
Схема преломления волн на воде
На диаграмме справа показан пример преломления волн на воде. Рябь движется слева и проходит по более мелкой области, наклоненной под углом к фронту волны. Волны распространяются медленнее на мелководье, поэтому длина волны уменьшается, и волна изгибается на границе.Пунктирная линия представляет нормаль к границе. Пунктирная линия представляет исходное направление волн. Это явление объясняет, почему волны на береговой линии никогда не ударяются о береговую линию под углом. В каком бы направлении ни двигались волны в глубокой воде, они всегда преломляются к нормали, когда входят в более мелкую воду возле пляжа.
Преломление также отвечает за радугу и за расщепление белого света на радужный спектр, когда он проходит через стеклянную призму.Стекло имеет более высокий показатель преломления, чем воздух, и разные частоты света распространяются с разной скоростью (рассеивание), в результате чего они преломляются под разными углами, так что вы можете их видеть. Разные частоты соответствуют разным наблюдаемым цветам.
Разные частоты соответствуют разным наблюдаемым цветам.
В то время как преломление позволяет создавать красивые явления, такие как радуга, оно также может создавать необычные оптические явления, такие как миражи и фата-моргана. Это связано с изменением показателя преломления воздуха в зависимости от температуры.
Преломление в плексигласовом (акриловом) блоке.
Закон Снелла используется для расчета степени преломления света при переходе из одной среды в другую.
Недавно были созданы метаматериалы с отрицательным показателем преломления.
С метаматериалами мы также можем получить явления полного преломления, когда волновые сопротивления двух сред совпадают. Отраженной волны нет.
Кроме того, поскольку рефракция может заставить объекты казаться ближе, чем они есть на самом деле, она позволяет воде увеличивать объекты.Во-первых, когда свет входит в каплю воды, он замедляется. Если поверхность воды не плоская, то свет изгибается в новый путь. Эта круглая форма изгибает свет наружу, и по мере его распространения изображение, которое вы видите, становится больше.
Показатель преломления
показатель преломления (или показатель преломления ) среды представляет собой обратное отношение фазовой скорости (определяемой ниже) волнового явления, такого как свет или звук, и фазовой скорости в эталонной среде (веществе, которое волна проходит).Чаще всего он используется в контексте света с вакуумом в качестве эталонной среды, хотя исторически были распространены другие эталонные среды (например, воздух при стандартном давлении и температуре). Обычно ему присваивается символ n, . В случае света он равен
- n=ϵr до н.э. ;r {\displaystyle n={\sqrt {\epsilon _{r}\mu _{r}}}},
, где ε r — относительная диэлектрическая проницаемость материала (как материал влияет на электрическую поле), а μ r — его относительная магнитная проницаемость (как материал реагирует на магнитное поле).Для большинства материалов μ r очень близко к 1 на оптических частотах, поэтому n приблизительно равно ϵr {\ displaystyle {\ sqrt {\ epsilon _ {r}}}}. n может быть меньше 1, и это имеет практические технические применения, такие как эффективные зеркала для рентгеновских лучей на основе полного внутреннего отражения.
n может быть меньше 1, и это имеет практические технические применения, такие как эффективные зеркала для рентгеновских лучей на основе полного внутреннего отражения.
Фазовая скорость определяется как скорость, с которой любая часть сигнала перемещается в пространстве; то есть скорость, с которой движется фаза сигнала.Групповая скорость представляет собой скорость распространения огибающей формы волны; то есть скорость изменения амплитуды (максимальное движение вверх и вниз) формы волны. Именно групповая скорость, скорость, с которой гребни и впадины волны движутся в пространстве, (почти всегда) представляет собой скорость, с которой информация (и энергия) может передаваться волной, — например, скорость, с которой импульс света распространяется по оптическому волокну.
Скорость света
Преломление света на границе двух сред с разными показателями преломления, при n 2 > n 1 .Во второй среде скорость меньше (v 2 1 ), поэтому угол преломления θ 2 меньше угла падения θ 1 ; то есть луч в среде с более высоким индексом ближе к нормали.
Скорость всего электромагнитного излучения в вакууме одинакова, примерно 3×10 8 метров в секунду, и обозначается c .
Следовательно, если v — фазовая скорость излучения определенной частоты в конкретном материале, показатель преломления определяется выражением
- n = cv {\ displaystyle n = {\ frac {c} {v}}}.
Обычно это число больше единицы: чем выше индекс материала, тем сильнее замедляется свет. Однако на определенных частотах (например, рентгеновские лучи) n на самом деле будет меньше единицы. Это не противоречит теории относительности, согласно которой ни один несущий информацию сигнал никогда не может распространяться быстрее, чем c, , потому что фазовая скорость не совпадает с групповой скоростью или скорость сигнала не совпадает с групповой скоростью, за исключением случаев, когда волна проходит через поглощающую среду.
Иногда определяют «показатель преломления групповой скорости», обычно называемый групповым показателем :
- ng = cvg {\ displaystyle n_ {g} = {\ frac {c} {v_ {g}}}}
, где v g — групповая скорость. Это значение не следует путать с n, , которое всегда определяется относительно фазовой скорости.
Это значение не следует путать с n, , которое всегда определяется относительно фазовой скорости.
На микроуровне фазовая скорость электромагнитной волны замедляется в материале, потому что электрическое поле создает возмущение в зарядах каждого атома (в первую очередь электронов), пропорциональное (соотношение ау = кх {\ displaystyle y = kx}) диэлектрическая проницаемость.Заряды, как правило, колеблются немного не в фазе относительно управляющего электрического поля. Таким образом, заряды излучают собственную электромагнитную волну той же частоты, но с фазовой задержкой. Макроскопическая сумма всех таких вкладов в материале представляет собой волну с той же частотой, но меньшей длиной волны, чем исходная, что приводит к замедлению фазовой скорости волны. Большая часть излучения колеблющихся материальных зарядов модифицирует приходящую волну, изменяя ее скорость.Однако некоторая чистая энергия будет излучаться в других направлениях (см. рассеяние).
Если известны показатели преломления двух материалов для заданной частоты, то по закону Снеллиуса можно вычислить угол, на который будет преломляться излучение этой частоты при переходе от первого материала ко второму.
Отрицательный показатель преломления
Недавние исследования также продемонстрировали существование отрицательного показателя преломления, которое может иметь место, если ε и μ являются одновременно отрицательными.Не считается естественным, это может быть достигнуто с помощью так называемых метаматериалов. Он предлагает возможность создания идеальных линз и других экзотических явлений, таких как обращение закона Снеллиуса.
Список показателей преломления
Многие материалы имеют хорошо охарактеризованные показатели преломления, но эти показатели сильно зависят от частоты света. Поэтому любое числовое значение индекса не имеет смысла, если не указана соответствующая частота.
Существуют также более слабые зависимости от температуры, давления/напряжения и т. д., а также от точного состава материала.Однако для многих материалов и типичных условий эти вариации находятся на уровне процентов или меньше. Поэтому особенно важно указать источник для измерения индекса, если требуется точность.
В общем случае показатель преломления представляет собой комплексное число, имеющее как действительную, так и мнимую часть, где последняя указывает на силу потерь поглощения на определенной длине волны — поэтому мнимую часть иногда называют коэффициентом экстинкции k. Такие потери становятся особенно значительными, например, в металлах при коротких длинах волн (таких как видимый свет) и должны быть включены в любое описание показателя преломления.
Рассеивание и абсорбция
В реальных материалах поляризация не мгновенно реагирует на приложенное поле. Это вызывает диэлектрические потери, которые могут быть выражены диэлектрической проницаемостью, которая является комплексной и зависит от частоты. Реальные материалы также не являются идеальными изоляторами, а это означает, что они имеют ненулевую проводимость постоянного тока (DC). Принимая во внимание оба аспекта, мы можем определить комплексный показатель преломления:
- n~=n−iκ{\displaystyle {\tilde {n}}=ni\kappa}
Здесь n — показатель преломления, указывающий фазовую скорость, а κ называется коэффициентом экстинкции, который указывает величину потери поглощения, когда электромагнитная волна распространяется через материал. И n , и κ зависят от частоты.
И n , и κ зависят от частоты.
Эффект, заключающийся в том, что n изменяется в зависимости от частоты (за исключением вакуума, где все частоты c распространяются с одинаковой скоростью), известен как дисперсия, и это то, что заставляет призму делить белый свет на составляющие его спектральные цвета, именно так образуются радуги в дождь или туман. Дисперсия также является причиной хроматических аберраций в объективах.
Поскольку показатель преломления материала зависит от частоты (и, следовательно, длины волны) света, обычно указывается соответствующая длина волны в вакууме, при которой измеряется показатель преломления.Как правило, это делается на различных четко определенных спектральных линиях излучения; например, n D — это показатель преломления на линии Фраунгофера «D», центре желтого двойного излучения натрия на длине волны 589,29 нм.
Уравнение Селлмейера — это эмпирическая формула, которая хорошо работает при описании дисперсии, и коэффициенты Селлмейера часто указываются в таблицах вместо показателя преломления. Некоторые репрезентативные показатели преломления на разных длинах волн см. в списке показателей преломления.
Некоторые репрезентативные показатели преломления на разных длинах волн см. в списке показателей преломления.
Как показано выше, диэлектрические потери и ненулевая проводимость по постоянному току в материалах вызывают поглощение. Хорошие диэлектрические материалы, такие как стекло, имеют чрезвычайно низкую проводимость по постоянному току, а на низких частотах диэлектрические потери также незначительны, что приводит к почти полному отсутствию поглощения (κ ≈ 0). Однако на более высоких частотах (таких как видимый свет) диэлектрические потери могут значительно увеличить поглощение, уменьшая прозрачность материала для этих частот.
Действительная и мнимая части комплексного показателя преломления связаны соотношением Крамерса-Кронига.Например, можно определить полный комплексный показатель преломления материала как функцию длины волны из спектра поглощения материала.
Двулучепреломление
Кристалл кальцита, лежащий на бумаге, с некоторыми буквами, показывающими двойное лучепреломление.
Показатель преломления некоторых сред может различаться в зависимости от поляризации и направления распространения света в среде. Это известно как двойное лучепреломление и описано в области кристаллооптики.
Нелинейность
Сильное электрическое поле света высокой интенсивности (например, излучение лазера) может вызывать изменение показателя преломления среды при прохождении через нее света, что приводит к возникновению нелинейной оптики.Если показатель изменяется квадратично с полем (линейно с интенсивностью), это называется оптическим эффектом Керра и вызывает такие явления, как самофокусировка и фазовая самомодуляция. Если индекс изменяется линейно с полем (что возможно только в материалах, не обладающих инверсионной симметрией), это называется эффектом Поккельса.
Неоднородность
Линза с градиентным показателем преломления с параболическим изменением показателя преломления (n) с радиальным расстоянием (x) .Линза фокусирует свет так же, как и обычная линза.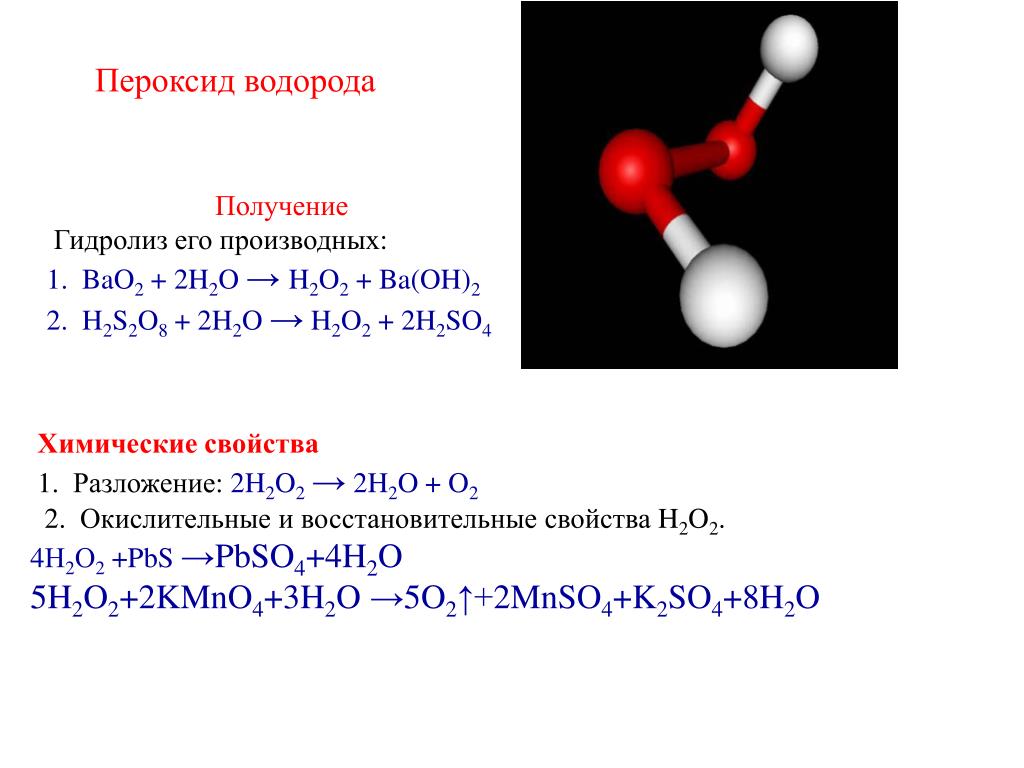
Если показатель преломления среды не является постоянным, а постепенно изменяется в зависимости от положения, материал известен как среда с градиентным показателем преломления и описывается оптикой с градиентным показателем. Свет, проходящий через такую среду, может быть искривлен или сфокусирован, и этот эффект можно использовать для изготовления линз, некоторых оптических волокон и других устройств. Некоторые распространенные миражи вызваны пространственно изменяющимся показателем преломления воздуха.
Приложения
Показатель преломления материала является наиболее важным свойством любой оптической системы, использующей свойство преломления.Он используется для расчета фокусирующей способности линз и рассеивающей способности призм.
Поскольку показатель преломления является фундаментальным физическим свойством вещества, его часто используют для идентификации конкретного вещества, подтверждения его чистоты или измерения его концентрации. Показатель преломления используется для измерения твердых тел (очки и драгоценные камни), жидкостей и газов.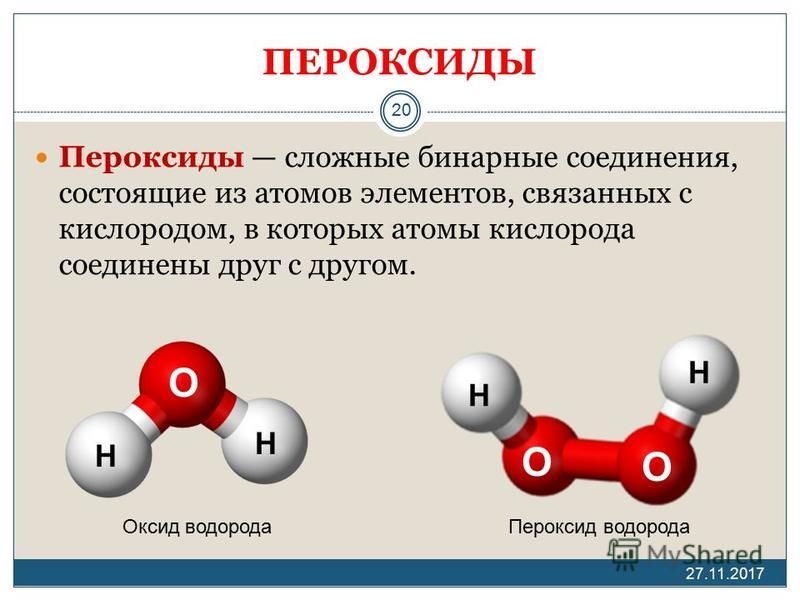 Чаще всего он используется для измерения концентрации растворенного вещества в водном растворе. Рефрактометр — это прибор, используемый для измерения показателя преломления.Для раствора сахара показатель преломления можно использовать для определения содержания сахара.
Чаще всего он используется для измерения концентрации растворенного вещества в водном растворе. Рефрактометр — это прибор, используемый для измерения показателя преломления.Для раствора сахара показатель преломления можно использовать для определения содержания сахара.
В медицине, особенно в офтальмологии и оптометрии, метод рефрактометрии использует свойство преломления для проведения проверки зрения. Это клинический тест, в котором используется фороптер для определения аномалии рефракции глаза и, исходя из этого, назначаются лучшие корректирующие линзы. Представлен ряд тестовых линз с разной оптической силой или фокусным расстоянием, чтобы определить, какие из них обеспечивают наиболее четкое и четкое зрение.
Альтернативное значение: Рефракция в металлургии
В металлургии термин преломление имеет другое значение. Это свойство металлов, которое указывает на их способность противостоять нагреву. Металлы с высокой степенью преломления относятся к тугоплавким . Эти металлы имеют высокие температуры плавления из-за сильных межатомных сил, которые участвуют в металлических связях. Для преодоления этих сил требуется большое количество энергии.
Эти металлы имеют высокие температуры плавления из-за сильных межатомных сил, которые участвуют в металлических связях. Для преодоления этих сил требуется большое количество энергии.
Примеры тугоплавких металлов включают молибден, ниобий, вольфрам и тантал.Карбид гафния — самое тугоплавкое известное бинарное соединение с температурой плавления 3890 градусов C. [1] [2]
См. также
Ссылки
Ссылки ISBN поддерживают NWE за счет реферальных сборов
- Фишбейн, Пол М. и др. 2005. Физика для ученых и инженеров, 3-е изд. Река Аппер-Сэдл, Нью-Джерси: Pearson Education. ISBN 0131418815.
Внешние ссылки
Все ссылки получены 27 июля 2019 г.
Кредиты
New World Encyclopedia авторов и редакторов переписали и дополнили статью в Википедии
в соответствии со стандартами New World Encyclopedia .Эта статья соответствует условиям лицензии Creative Commons CC-by-sa 3.0 (CC-by-sa), которая может использоваться и распространяться с надлежащим указанием авторства. Упоминание должно быть выполнено в соответствии с условиями этой лицензии, которая может ссылаться как на авторов New World Encyclopedia , так и на самоотверженных добровольных участников Фонда Викимедиа. Чтобы процитировать эту статью, щелкните здесь, чтобы просмотреть список допустимых форматов цитирования. История более ранних вкладов википедистов доступна исследователям здесь:
Упоминание должно быть выполнено в соответствии с условиями этой лицензии, которая может ссылаться как на авторов New World Encyclopedia , так и на самоотверженных добровольных участников Фонда Викимедиа. Чтобы процитировать эту статью, щелкните здесь, чтобы просмотреть список допустимых форматов цитирования. История более ранних вкладов википедистов доступна исследователям здесь:
История этой статьи с момента ее импорта в New World Encyclopedia :
Примечание. На использование отдельных изображений, лицензированных отдельно, могут распространяться некоторые ограничения.
Диэлектрик — Энциклопедия Нового Света
Различные типы конденсаторов. Каждый конденсатор состоит из пары проводящих пластин, разделенных диэлектриком.
Диэлектрик или электрический изолятор представляет собой материал, обладающий высокой устойчивостью к протеканию электрического тока. Диэлектрические материалы могут быть твердыми, жидкими или газообразными. Кроме того, вакуум является отличным диэлектриком.
Кроме того, вакуум является отличным диэлектриком.
Важным применением диэлектриков является разделение пластин конденсаторов.Способность конденсатора накапливать электрический заряд зависит от диэлектрика, разделяющего его пластины.
Объяснение
При взаимодействии диэлектрической среды с приложенным электрическим полем происходит перераспределение зарядов внутри ее атомов или молекул. Это перераспределение меняет форму приложенного электрического поля как внутри диэлектрической среды, так и в близлежащей области.
При движении двух электрических зарядов через диэлектрическую среду энергии взаимодействия и силы между ними уменьшаются.Когда электромагнитная волна проходит через диэлектрик, ее скорость уменьшается, а длина волны укорачивается.
Когда электрическое поле первоначально прикладывается к диэлектрической среде, протекает ток. Полный ток , протекающий через реальный диэлектрик, состоит из двух частей: тока проводимости и тока смещения. В хороших диэлектриках ток проводимости будет крайне мал. Ток смещения можно рассматривать как упругую реакцию диэлектрического материала на любое изменение приложенного электрического поля.По мере увеличения величины электрического поля протекает ток смещения, и дополнительное смещение накапливается в диэлектрике в виде потенциальной энергии. Когда электрическое поле уменьшается, диэлектрик высвобождает часть накопленной энергии в виде тока смещения. Электрическое смещение можно разделить на вакуумное и диэлектрическое.
В хороших диэлектриках ток проводимости будет крайне мал. Ток смещения можно рассматривать как упругую реакцию диэлектрического материала на любое изменение приложенного электрического поля.По мере увеличения величины электрического поля протекает ток смещения, и дополнительное смещение накапливается в диэлектрике в виде потенциальной энергии. Когда электрическое поле уменьшается, диэлектрик высвобождает часть накопленной энергии в виде тока смещения. Электрическое смещение можно разделить на вакуумное и диэлектрическое.
- D = ε0E + P = ε0E + ε0χE = ε0E (1 + χ), {\ displaystyle \ mathbf {D} = \ varepsilon _ {0} \ mathbf {E} + \ mathbf {P} = \ varepsilon _ { 0}\mathbf {E} +\varepsilon _{0}\chi \mathbf {E} =\varepsilon _{0}\mathbf {E} \left(1+\chi \right),}
, где P — поляризация среды, E — электрическое поле, D — плотность электрического потока (или смещения) и его электрическая восприимчивость.Отсюда следует, что относительная диэлектрическая проницаемость и восприимчивость диэлектрика связаны: εr = χ + 1 {\ displaystyle \ varepsilon _ {r} = \ chi +1}.
Диэлектрическая проницаемость
Диэлектрическая проницаемость (или статическая диэлектрическая проницаемость) материала (при данных условиях) является мерой степени, в которой материал концентрирует электростатические линии потока. На практике она измеряется как «относительная диэлектрическая проницаемость», которая определяется как отношение количества электрической энергии, запасенной в изоляторе, когда на него наложено статическое электрическое поле, к диэлектрической проницаемости вакуума (который имеет диэлектрическая проницаемость 1).
Относительная диэлектрическая проницаемость представлена как ε r (или иногда κ{\ displaystyle \ kappa}, K или Dk). Математически это определяется как:
, где материала, а ε 0 — диэлектрическая проницаемость вакуума. Диэлектрическая проницаемость вакуума выводится из уравнений Максвелла путем связывания напряженности электрического поля E с плотностью электрического потока D . В вакууме (свободном пространстве) диэлектрическая проницаемость ε равна всего лишь ε 0 , поэтому диэлектрическая проницаемость равна единице.
В вакууме (свободном пространстве) диэлектрическая проницаемость ε равна всего лишь ε 0 , поэтому диэлектрическая проницаемость равна единице.
Диэлектрическая проницаемость
Диэлектрическая проницаемость — это физическая величина, описывающая, как электрическое поле влияет на диэлектрическую среду, и определяется способностью материала поляризоваться в ответ на поле и, таким образом, уменьшать поле внутри материала. Таким образом, диэлектрическая проницаемость относится к способности материала пропускать (или «разрешать») электрическое поле.
Непосредственно связан с электрической восприимчивостью. Например, в конденсаторе повышенная диэлектрическая проницаемость позволяет сохранять тот же заряд при меньшем электрическом поле (и, следовательно, меньшем напряжении), что приводит к увеличению емкости.
Диэлектрическая прочность
Термин диэлектрическая прочность может быть определен следующим образом:
- Для изоляционного материала диэлектрическая прочность представляет собой максимальную напряженность электрического поля, которую материал может выдержать без разрушения, то есть без потери своих изоляционных свойств.

- Для данной конфигурации диэлектрического материала и электродов диэлектрическая прочность представляет собой минимальное электрическое поле, вызывающее пробой.
Теоретическая диэлектрическая прочность материала является неотъемлемым свойством сыпучего материала и зависит от конфигурации материала или электродов, с которыми приложено поле. При пробое электрическое поле освобождает связанные электроны. Если приложенное электрическое поле достаточно велико, свободные электроны могут разгоняться до скоростей, которые могут высвободить дополнительные электроны во время столкновений с нейтральными атомами или молекулами в процессе, называемом лавинным пробоем.Пробой происходит довольно резко (обычно за наносекунды), что приводит к образованию электропроводящей дорожки и пробивному разряду через материал. Для твердых материалов пробой серьезно ухудшает или даже разрушает их изоляционную способность.
Напряженность поля пробоя
Напряженность поля, при которой происходит пробой в данном случае, зависит от соответствующей геометрии диэлектрика (изолятора) и электродов, к которым приложено электрическое поле, а также от скорости нарастания электрического поля. Поскольку диэлектрические материалы обычно содержат незначительные дефекты, практическая диэлектрическая прочность будет составлять часть внутренней диэлектрической прочности, наблюдаемой для идеального материала без дефектов. Диэлектрические пленки обладают большей диэлектрической прочностью, чем более толстые образцы того же материала. Например, диэлектрическая прочность пленок диоксида кремния толщиной от нескольких сотен нм до нескольких микрон составляет примерно десять МВ/см. Несколько слоев тонких диэлектрических пленок используются там, где требуется максимальная практическая диэлектрическая прочность, например, в высоковольтных конденсаторах и импульсных трансформаторах.
Поскольку диэлектрические материалы обычно содержат незначительные дефекты, практическая диэлектрическая прочность будет составлять часть внутренней диэлектрической прочности, наблюдаемой для идеального материала без дефектов. Диэлектрические пленки обладают большей диэлектрической прочностью, чем более толстые образцы того же материала. Например, диэлектрическая прочность пленок диоксида кремния толщиной от нескольких сотен нм до нескольких микрон составляет примерно десять МВ/см. Несколько слоев тонких диэлектрических пленок используются там, где требуется максимальная практическая диэлектрическая прочность, например, в высоковольтных конденсаторах и импульсных трансформаторах.
| Материал | Диэлектрическая прочность (МВ/м) |
|---|---|
| Воздух | 3 |
| Кварц | 8 |
| Титанат стронция | 8 |
| Неопреновый каучук | 12 |
| Нейлон | 14 |
| Стекло пирекс | 14 |
| Силиконовое масло | 15 |
| Бумага | 16 |
| Бакелит | 24 |
| Полистирол | 24 |
| Тефлон | 60 |
Диэлектрики в плоскопараллельных конденсаторах
Электроны в молекулах смещаются к положительно заряженной левой пластине. Затем молекулы создают направленное влево электрическое поле, которое частично нейтрализует поле, создаваемое пластинами. (Воздушный зазор показан для наглядности; в реальном конденсаторе диэлектрик обычно находится в непосредственном контакте с пластинами.)
Затем молекулы создают направленное влево электрическое поле, которое частично нейтрализует поле, создаваемое пластинами. (Воздушный зазор показан для наглядности; в реальном конденсаторе диэлектрик обычно находится в непосредственном контакте с пластинами.)
Помещение диэлектрического материала между пластинами конденсатора с параллельными пластинами вызывает увеличение емкости пропорционально к , относительной диэлектрической проницаемости материала:
- C = kϵ0Ad {\ displaystyle C = {\ frac {k \ epsilon _ {0} A} {d}}}
- , где ϵ0{\displaystyle \epsilon _{0}} — диэлектрическая проницаемость свободного пространства, A — площадь, покрытая конденсаторами, а d — расстояние между пластинами.
Это происходит потому, что электрическое поле поляризует связанные заряды диэлектрика, создавая концентрации заряда на его поверхности, которые создают электрическое поле, противоположное (антипараллельное) полю конденсатора. Таким образом, данное количество заряда создает более слабое электрическое поле между пластинами, чем без диэлектрика, что снижает электрический потенциал. Если рассматривать этот аргумент в обратном порядке, этот аргумент означает, что в случае диэлектрика заданный электрический потенциал заставляет конденсатор накапливать большую поляризацию заряда.
Таким образом, данное количество заряда создает более слабое электрическое поле между пластинами, чем без диэлектрика, что снижает электрический потенциал. Если рассматривать этот аргумент в обратном порядке, этот аргумент означает, что в случае диэлектрика заданный электрический потенциал заставляет конденсатор накапливать большую поляризацию заряда.
Приложения
Использование диэлектрика в конденсаторе дает несколько преимуществ. Самый простой из них заключается в том, что проводящие пластины можно размещать очень близко друг к другу без риска контакта. Кроме того, если подвергнуть воздействию очень сильного электрического поля, любое вещество ионизируется и становится проводником. Диэлектрики более устойчивы к ионизации, чем сухой воздух, поэтому конденсатор, содержащий диэлектрик, может подвергаться более высокому рабочему напряжению. Слои диэлектрика обычно включаются в промышленные конденсаторы для обеспечения более высокой емкости в меньшем пространстве, чем конденсаторы, использующие только воздух или вакуум между их пластинами, и термин диэлектрик относится к этому приложению, а также к изоляции, используемой в силовых и радиочастотных кабелях. .
.
Некоторые практичные диэлектрики
Диэлектрические материалы могут быть твердыми, жидкими или газообразными. Кроме того, высокий вакуум также может быть полезным диэлектриком без потерь, даже если его относительная диэлектрическая проницаемость равна всего единице.
Твердые диэлектрики, пожалуй, наиболее часто используемые диэлектрики в электротехнике, и многие твердые тела являются очень хорошими изоляторами. Некоторые примеры включают фарфор, стекло и большинство пластмасс. Воздух, азот и гексафторид серы являются тремя наиболее часто используемыми газообразными диэлектриками.
- Промышленные покрытия, такие как парилен, обеспечивают диэлектрический барьер между подложкой и окружающей средой.
- Минеральное масло широко используется внутри электрических трансформаторов в качестве жидкого диэлектрика и для охлаждения. Диэлектрические жидкости с более высокой диэлектрической проницаемостью, такие как касторовое масло электротехнического качества, часто используются в высоковольтных конденсаторах, чтобы помочь предотвратить коронный разряд и увеличить емкость.

- Поскольку диэлектрики сопротивляются потоку электричества, поверхность диэлектрика может удерживать многожильные избыточные электрические заряды.Это может произойти случайно при трении диэлектрика (трибоэлектрический эффект). Это может быть полезно, как в генераторе Ван де Граафа или электрофоре, или потенциально разрушительно, как в случае электростатического разряда.
- Специально обработанные диэлектрики, называемые электретами, могут сохранять избыточный внутренний заряд или «замороженную» поляризацию. Электреты имеют полупостоянное внешнее электрическое поле и являются электростатическим эквивалентом магнитов. Электреты имеют множество практических применений в быту и промышленности.
- Некоторые диэлектрики могут генерировать разность потенциалов при механическом воздействии или изменять физическую форму, если к материалу приложено внешнее напряжение. Это свойство называется пьезоэлектричеством. Пьезоэлектрические материалы представляют собой еще один класс очень полезных диэлектриков.

- Некоторые ионные кристаллы и полимерные диэлектрики обладают спонтанным дипольным моментом, который можно обратить вспять приложенным извне электрическим полем. Такое поведение называется сегнетоэлектрическим эффектом.Эти материалы аналогичны тому, как ферромагнитные материалы ведут себя во внешнем магнитном поле. Сегнетоэлектрические материалы часто имеют очень высокие диэлектрические проницаемости, что делает их весьма полезными для конденсаторов.
См. также
Ссылки
Ссылки ISBN поддерживают NWE за счет реферальных сборов
- Бетчер, Карл Йохан Фридрих. 1980. Теория электрической поляризации: диэлектрическая поляризация . Эльзевир Наука. ISBN 0444415793
- Рамбл, Джон (изд.). 2017. CRC Справочник по химии и физике , 98-е изд. Бока-Ратон: CRC Press. ISBN 978-1498784542
- Фон Хиппель, Артур Р. 1994. Диэлектрики и волны . Артек Печать по требованию. ISBN 978-08
038
Внешние ссылки
Все ссылки получены 8 мая 2018 г.
Кредиты
New World Encyclopedia авторов и редакторов переписали и дополнили статью в Википедии
в соответствии со стандартами New World Encyclopedia .Эта статья соответствует условиям лицензии Creative Commons CC-by-sa 3.0 (CC-by-sa), которая может использоваться и распространяться с надлежащим указанием авторства. Упоминание должно быть выполнено в соответствии с условиями этой лицензии, которая может ссылаться как на авторов New World Encyclopedia , так и на самоотверженных добровольных участников Фонда Викимедиа. Чтобы процитировать эту статью, щелкните здесь, чтобы просмотреть список допустимых форматов цитирования. История более ранних вкладов википедистов доступна исследователям здесь:
История этой статьи с момента ее импорта в New World Encyclopedia :
Примечание. На использование отдельных изображений, лицензированных отдельно, могут распространяться некоторые ограничения.
Использование перекиси водорода | приготовление и свойства перекиси водорода
Химические сомнения
О перекиси водорода
Перекись водорода была открыта французским химиком Тенаром.
Приготовление перекиси водорода
(i) Лабораторный метод: В лаборатории готовится по технологии Merck. Его готовят путем добавления рассчитанного количества пероксида натрия к охлажденному льдом разбавленному (20%) раствору .
(ii) Промышленный метод: В промышленных масштабах может быть получен электролизом 50% раствора. В ячейке на аноде образуется пероксидисерная кислота. Его отбирают из ячейки и гидролизуют водой с получением. Полученный раствор перегоняют при пониженном давлении, когда он перегоняется, а при высокой температуре кипения остается неперегнанным.
Физические свойства перекиси водорода
1. Безводный — бесцветная вязкая жидкость, растворимая в эфире, спирте и воде.Придает синеватый оттенок в толстых слоях
2. Вызывает волдыри на коже и горький вкус
3. Чистая вода имеет слабую кислотность и существует в виде ассоциированной жидкости из-за водородных связей
.
4. Его удельный вес составляет 1,45 г/мл при 0,C
.
5. По своей природе диамагнетик
6. Он кипит при 1520С и замерзает при . Он начинает разлагаться при b.pt. и таким образом перегоняется при пониженном давлении
7. В чистом виде его диэлектрическая проницаемость равна 93.7, которая увеличивается с разбавлением. Из-за высокой диэлектрической проницаемости и его водный раствор являются хорошими растворителями.
Химические свойства перекиси водорода
(i) Разложение: Чистый – нестабильная жидкость, разлагается на воду и либо при стоянии, либо при нагревании,
(ii) Окислительная природа: является сильным окислителем как в кислой, так и в щелочной среде
Ниже приведены некоторые важные примеры окислительного действия перекиси водорода
.
(a) окисляет черный сульфид свинца (PbS) до белого сульфата свинца (PbSO4)
(b) окисляет сульфиты в сульфаты
(c) окисляет нитриты до нитратов
(г). выделяет йод из йодида калия
выделяет йод из йодида калия
(е). окисляет арсенаты в арсенаты
(е). окисляет подкисленный сульфат железа до сульфата железа
(г). окисляется до серы
(час). окисляет подкисленный ферроцианид калия до феррицианида калия
(я). окисляет формальдегид до фориновой кислоты в присутствии пирогаллола и в щелочной среде
(к). растворяет осадок гидроксида хрома, присутствующий в растворе, образуя желтый раствор хромата натрия
(к).окисляет бензол в присутствии сульфата железа до фенола
(l). Раствор хромовой кислоты в серной кислоте или подкисленном дихромате калия окисляется до синего пероксида хрома, который нестабилен, однако растворяется в эфире с образованием окрашенного в синий цвет раствора
Пероксид хрома разлагается с образованием сульфата хрома и кислорода Пероксид хрома представлен как (m) окисляет ртуть до оксида ртути в кислом растворе
(iii) Отбеливающее действие: действует как отбеливающий агент благодаря выделению образующегося кислорода. Таким образом, отбеливающее действие связано с окислением. Он окисляет красящее вещество до бесцветного продукта, Красящее вещество +O Бесцветное вещество
Таким образом, отбеливающее действие связано с окислением. Он окисляет красящее вещество до бесцветного продукта, Красящее вещество +O Бесцветное вещество
используется для отбеливания деликатных материалов, таких как слоновая кость, шелк, шерсть, хлопок, волосы, кожа и т. д.
(iv) Реакции присоединения: показаны реакции присоединения по этиленовой связи
.
Структура перекиси водорода
имеет неплоскую структуру, в которой два атома водорода расположены в двух направлениях почти перпендикулярно друг другу и оси, соединяющей два атома кислорода.Связь О-О называется пероксидной связью.
Прочность перекиси водорода
Сила выражается в единицах веса или объема, 90 005
(i) Массовое процентное содержание: Массовое процентное содержание дает массу в 100 г раствора. Например, 40% раствор по массе. означает, что в 100 г раствора содержится 40 г.
(ii) Как объем: сила обычно выражается как объем. Это относится к объему кислорода, который даст раствор. Например, «объем 20» означает, что 1 литр этого раствора даст 20 литров кислорода при NTP.
Например, «объем 20» означает, что 1 литр этого раствора даст 20 литров кислорода при NTP.
Использование перекиси водорода
(i) В качестве гермицида и антисептика для ран, зубов и ушей
(ii) В качестве отбеливателя для дерева, волос и других мягких материалов
(iii) В качестве консерванта для молока и вина
(iv) В качестве топлива для ракет, подводных лодок и торпед
(v) При освежении старых картин маслом из-за образования черного превращает их в
(vi) При обнаружении ионов и ионов
(vii) В качестве антихлора для удаления следов хлора и гипохлорита
Тест перекиси водорода
(i) Подкисленный раствор соли титана при обработке , окрашивается в желтый или оранжевый цвет из-за образования пертитановой кислоты
(ii) Он высвобождает йод из раствора KI, который дает синюю окраску с раствором крахмала
(iii) обесцвечивает подкисленный раствор
(iv) при встряхивании с подкисленной небольшим количеством эфира появляется синее окрашивание (из-за образования пероксида хрома)
(v) Фильтровальная бумага с черным пятном PbS при контакте с раствором становится белой
Ниже приведены подробные сведения о реакциях перекиси водорода
.
‘;
}
иначе если (json.file_format==’индексировано’)
{
если (общая страница == 0)
{
displayHtml = displayHtml +’
Перекись водорода — Goor — — Major Reference Works
Статья содержит разделы под названиями:
1. | Введение и исторические аспекты |
2. | Физические свойства |
3. | Химические свойства |
4. | Производство |
4.1. | Антрахиноновый процесс (процесс АО) |
4. | Принципы |
4.1.2. | Описание процесса |
4.1.2.1. | Гидрирование |
4.1.2.2. | Окисление |
4.1.2.3. | Экстракция и сушка |
4.1.2.4. | Очистка и регенерация рабочего раствора |
4.1.2.5. | Очистка сырой перекиси водорода |
4. | Концентрация перекиси водорода |
4.2. | Процесс 2-пропанола (процесс Shell) |
4.3. | Электрохимические процессы |
4.3.1. | Процесс Дегусса — Вайсенштайн |
4.3.2. | Мюнхенский процесс |
4.4. | Прочие процессы |
4.4.1. | Продукция из пероксикомпаундов |
4. | Производство водорода и кислорода |
4.4.3. | Производство из окиси углерода, кислорода и воды |
4.4.4. | Производство автоокислением органических соединений |
4.4.5. | Производство катодным восстановлением кислорода |
5. | Хранение и транспортировка |
6. | Безопасность |
7. | Использование |
8. | Токсикология, гигиена труда и экотоксикология |
9. | Воздействие на окружающую среду |
9.1 | Атмосферная судьба |
9.2 | Водная судьба |
9,3 | Биодеградация |
9.4 | Выбросы в окружающую среду |
9,5 | Воздействие на окружающую среду |
В этом обзоре рассматриваются химические и физические свойства перекиси водорода и даются подробные описания различных производственных процессов. Сегодня почти вся перекись водорода производится с помощью процессов органического автоокисления, в первую очередь антрахинонового процесса. Другими аспектами в этом обзоре являются обращение, безопасность и использование перекиси водорода. Перекись водорода встречается в природе. Из-за своей химической активности перекись водорода также обладает токсическими свойствами. Образование и разложение атмосферной перекиси водорода происходит фотохимически. Разложение водной перекиси водорода катализируется биологическим материалом или переходными металлами.Данные о токсичности собираются для различных организмов.
Сегодня почти вся перекись водорода производится с помощью процессов органического автоокисления, в первую очередь антрахинонового процесса. Другими аспектами в этом обзоре являются обращение, безопасность и использование перекиси водорода. Перекись водорода встречается в природе. Из-за своей химической активности перекись водорода также обладает токсическими свойствами. Образование и разложение атмосферной перекиси водорода происходит фотохимически. Разложение водной перекиси водорода катализируется биологическим материалом или переходными металлами.Данные о токсичности собираются для различных организмов.
Перекись водорода | Encyclopedia.com
ОБЗОР
Перекись водорода (HY-druh-jin per-OK-side) представляет собой прозрачную, бесцветную, несколько нестабильную жидкость с горьким вкусом. В абсолютно чистом виде соединение достаточно стабильно. Однако даже небольшие количества примесей (таких как железо или медь) действуют как катализаторы, которые увеличивают его склонность к разложению, иногда бурному, на воду и образующийся кислород (O). Для предотвращения разложения в чистую перекись водорода и растворы перекиси водорода добавляют небольшие количества ингибиторов, таких как ацетанилид или станнат натрия.
Для предотвращения разложения в чистую перекись водорода и растворы перекиси водорода добавляют небольшие количества ингибиторов, таких как ацетанилид или станнат натрия.
ОСНОВНЫЕ ФАКТЫ
ДРУГИЕ НАЗВАНИЯ:
Двуокись водорода; гидропероксид; пероксид
ФОРМУЛА:
H 2 O 2
ЭЛЕМЕНТЫ:
Водород; Oxygen
Соединитель Тип:
Оксид (неорганический)
Состояние:
Жидкость
Молекулярная масса:
34,02 г / моль
Точка плавления:
-0,43 ° C (-31 ° F)
кипение ТОЧКА:
150,2°C (302,4°F)
РАСТВОРИМОСТЬ:
Хорошо растворим в воде; растворим в эфире
Перекись водорода была открыта в 1818 году французским химиком Луи Жаком Тенаром (1777–1857).Впервые он был использован в коммерческих целях в 1800-х годах, в основном для отбеливания шляп. Сегодня промышленные процессы производят около 500 миллионов килограммов (1 миллиард фунтов) перекиси водорода ежегодно для использования в самых разных областях, от отбеливания зубов до запуска ракет.
КАК ЭТО ПРОИЗВОДИТСЯ
Перекись водорода встречается в природе в очень малых количествах. Он образуется, когда кислород воздуха реагирует с водой с образованием H 2 O 2 . Перекись водорода также присутствует в растительных и животных клетках как побочный продукт метаболических реакций, происходящих в этих клетках.
Большие количества перекиси водорода, используемые в промышленности, получают в ходе сложной серии реакций, которые начинаются с любого соединения из семейства соединений, известных как алкилантрагидрохиноны, таких как этилантрагидрохинон. Антрагидрохиноны представляют собой соединения с тремя кольцами, которые могут превращаться между двумя или более подобными структурами. При переходе из одной структуры в другую в качестве побочного продукта образуется перекись водорода. Антрахинон непрерывно регенерируется во время производства перекиси водорода, что делает процесс очень эффективным.
Также доступны другие методы получения перекиси водорода. Например, электролиз серной кислоты приводит к образованию родственного соединения, пероксисерной кислоты (H 2 SO 5 ), которое затем реагирует с водой с образованием перекиси водорода. Третий метод приготовления включает нагревание изопропилового спирта [2-пропанол; (CH 3 ) 2 CHOH] при высокой температуре и давлении, что приводит к образованию перекиси водорода как одного из продуктов реакции.
Например, электролиз серной кислоты приводит к образованию родственного соединения, пероксисерной кислоты (H 2 SO 5 ), которое затем реагирует с водой с образованием перекиси водорода. Третий метод приготовления включает нагревание изопропилового спирта [2-пропанол; (CH 3 ) 2 CHOH] при высокой температуре и давлении, что приводит к образованию перекиси водорода как одного из продуктов реакции.
ОБЫЧНОЕ ПРИМЕНЕНИЕ И ПОТЕНЦИАЛЬНАЯ ОПАСНОСТЬ
Применение пероксида водорода в большинстве случаев зависит от того факта, что он склонен к распаду с выделением одного атома кислорода (O):
H 2 O 2 → H 2 O + (O)
Термин зарождающийся кислород относится к одному атому кислорода, структуре, которая химически очень активна. Возникающий кислород имеет тенденцию быть очень сильным окислителем. Например, перекись водорода, с которой, вероятно, знакомо большинство людей, используется в качестве антисептика, вещества, используемого для уничтожения микробов. Перекись водорода достигает такого результата, потому что выделяемый ею кислород уничтожает бактерии, грибки и другие микроорганизмы, вызывающие заболевания.
Перекись водорода достигает такого результата, потому что выделяемый ею кислород уничтожает бактерии, грибки и другие микроорганизмы, вызывающие заболевания.
Интересные факты
- Перекись водорода продается в концентрации от 3 процентов (для домашнего использования) до 90 процентов (для промышленного применения).
- Ученые обнаружили перекись водорода в атмосфере Марса.
Наиболее важное промышленное применение перекиси водорода — ее использование в целлюлозно-бумажной промышленности — также зависит от ее окислительных свойств.В этом случае он используется для отбеливания материалов, из которых изготовлена бумага, превращая окрашенные соединения в бесцветные соединения. Для этой цели используется около 55 процентов всей производимой в США перекиси водорода. Еще девять процентов используются при отбеливании других материалов, таких как ткани, меха, перья и волосы. Еще одним важным применением перекиси водорода являются очистные сооружения для воды и сточных вод, где ее антибактериальное действие уничтожает болезнетворные организмы в воде. Некоторые дополнительные области применения перекиси водорода включают:
Некоторые дополнительные области применения перекиси водорода включают:
- В пекарнях для кондиционирования теста и облегчения работы с ним;
- Для очистки металлов;
- В качестве ракетного топлива;
- При получении других органических и неорганических соединений;
- В качестве нейтрализующего агента при производстве вин; и
- В качестве дезинфицирующего средства при обработке семян для сельскохозяйственных целей.
Растворы перекиси водорода, с которыми люди вступают в контакт в домашних условиях, практически не представляют опасности для здоровья, поскольку концентрация соединения очень низкая, обычно около 3 процентов.Однако длительное использование перекиси водорода может вызвать ожоги кожи, а более концентрированные растворы, используемые в промышленности, представляют более серьезную опасность. Они могут быть токсичными при попадании внутрь и взрывоопасными при неправильном хранении.
Полезные слова
- КАТАЛИЗАТОР
- Материал, увеличивающий скорость химической реакции без каких-либо изменений в собственной химической структуре.

- ИНГИБИТОР
- Вещество, добавляемое к другому веществу для предотвращения или замедления нежелательной реакции.
- МЕТАБОЛИЗМ
- Процесс, включающий все химические реакции, происходящие в клетках, в ходе которых жиры, углеводы и другие соединения расщепляются для получения энергии и соединений, необходимых для построения новых клеток и тканей.
- ОКИСЛЕНИЕ
- Химическая реакция, при которой кислород взаимодействует с другим веществом или, альтернативно, при которой некоторые вещества отдают электроны другому веществу, окислителю.
ДЛЯ ДОПОЛНИТЕЛЬНОЙ ИНФОРМАЦИИ
«Перекись водорода (> 60% раствор в воде).Международная организация труда. http://www.ilo.org/public/english/protection/safework/cis/products/icsc/dtasht/_icsc01/icsc0164.htm (по состоянию на 12 октября 2005 г.). Перекись водорода». Перекись США. http://www.h302.com/intro/overview.html (по состоянию на 12 октября 2005 г.).
«Рецепт смерти?» CBSNews.

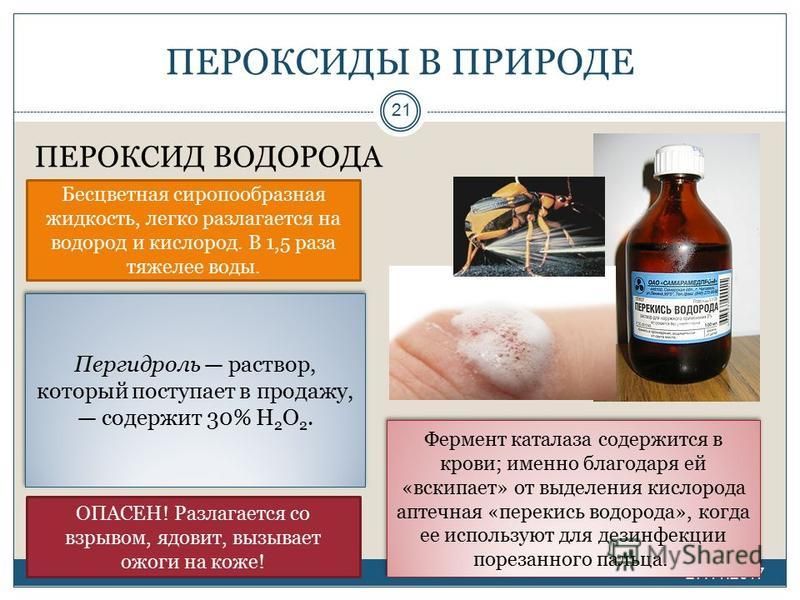
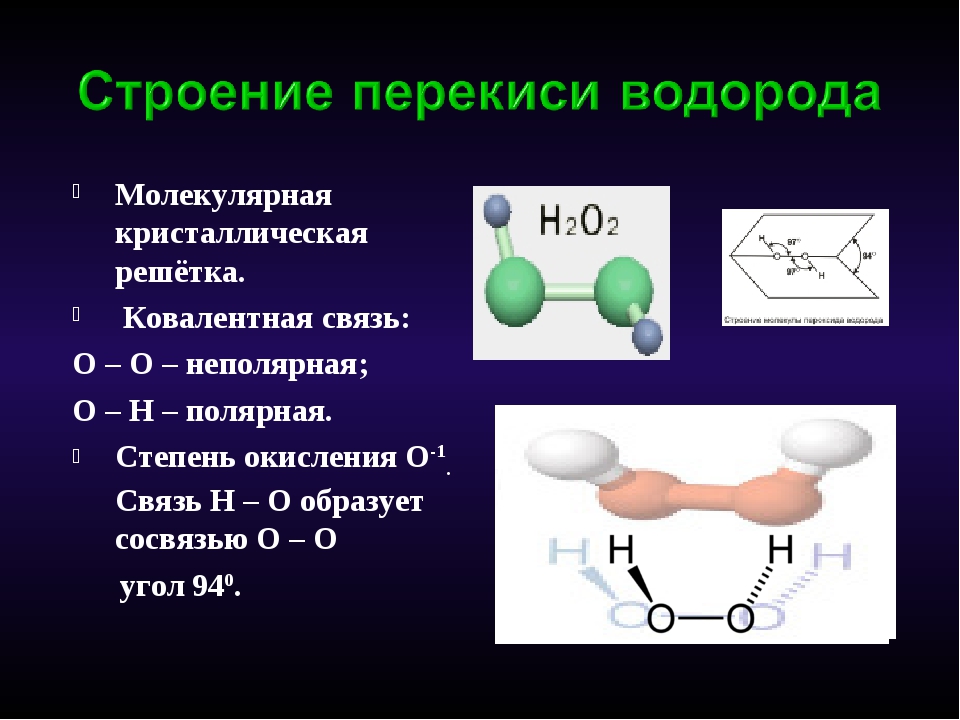 Не вызывать рвоту (=промывание желудка ТОЛЬКО врачом, с помощью зонда, и никаких привычных уже «два пальца в рот»). Не давать что либо через рот человеку без сознания.
Не вызывать рвоту (=промывание желудка ТОЛЬКО врачом, с помощью зонда, и никаких привычных уже «два пальца в рот»). Не давать что либо через рот человеку без сознания. мастер кард 5536 0800 1174 5555
мастер кард 5536 0800 1174 5555


 1.1.
1.1. 1.2.6.
1.2.6.
