Содержание
учёные обнаружили различие ряда белков ДНК человека и животных — РТ на русском
Транскрипционные факторы — белки, отвечающие за перенос генетической информации, — у человека и других представителей животного мира имеют значительные отличия. К такому выводу пришли канадские учёные. В ходе исследования они обнаружили уникальные гены, которые могут отвечать за особенности человеческой физиологии и анатомии, прежде всего иммунной системы и мозга. По их мнению, это открытие приблизит специалистов к разгадке тайны появления нашего вида.
Исследователи из Donnelly Centre Университета Торонто (Канада) утверждают, что гены людей и других живых существ имеют больше различий, чем считалось ранее. Десятки генов уникальны только для человека, и они могут помочь объяснить появление нашего вида. Об этом сообщается в статье, вышедшей в журнале Nature Genetics.
Ранее считалось, что белки — транскрипционные факторы, отвечающие за перенос генетической информации, — выглядят у различных организмов одинаково.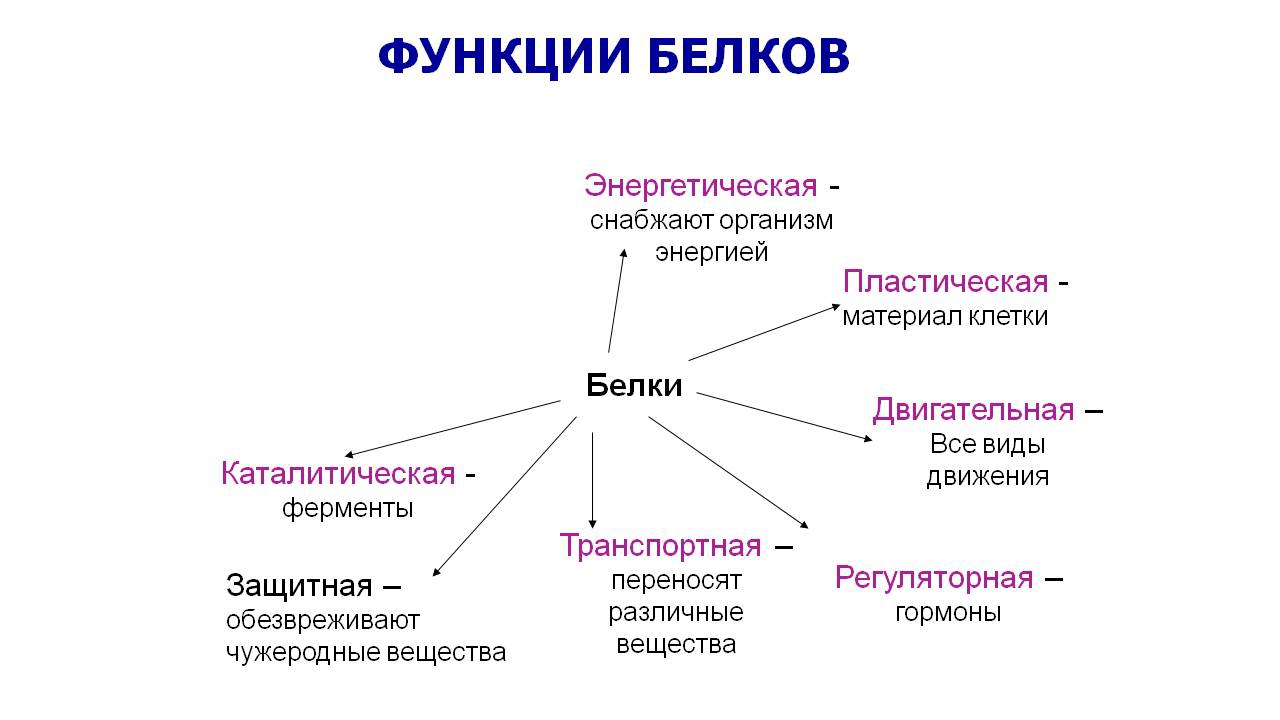 Однако исследование канадских учёных показало, что между ними могут быть различия в определённых последовательностях органических соединений — в специфических фрагментах кода ДНК, которые называются мотивами.
Однако исследование канадских учёных показало, что между ними могут быть различия в определённых последовательностях органических соединений — в специфических фрагментах кода ДНК, которые называются мотивами.
«Даже между близкородственными видами имеется значительная часть транскрипционных факторов, которые могут привести к образованию новых последовательностей. Это означает, что они, регулируя различные гены, могут выполнять новые, ещё не изученные функции, что может иметь большое значение с точки зрения межвидовых различий», — говорит один из авторов работы Сэм Ламберт.
По его мнению, даже у людей и шимпанзе, чьи геномы идентичны на 99%, есть десятки белков, которые распознают различные для каждого вида фрагменты кода ДНК. Всё это влияет на процесс передачи наследственной информации для сотен разных генов.
«Мы полагаем, что данными различиями, наблюдаемыми на молекулярном уровне, могут быть обусловлены некоторые различия между шимпанзе и людьми», — поясняет Ламберт.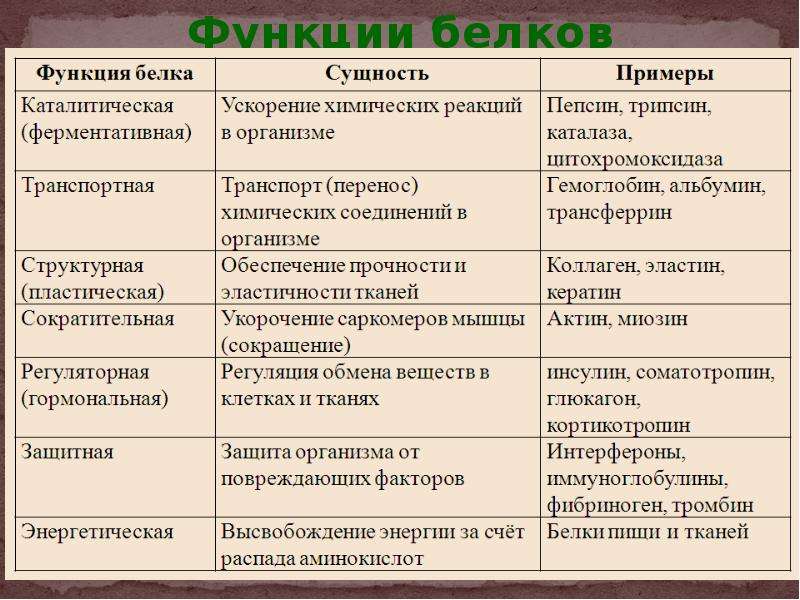
- Gettyimages.ru
- © RollingEarth
Напомним, что кодом ДНК, или генетическим кодом, называют совокупность правил, согласно которым в живых клетках последовательность нуклеотидов (ген и мРНК) переводится в последовательность аминокислот (белок). Генетический код всех живых организмов Земли един (имеются лишь незначительные вариации).
Открытый вопрос
Учёные разработали компьютерную программу, способную сравнивать транскрипционные факторы у различных видов по составу аминокислот и таким образом различать похожие белки.
Полученные результаты противоречат данным более ранних работ, в которых утверждалось, что почти все транскрипционные факторы человека и, например, мух из рода дрозофил связывают одни и те же фрагменты кода ДНК.
Также по теме
Дальний родственник из миоцена: учёные обнаружили ранее неизвестный вид древних обезьян
Американские учёные выявили новый вид обезьян, обитавший на Земле 22 млн лет назад.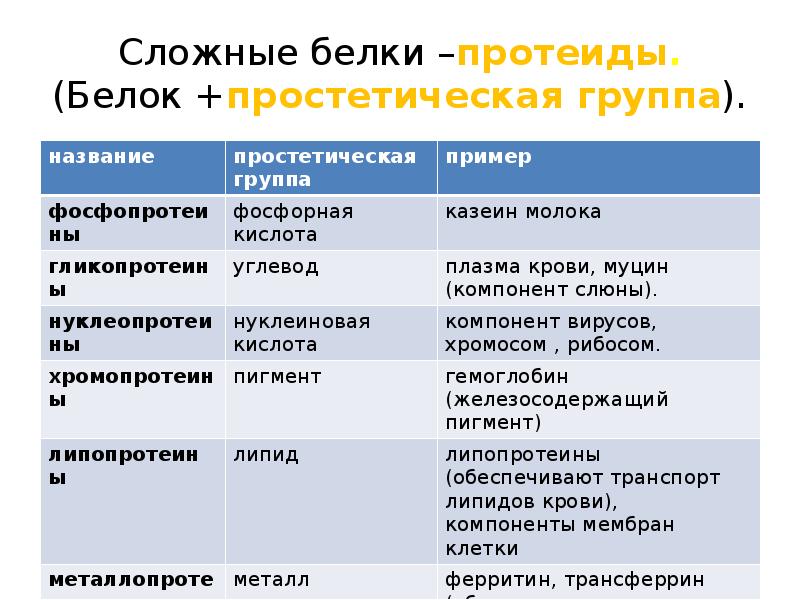 Открытие было сделано благодаря обнаруженным в…
Открытие было сделано благодаря обнаруженным в…
«До сих пор сохранилось представление о том, что транскрипционные факторы людей и плодовых мух связывают почти идентичные структурные элементы (мотивы). И хотя известно множество примеров, где эти белки обладают функциональной консервативностью, данная гипотеза ещё далека от признания», — говорит руководитель лаборатории, в которой было проведено исследование, профессор кафедры молекулярной генетики Университета Торонто Тимоти Хьюз.
Для канадских учёных остаётся открытым вопрос, за какие функции отвечают уникальные для человека гены. В изучаемых ими белках могут быть сокрыты особенности физиологии и анатомии человека — нашей иммунной системы и мозга, которые являются наиболее сложными среди животных. Также исследователи не исключают, что эти гены могут отвечать за анатомические различия между полами.
«В области генетики человека молекулярная основа полового диморфизма почти никем не исследуется. Но ведь речь идёт о различиях, которые видны людям друг в друге и привлекают их внимание.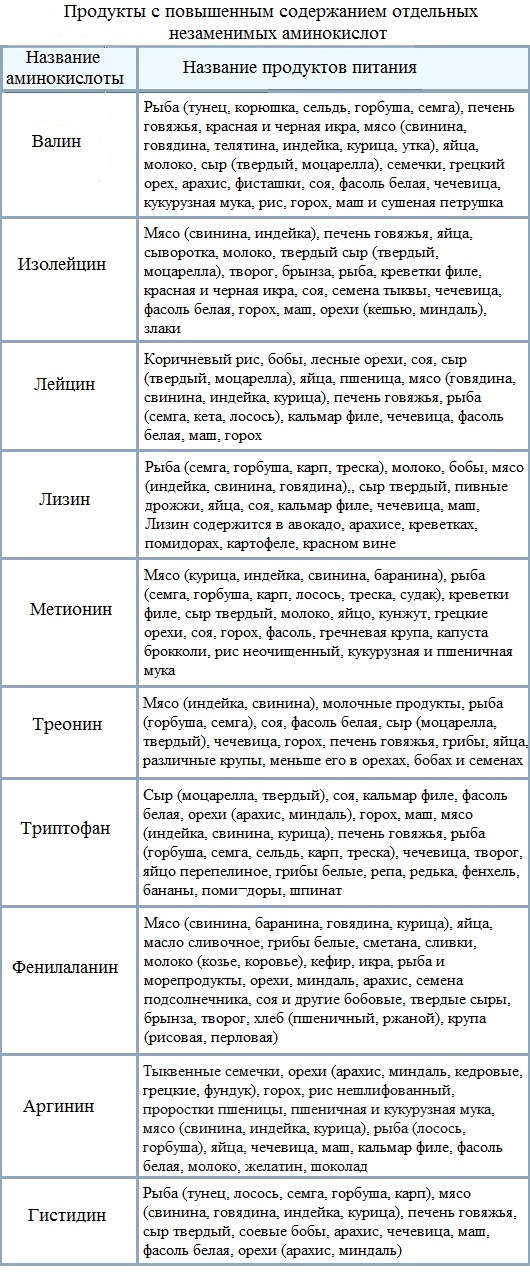 У меня есть соблазн посвятить работе над данной темой оставшуюся половину своей карьеры, если только я смогу разобраться, как мне этого добиться», — говорит профессор Хьюз.
У меня есть соблазн посвятить работе над данной темой оставшуюся половину своей карьеры, если только я смогу разобраться, как мне этого добиться», — говорит профессор Хьюз.
«Кирпичик в здании науки»
Однако российские коллеги канадских учёных не столь оптимистичны в оценках проведенного исследования.
«Работа канадцев важна для понимания определённых регуляционных процессов, для более глубокого понимания живых систем и их эволюции. Но говорить о том, что они приблизились к пониманию природы человека, пока рано. Это лишь кирпичик в здании науки», — сообщил в беседе с RT академик РАН ректор РНИМУ им. Н.И. Пирогова Сергей Лукьянов.
Ясно, что в ходе эволюции некоторые гены претерпели изменения и не могут оставаться идентичными тем, которые были сотни миллионов лет назад, утверждает академик.
«Очевидно, что кошка с собакой разные. Но, например, иммунная система людей практически ничем не отличается от той, что есть у других животных. А вот мозг — совсем другое дело, большие полушария у нас более развиты. В результате эволюции у всех видов появились какие-то особенности. Но, с точки зрения генетики, человек — абсолютно обычный организм», — заключил Лукьянов.
А вот мозг — совсем другое дело, большие полушария у нас более развиты. В результате эволюции у всех видов появились какие-то особенности. Но, с точки зрения генетики, человек — абсолютно обычный организм», — заключил Лукьянов.
Новости фитнес-клуба POWERHOUSE GYM РЕУТОВ
30.11.2017
Производители протеиновых коктейлей предлагают современному человеку большой выбор высокобелковых смесей. Каждый человек должен подобрать продукт, который подходит ему оптимальным образом.
Протеин подбирают по нескольким параметрам. Откидываем все добавки, и остается выявить процентное соотношение углеводов и жиров в продукте.
Следующим шагом остается определиться, с какой целью вы собираетесь употреблять высокобелковые смеси. Современный протеиновый коктейль имеет несколько разновидностей.
Сывороточный протеин.
· Имеет максимальную скорость усвоения, по сравнению с остальными продуктами. Кроме того, он на четверть состоит из аминокислот ВСАА. Это позволяет использовать данный вид протеина после тренировок, когда мышцам необходим строительный материал для восстановления. Чем чище сыворотка, тем выше ее стоимость.
Кроме того, он на четверть состоит из аминокислот ВСАА. Это позволяет использовать данный вид протеина после тренировок, когда мышцам необходим строительный материал для восстановления. Чем чище сыворотка, тем выше ее стоимость.
Изолят сывороточного протеина.
· Считается самой чистой протеиновой сывороткой. В нем практически не содержится жира и углеводов, но и обходится дороже. Если вы стараетесь избегать лишних углеводов или находитесь на стадии сушки, то данный продукт незаменим.
Гидролизат протеина.
· Включает большее количество белковых фракций, которые разбиты на более мелкие компоненты. Это обеспечивает более быстрое усвоение продукта и поступление белков в мышцы. Гидролизный протеин принимают после тренировок, но это не дешевое удовольствие.
Комплексный протеин.
· Выгодно отличается от всех протеинов, так как является универсальным протеином из за содержания разных типов белка. Как правило, эти белки с разной скоростью усваивания — низкий, средний и высокий. Поэтому такие протеины имеют пролонгированное действие. Прием таких протеинов даст вашему организм непрерывный поток незаменимых аминокислот для восстановления и набора мышечной массы.
Как правило, эти белки с разной скоростью усваивания — низкий, средний и высокий. Поэтому такие протеины имеют пролонгированное действие. Прием таких протеинов даст вашему организм непрерывный поток незаменимых аминокислот для восстановления и набора мышечной массы.
Казеиновый протеин.
· Усваивается организмом постепенно. На усвоение смеси уходит примерно 6 часов. Следовательно, на протяжении этого времени организм получает белок, который ему необходим. Если организм не получает протеина, то он начинает брать его из мышц, заменяя жиром. Когда необходимо увеличить содержание белка в рационе питания, казеиновый протеин становится оптимальным решением.
Яичный протеин.
· Изготавливается из яичного белка. Обычно он входит в состав продуктов, а как самостоятельный компонент встречается редко.
Соевый протеин.
· Ряд исследований указывает на то, что изолят соевого протеина влияет на выработку тиреоидных гормонов у человека. Идеально подходит для рациона вегетарианцев.
Идеально подходит для рациона вегетарианцев.
Растительный протеин.
· Очень популярен у вегетарианцев. В нем содержатся аминокислоты в достаточных количествах, чтобы поддержать развитие организма в целом.
Готовый к употреблению протеин.
· Для людей у которых нет времени на приготовления протеиновых коктейлей. Но онинуждаются в дополнительном источнике белка. Выпускается в разных видах и фасовках : тетра пак, бутылки, также бывает пудинг и в виде геля.
Таблица времени усваивания белков.
· 2-3 часа: яичный белок, ультра фильтрованный концентрат сывороточного белка, микрофильтрованный изолят сывороточного протеина.
· 4-6 часа: концентрат молочного белка.
· 6-8 часов: казеинат кальция, мицеллярный альфа-и бета-казеин и казеинаты.
10 класс Функции белков
КОНСПЕКТ УРОКА НА ТЕМУ
«ФУНКЦИИ БЕЛКОВ. СВОЙСТВА ФЕРМЕНТОВ».
СВОЙСТВА ФЕРМЕНТОВ».
Лабораторная работа «Изучение свойств ферментов»
ЦЕЛЬ: дать представление об основных функциях белков – ферментативной;
рассказать о ферментах, их основных свойствах (денатурация, ренатурация, деструкция) и принципе действия ферментов.
ТЕРМИНЫ: каталаза, уреаза, кофермент (активный центр), фермент – субстратный комплекс.
ОБОРУДОВАНИЕ: таблицы, схемы, рисунки, перекись водорода, пробирки, штативы, термо-метр, часы, стеклянная палочка, варенное мясо картофель, сырое мясо и картофель, горсть проросшего гороха, теплая вода (t 40 ) на бане.
КОНЦЕПЦИЯ УРОКА: Изучение свойств белков и функций ферментов, опираясь на знания о третичной структуре белков, показать принцип действия ферментов; наличие у них активного центра, способности образовывать фермент – субстратный комплекс и снижать энергию начала реакции,.
Исходя из этого, вывести другие свойства ферментов. Подвести итог, что ферменты – биологические катализаторы, ускоряющие реакции в десятки раз. На лабораторной работе показать учащимся свойства ферментов.
Подвести итог, что ферменты – биологические катализаторы, ускоряющие реакции в десятки раз. На лабораторной работе показать учащимся свойства ферментов.
СТРУКТУРА УРОКА.
1. Организационный момент …………………………………………… 2 мин.
2. Актуализация опорных знаний………………………………………. 7 мин
3. Изучение нового материала………………………………………….. 15 мин
4. Выполнение лабораторной работы …………………………………. 10мин
5. Закрепление…………………………………………………………… 7 мин
6.Домашнее задание …………………………………………………….. 2мин
7.Итог урока Формулировка выводов …………………………. 2мин
СОДЕРЖАНИЕ И ХОД УРОКА.
Актуализация опорных знаний.
Устно.
Дайте определение белкам как непериодическим полимерам. Белки – важнейшая часть ЖО.
У доски.
Записать строение структурной единицы белков – аминокислоты, отношение их к воде, доказать их амфотерные свойства.

Записать пептидную связь, объяснить механизм ее образования.
Записать классификацию радикалов аминокислот белков.
Работа с тетрадью.
Тестирование по теме «Белки». Обменятся тетрадями, проставить оценки. Вводное
Обменятся тетрадями и подвести итог тестированию: 14 – 12; 13 – 11; 12 -10; 10, 11 -9; 9,8 -8, 7-7. 6-6 и т.д. Выставить оценки в журнал по домашнему заданию.(на перерыве)
Ответы:В1:1б; 2г; 3б;4б,в; 5б,в,г; 6а,б,в,г; 7а; 8б; 9в; 10г,з,и,к,л,м,о,с;
Ответы.В2;1в; 2б; 3а; 4б,в; 5б,в,г; 6б; 7б; 8б; 9в; 10г,з,и,к,л,м,о,с;
ТЕСТ 1. Тема: «БЕЛКИ». В I
Белки полимеры: а) периодичные; б) не периодичные.
Молекула белков образует структур: а) 1; б) 2; в) 3; г) 4; д) 5; е) 6; ж) 7; з) 8.
Первичная структура белка образована типами химических связей: а) ионными;
б) ковалентными; в) водородными; г) гидрофобными.
Вторичная структура белка образована типами химических связей: а) ионными;
б) ковалентными; в) водородными; г) гидрофобными.
Третичная структура белка образована типами химических связей: а) ионными;
б) ковалентными; в) водородными; г) гидрофобными.
Четвертичная структура белка образована типами химических связей: а) ионными;
б) ковалентными; в) водородными; г) гидрофобными.
7. Первичная структура белка имеет вид: а) нити; б) спирали; в) глобулы.
8. Вторичная структура белка имеет вид: а) нити; б) спирали; в) глобулы.
9. Третичная структура белка имеет вид: а) нити; б) спирали; в) глобулы.
10. К незаменимым аминокислотам относятся: а) лизин; б) аланин; в) тирозин; г) триптофан; д) фенилаланин; е) серин; ж) пролин; з) лейцин; и) изолейцин; к) валин; л) метионин; м) треонин; н) гистидин; о) глицин; п) цистеин; р) аргинин.
ТЕСТ 1.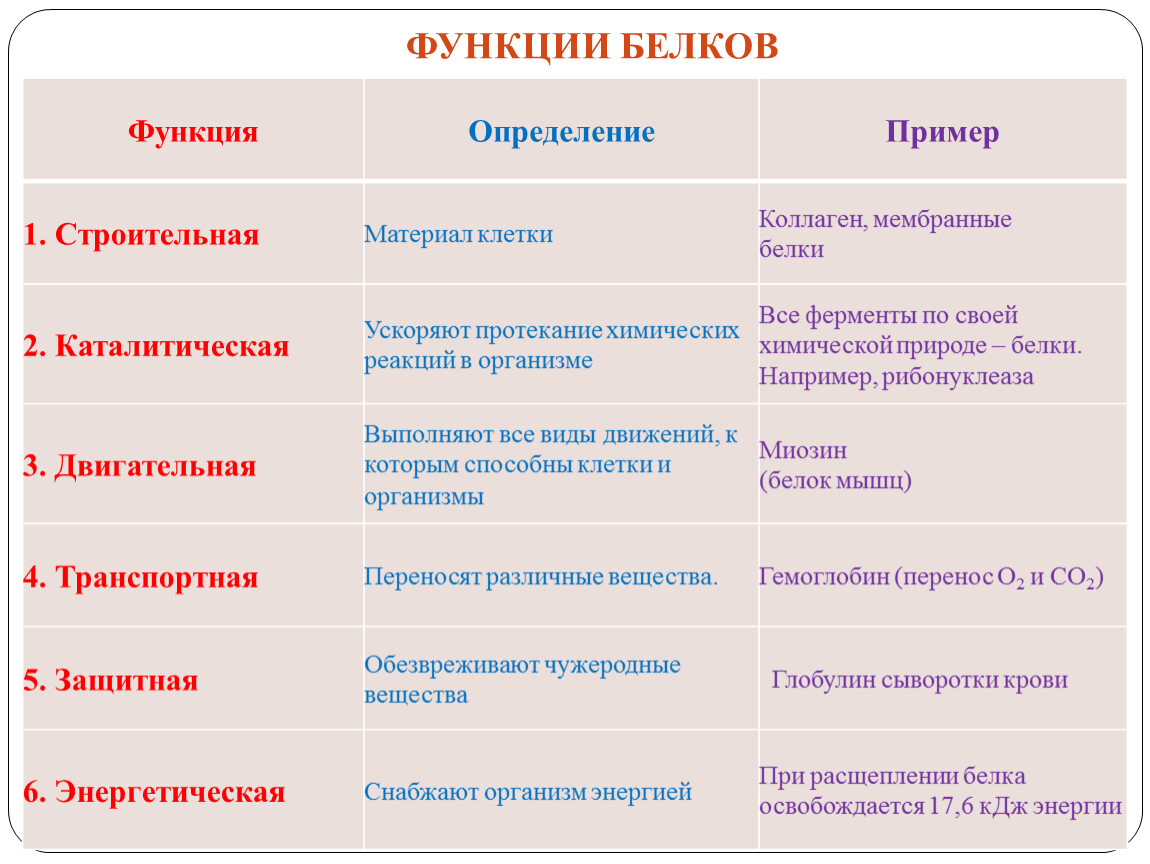 Тема: «БЕЛКИ». В II
Тема: «БЕЛКИ». В II
Белки состоят из мономеров: а) глюкозы; б) нуклеотидов; в) аминокислот.
Сколько аминокислот участвуют в синтезе белка: а) 23; б)20; в) 100?
Какая частью аминокислоты отличается друг от друга: а) радикалом; б) аминогруппой;
в) карбоксильной группой.
Вторичная структура белка образована типами химических связей: а) ионными;
б) ковалентными; в) водородными; г) гидрофобными.
Третичная структура белка образована типами химических связей: а) ионными;
б) ковалентными; в) водородными; г) гидрофобными.
Первичная структура белка образована типами химических связей: а) ионными;
б) пептидными; в) водородными; г) гидрофобными; д) ковалентными полярными.
7. Посредством какой химической связи соединены между собой аминокислоты первичной структуры: а) дисульфидной; б)пептидныой; в) водородной.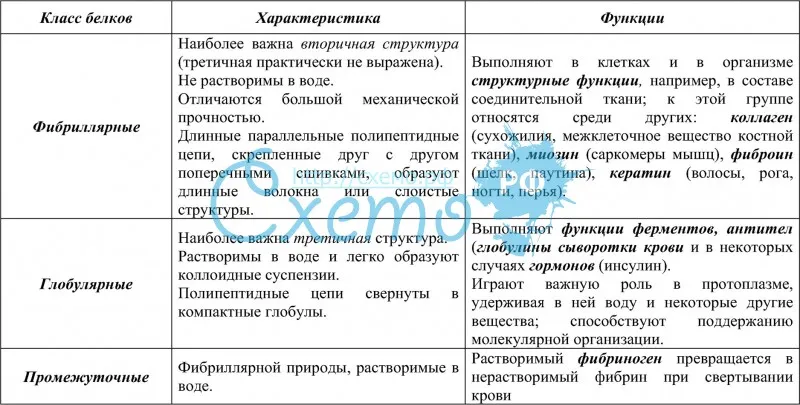
8. Вторичная структура белка имеет вид: а) нити; б) спирали; в) глобулы.
9. Третичная структура белка имеет вид: а) нити; б) спирали; в) глобулы.
10. К незаменимым аминокислотам относятся: а) лизин; б) аланин; в) тирозин; г) триптофан; д) фенилаланин; е) серин; ж) пролин; з) лейцин; и) изолейцин; к) валин; л) метионин; м) треонин; н) гистидин; о) глицин; п) цистеин; р) аргинин; с) лизин.
.
Актуализация опорных знаний и мотивация учебной деятельности
Что вы знаете о химических реакциях, которые протекают в живых организмах? Чем они отличаются от реакций, протекающих в неживой природе?
Что вы знаете о катализаторах, каковы их свойства? Какие условия необходимы для действия тех или иных катализаторов?
Известно, что молекула перекиси водорода расщепляется под действием каталазы на воду и молекулярный кислород. Как вы думаете, сколько молекул перекиси водорода может расщепить одна молекула каталазы за одну секунду?
Ответ 1: Реакции в живых организмах протекают быстрее в 1000 –чи раз.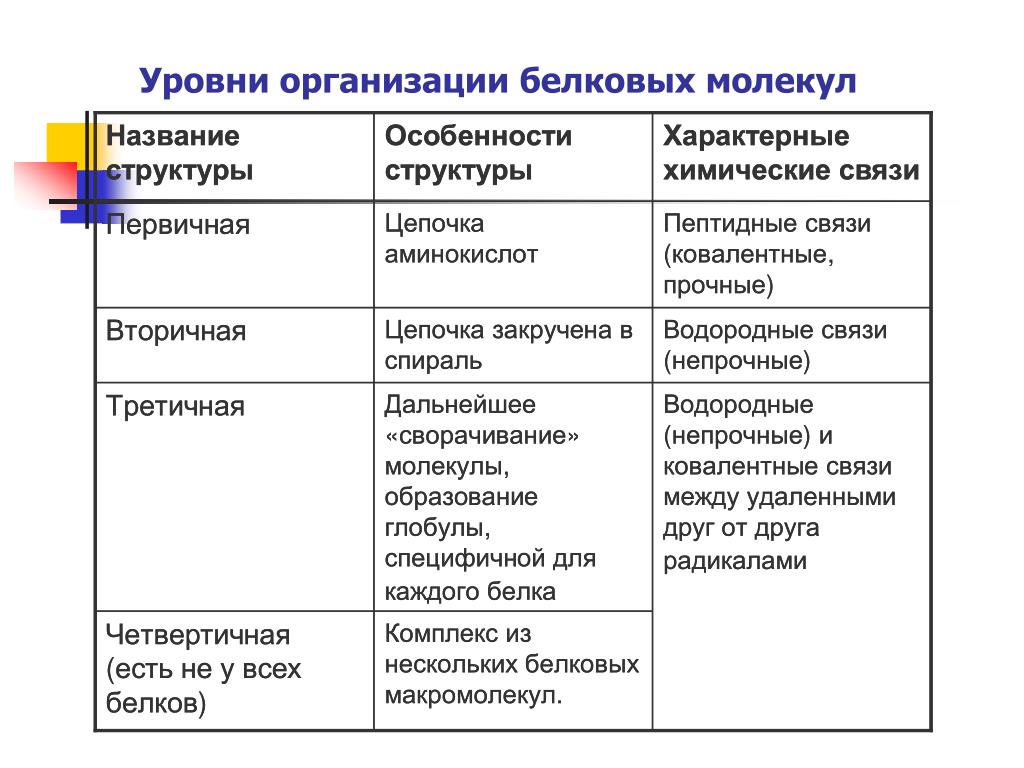
Они отличаются не только скоростью, но и условиями их протекания, т.к. протекают при низких температурах, как в кислой так и в щелочной среде и др.
Ответ 2: Катализаторы – это вещества, определяющие скорость химических реакций. В разных условиях они ускоряют или замедляют скорость химических реакций.
Ответ 3: Каталаза – один из наиболее быстро работающих ферментов: при 0 градусов по Цельсию одна молекула каталазы разлагает за 1 сек до 40 000 молекул перекиси водорода!
Что вы знаете о ферментах (биологических катализаторах)? Как бы без них протекали реакции и к чему бы это привело?
НОВЫЙ МАТЕРИАЛ.
ФЕРМЕНТЫ – это биологические катализаторы, способные ускорять химические реакции
в клетке в десятки тысяч раз. Изучает ферменты наука энзимология.
ОСНОВНЫЕ СВОЙСТВА ФЕРМЕНТОВ,
ВСЕ ФЕРМЕНТЫ – глобулярные белки.
ФЕРМЕНТЫ увеличивают скорость реакций, но сами в этой реакции не расходуются.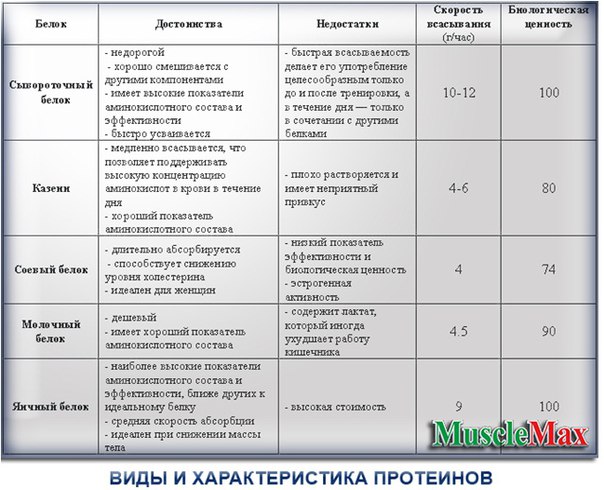
ФЕРМЕНТЫ высоко специфичны: один фермент может катализировать только одну реакцию.
ФЕРМЕНТ всегда больше субстрата, с которыми он взаимодействует.
ФЕРМЕНТ в малом количестве вызывает превращения большого количества субстрата.
ФЕРМЕНТ своим присутствием не влияет ни на свойства, ни на природу конечного продукта.
ФЕРМЕНТ взаимодействует из субстратом с помощью АЦ (К — 10 — 20 аминокислот) специфического участка, который по форме соответствует субстрату.
Катализируемая им реакция обратима.
Активность ферментов зависит от t, рН среды, температуры, давления и от концентрации как субстрата так и самого фермента.
Фермент – субстратный комплекс способен снижать энергию начала реакции, это и позволяет ферменту ускорить протекание реакции.
СТРОЕННИЕ ФЕРМЕНТА.
АПОФЕМЕНТ – БЕКОВАЯ ЧАСТЬ ФЕРМЕНТА;
Орг — е в — ва: белки или близкие к витаминам в – ва (гормоны)
КОФЕРМЕНТ — небелковая часть фермента,
Активная часть фермента.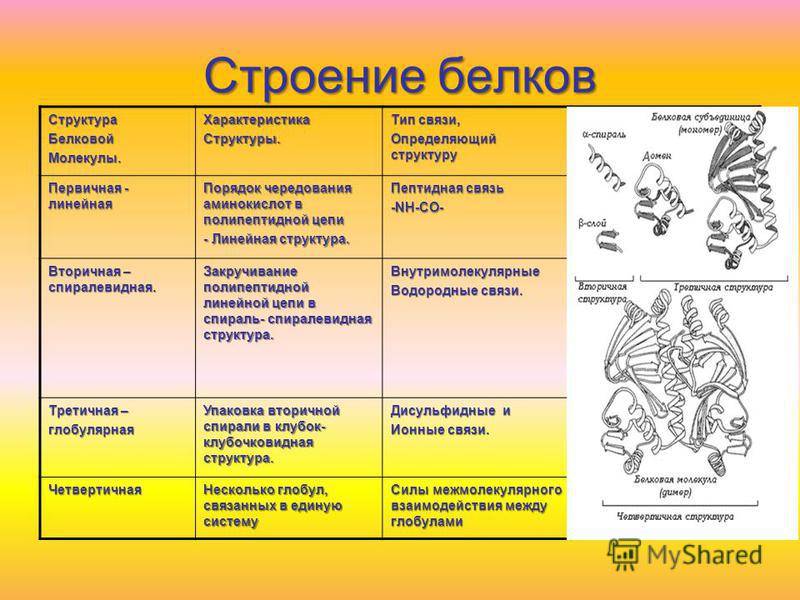
МЕХАНИЗМ ДЕЙСТВИЯ ФЕРМЕНТА.
«КЛЮЧА И ЗАМКА» «РУКИ И ПЕРЧАТКИ»
1890 г. Фишер
СУБСТРАТ ФЕРМЕНТ СУБСТРАТ ФЕРМЕНТ
Главная часть замка – активный центр. Форма субстрата соответствует активному центру.
Фермент – субстратный комплекс существует короткое время. Образовавшиеся продукты реакции поступают в окружающую среду. Комплекс распался и готов принимать новый субстрат. Активный центр не жестко подходит к субстрату как «рука в перчатку».
Каталаза — м = 250 000; Перекись водорода – м = 34.
ЭТАПЫ ДЕЙСТВИЯ ФЕРМЕНТА.
Приближение субстрата к активному центру;
Вхождение С (субстрата) в активный центр;
Перестройка субстрата в продукт реакции;
Выход продукта реакции из активного центра.
СВОЙСТВА БЕЛКОВ.
ДЕНАТУРАЦИЯ РЕНАТУРАЦИЯ ДЕСТРУКЦИЯ
Нарушение высших уровней организации белковой молекулы (вторичной, третичной, четвертичной структур белка из сохранением первичной структуры).
ПРИЧИНЫ.
1)температура; 2) давление; 3) рН среды – кислая или щелочная; 4) ультразвук; 5) вещества.
ЖИВОЙ __________________ РАЗВЕРНУТЫЙ ________________ РЕНАТУРАЦИЯ
БЕЛОК денатурация (t, р, рН) БЕЛОК если не нарушена I стр – ра белка
КАТАЛАЗА УТРАТИЛА СВОЙСТВА ВОССТАНОВИЛА СВОЙСВА
Лабораторная работа
ТЕМА. Свойства белков. Определение свойств ферментов.
ЦЕЛЬ: выявить каталитическую активность ферментов в живых тканях.
Оборудование: перекись водорода, сырой и вареный картофель, сырое и вареное мясо, про бирки, штативы, стеклянные палочки, проросшие семена гороха, термометр.
ХОД РАБОТЫ.
В приготовленные пробирки добавьте несколько капель перекиси водорода. Наблюдаемое запишите в таблицу:
Исследуемый
объект
Действие перекиси водорода
Наблюдения
1.
Сырой
картофель
Каталаза + перекись водорода
Вскипание в пробирке;Ф ката-лаза расщепляет яд до про-стых в-в: воды и кислорода
2.
Вареный
картофель
Деструкция Ф каталазы + перек. водород
Кипячение
Реакции не протекают, т.к. нарушена нативная структура белка – фермента при кипячен.
3.
Сырое
Мясо
Каталаза + перекись водорода
Вскипание в пробирке;Ф ката-лаза расщепляет яд до про-стых в-в: воды и кислорода
4.
Вареное
мясо
Деструкция Ф каталазы + перек. водород
Кипячение
Реакции не протекают, т.к. нарушена нативная структура белка – фермента при кипячен.
5.
Сырое семя
гороха
Каталаза + перекись водорода
Вскипание в пробирке;Ф ката-лаза расщепляет яд до про-стых в-в: воды и кислорода
6.
Вареное семя
гороха
Деструкция Ф каталазы + перек. водород
водород
кипячение
Реакции не протекают, т.к. нарушена нативная структура белка – фермента при кипячен.
ВЫВОД. Денатурированный белок не взаимодействуют с перекисью водорода с выделением конечных продуктов воды и кислорода, а белок – фермент каталаза в живых клетках за доли секунды разрушает яд, перекись водорода, до простых веществ.
II часть. НОВЫЙ МАТЕРИАЛ.
БИОЛОГИЧЕСКАЯ РОЛЬ БЕЛКОВ. ФУНКЦИИ ФЕРМЕНТОВ.
№
П/п
Группы
белков
ВИДЫ
ФУНКЦИИ
ПРИМЕРЫ
1.
Структурные
кератин
коллаген
строительная
опорная
Входит в состав волос, ногтей, копыт, рогов
Компонент сухожилий, связок, и хрящей
2.
Гормоны
инсулин
вазопрессин
регуляторная
——— « ———
Регулируют обмен веществ
3.
Сократительные
актин
миозин
двигательная
——— « ——-
Осуществляют мышечные сокращения
4.
Запасные
козеин
ферритин
запасающая
——- « ——-
Белок в молоке
железо в селезенке
5.
Транспортные
Гемоглобин
альбумин
перенос веществ
—— «———
Перенос О и СО
Перенос жирных кислот
6.
Защитные
антитела
иммунная
Защищают организм от бактерий, вирусов, антигенов, чужеродных белков
7.
Сигнальная
рецепторы
иодопсин
родопсин
Рефлекторная, передает сигналы из внешней среды
Осуществляет взаимосвязь организма и окружающей среды
8.
токсины
нейротоксин
блокирующее
Блокирует передачу нервного импульса
9.
Энергетическая
все
все
При расщеплении 1г-7,8 кДж
10.
Ферментативная
каталаза
амилаза
инсулин
глюкогон
ДНКполимераза
уреаза
каталитическая
Расщепляет Н О
Расщепляет крахмал
превращ-т крахмал в глюкозу
превращ-т глюкозу в крахмал
осущ-т репарацию мол-л ДНК
разложение мочевины
Свойства белков обусловлены аминокислотным составом белков.
Протамины – содержащиеся в икре рыб, где их до 30 % аминокислот с двумя аминогруппами, что обуславливает щелочные свойства этих белков.
Химическая активность веществ в живой клетке невелика.
Концентрация их в клетке ничтожно мала.

В клетке низкая t.
Реакции идут очень быстро и качественно потому, что химические реакции регулируются белками – катализаторами.
Для каждого фермента существует определенное значение реакции среды, при котором он проявляет наивысшую активность
Изменение рН вызывает снижение или полное торможение деятельности фермента.
Изменение t вызывает изменение скорости и ход ферментативной реакции.
Пример: разложение мочевины (кошачьей мочи) уреазой (выработанной бактериями)
при комнатной t (1 мол уреазы за 1 сек расщепляет 30 000 мол мочевины) –
Н N- СО- NН + Н О ———- СО + 2 NН (запах аммиака).
III. ЗАКРЕПЛЕНИЕ.
Почему все ферменты глобулярные белки?.Чем ферменты отличаются от катализаторов в неживой природе?
Почему активность ферментов зависит от t среды?
Одни ферменты активны в кислой среде, а другие — в щелочной.
 Как вы это можете объяснить?
Как вы это можете объяснить?Известно, что один фермент катализирует только одну реакцию. Объясните, почему невозможно с помощью этого же фермента ускорить любую реакцию?
ТЕСТ 2. Тема. «Свойства и функции белков. Выходное.
1.Процесс восстановления структуры белка после ее нарушения называется: а) деструкция; б) денатурация; в) ренатурация; г) биосинтезом.
2. К растворимым в воде органическим веществам относятся: а) липиды; б) моносахариды; в) полисахариды; г) некоторые белки.
3При расщеплении 1 г белка выделяется энергия: а) 17,8 кДж; б) 39,8 кДж; в) 178 кДж.
4Ускорение биохимических реакций обеспечивают: а) алкалоиды; б) гормоны; в) белки (ферменты)
5Антитела имеют природу: а) белковую; б) углеводную; в) липидную.
6В полипептидную цепь аминокислоты соединяются благодаря: а) водородным связям; б) ковалентным связям; в) гидрофобным; г) ионным.
7Вторичная структура белка имеет вид: а) глобулы; б) спирали; в) цепи аминокислотных остатков.
8Процесс разрушения первичных пептидных связей называют: а) денатурация; б) деструкция; в) ренатурация.
l l вариант.
В состав молекулы белков входят химические элементы: а) С; б) К; в) Н ; г) О ; д) Са; е) N ; ж) S; з) Fe.
Активная часть белка – фермента, обеспечивающая каталитические свойства:
а) апофермент; б) кофермент.
Сократительную функцию выполняют белки: а) протеины; б) миозин; в) кератин;
в) актин.
Каталитическую функцию выполняют белки: а) каталаза; б) миозин; в) кератин;
в) уреаза;
Транспортную функцию выполняют белки: а) гемоглобин; б) миозин; в) кератин;
в) актин.
Защитную функцию выполняют белки: а) коллаген; б) иммуноглобулины; в) тромбо-пластин; г) тромбин; д) фибриноген.
Строительную (структурную) функцию выполняют белки: а) коллаген; б) кератин;
в) инсулин.
8. Какие структуры молекул белка способны разрушаться при денатурации, а затем, вновь восстанавливаться: а) первичная; б) вторичная; в) третичная; г) четвертичная?
IV. ДОМАШНЕЕ ЗАДАНИЕ: учить &5 и конспект урока, подготовить
нформацию о роли белков в организме,повторить биологические термины.
V. ИТОГ УРОКА.
Подвести обучающихся к следующим выводам:
Свойства белков обусловлены аминокислотным составом белков.
Без участия ферментов протекание большинства биохимических процессов в клетке было бы невозможным.
В результате ферментативных реакций не образуются побочные продукты, то есть наблюдается почти 100% выход конечного продукта.
Для нормального функционирования организма это имеет большое значение, т.к. все вещества, распавшиеся до конечных продуктов – воды и углекислого газа, выводятся полностью наружу из организмов, при этом не накапливаются ненужные вещества в ЖО.
.
Шкала оценки тяжести состояния для пациентов с COVID-19
Как рассчитать уровень тяжести состояния: каждый из 9 показателей (см. таблицу) нужно
сравнить с порогом. Показатели делятся на 2 категории: для которых балл начисляется за
превышение порога (АЧТВ, СРБ, Д-димер, глюкоза, мочевина и общие лейкоциты) и те, у
которых балл начисляется за уменьшение ниже порога (гемоглобин, лимфоциты, общий белок).
Далее начисленные баллы суммируются.
| Показатель | Порог | Балл |
| APTT (АЧТВ) | > 42 sec | 4 |
| CRP (С-реактивный белок) | > 146 mg/L | 3 |
| D-dimer (Д-димер) | > 2149 mg/L | 4 |
| Glucose (Глюкоза) | > 9 mmol/L | 4 |
| Hemoglobin (Гемоглобин) | 3 | |
| Lymphocytes (Лимфоциты) | 3 | |
| Total protein (Общий белок) | 6 | |
| Urea (Мочевина) | > 11 mmol/L | 5 |
| WBC (Общие лейкоциты) | > 13,5*10^9/L | 4 |
Итого: максимум 36 баллов
Например, у пациента АЧТВ 45 сек, СРБ 180, Д-димер: 1000, глюкоза: 8, гемоглобин 110,
лимфоциты: 0. 8, общий белок: 60, мочевина 10, общие лейкоциты: 15.
8, общий белок: 60, мочевина 10, общие лейкоциты: 15.
Как видно, критическое значение наблюдается у: АЧТВ (4 балла), СРБ (3 балла), гемоглобин (3
балла), общий белок (6 баллов), общие лейкоциты (4 балла). Таким образом суммарный балл
составляет 4+3+3+6+4 = 20 баллов.
Далее суммарный балл можно сопоставить с рассчитанными диапазонами и вынести вердикт о градации риска.
Подробнее о методике расчета: https://www.medrxiv.org/content/10.1101/2021.02.09.21249859v3
Для удобства оценки предлагаем автоматический калькулятор.
Для корректного расчета необходимо заполнить все поля. Десятичные дроби необходимо вводить с точкой в качестве разделителя целой и дробной частей.
Важно!
В шкале не учитывается информация о сатурации кислородом! Даже низкий балл при дыхательной недостаточности (SpO2
Результаты шкалы не предназначены для самостоятельного применения пациентом и должны оцениваться ТОЛЬКО врачом-специалистом с учетом результатов комплексного клинико-лабораторного обследования.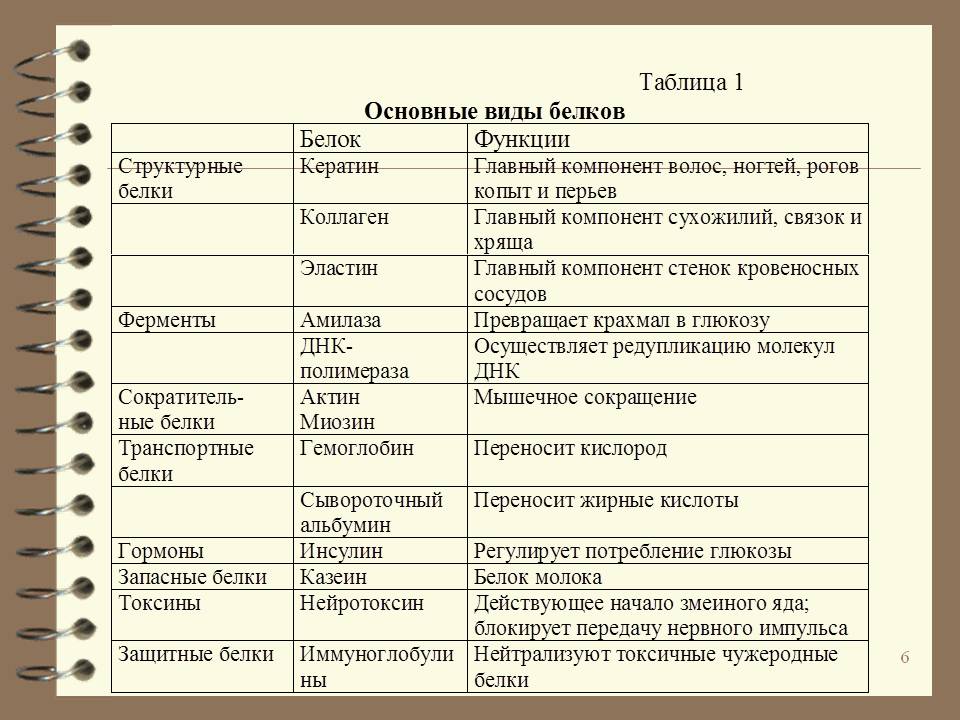
§ 10. Классификация белков
§ 10. КЛАССИФИКАЦИЯ БЕЛКОВ
Существуют несколько подходов к классификации белков: по форме белковой молекулы, по составу белка, по функциям. Рассмотрим их.
Классификация по форме белковых молекул
По форме белковых молекул различают фибриллярные белки и глобулярные белки.
Фибриллярные белки представляют собой длинные нитевидные молекулы, полипептидные цепи которых вытянуты вдоль одной оси и скреплены друг с другом поперечными сшивками (рис. 18,б). Эти белки отличаются высокой механической прочностью, нерастворимы в воде. Они выполняют главным образом структурные функции: входят в состав сухожилий и связок (коллаген, эластин), образуют волокна шелка и паутины (фиброин), волосы, ногти, перья (кератин).
В глобулярных белках одна или несколько полипептидных цепей свернуты в плотную компактную структуру – клубок (рис. 18,а). Эти белки, как правило, хорошо растворимы в воде. Их функции многообразны. Благодаря им осуществляются многие биологические процессы, о чем подробнее будет изложено ниже.
18,а). Эти белки, как правило, хорошо растворимы в воде. Их функции многообразны. Благодаря им осуществляются многие биологические процессы, о чем подробнее будет изложено ниже.
Рис. 18. Форма белковых молекул:
а – глобулярный белок, б – фибриллярный белок
Классификация по составу белковой молекулы
Белки по составу можно разделить на две группы: простые и сложные белки. Простые белки состоят только из аминокислотных остатков и не содержат других химических составляющих. Сложные белки, помимо полипептидных цепей, содержат другие химические компоненты.
К простым белкам относятся РНКаза и многие другие ферменты. Фибриллярные белки коллаген, кератин, эластин по своему составу являются простыми. Запасные белки растений, содержащиеся в семенах злаков, – глютелины, и гистоны – белки, формирующие структуру хроматина, принадлежат также к простым белкам.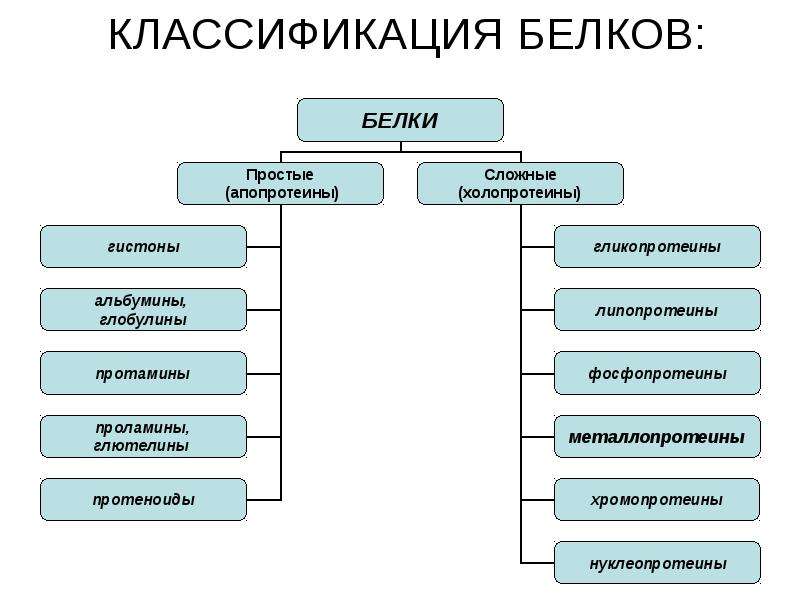
Среди сложных белков различают металлопротеины, хромопротеины, фосфопротеины, гликопротеины, липопротеины и др. Рассмотрим эти группы белков подробнее.
Металлопротеины
К металлопротеинам относят белки, в составе которых имеются ионы металлов. В их молекулах встречаются такие металлы, как медь, железо, цинк, молибден, марганец и др. Некоторые ферменты по своей природе являются металлопротеинами.
Хромопротеины
В составе хромопротеинов в качестве простетической группы присутствуют окрашенные соединения. Типичными хромопротеинами являются зрительный белок родопсин, принимающий участие в процессе восприятие света, и белок крови гемоглобин (Hb), четвертичная структура которого рассмотрена в предыдущем параграфе. В состав гемоглобина входит гем, представляющий собой плоскую молекулу, в центре которой расположен ион Fe2+ (рис. 19). При взаимодействии гемоглобина с кислородом образуется оксигемоглобин. В альвеолах легких гемоглобин насыщается кислородом. В тканях, где содержание кислорода незначительно, оксигемоглобин распадается с выделением кислорода, который используется клетками:
В альвеолах легких гемоглобин насыщается кислородом. В тканях, где содержание кислорода незначительно, оксигемоглобин распадается с выделением кислорода, который используется клетками:
.
Гемоглобин может образовывать соединение с оксидом углерода (II), которое называется карбоксигемоглобином:
.
Карбоксигемоглобин не способен присоединять кислород. Вот почему происходит отравление угарным газом.
Гемоглобин и другие гем-содержащие белки (миоглобин, цитохромы) называют еще гемопротеинами из-за наличия в их составе гема (рис. 19).
Рис. 19. Гем
Фосфопротеины
Фосфопротеины в своем составе содержат остатки фосфорной кислоты, связанные с гидроксильной группой аминокислотных остатков сложноэфирной связью (рис. 20).
Рис. 20. Фосфопротеин
К фосфопротеинам относится белок молока казеин. В его состав входят не только остатки фосфорной кислоты, но и ионы кальция. Фосфор и кальций необходимы растущему организму в больших количествах, в частности, для формирования скелета. Кроме казеина, в клетках много и других фосфопротеинов. Фосфопротеины могут подвергаться дефосфорилированию, т.е. терять фосфатную группу:
В его состав входят не только остатки фосфорной кислоты, но и ионы кальция. Фосфор и кальций необходимы растущему организму в больших количествах, в частности, для формирования скелета. Кроме казеина, в клетках много и других фосфопротеинов. Фосфопротеины могут подвергаться дефосфорилированию, т.е. терять фосфатную группу:
фосфопротеин + Н2 протеин + Н3РО4
Дефосфорилированные белки могут при определенных условиях быть снова фосфорилированы. От наличия фосфатной группы в их молекуле зависит их биологическая активность. Одни белки проявляют свою биологическую функцию в фосфорилированном виде, другие – в дефосфорилированном. Посредством фосфорилирования – дефосфорилирования регулируются многие биологические процессы.
Липопротеины
К липопротеинам относятся белки, содержащие ковалентно связанные липиды. Эти белки встречаются в составе клеточных мембран. Липидный (гидрофобный) компонент удерживает белок в мембране (рис.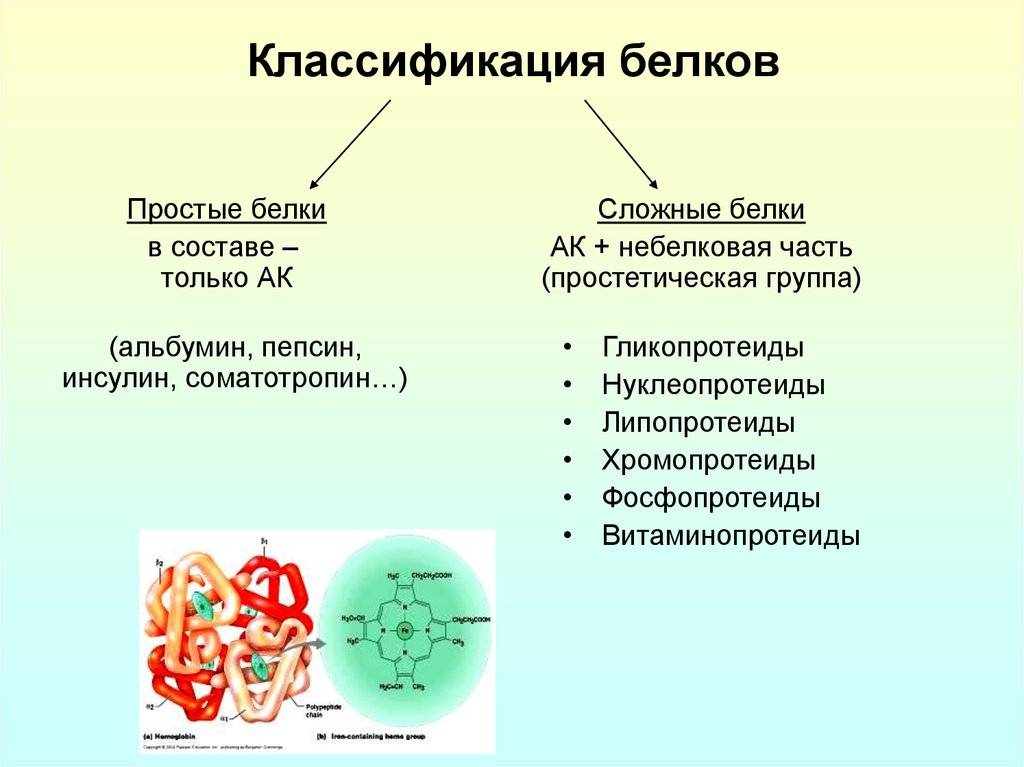 21).
21).
Рис. 21. Липопротеины в клеточной мембране
К липопротеинам относят также белки крови, участвующие в транспорте липидов и не образующие с ними ковалентную связь.
Гликопротеины
Гликопротеины содержат в качестве простетической группы ковалентно связанный углеводный компонент. Гликопротеины разделяют на истинные гликопротеины и протеогликаны. Углеводные группировки истинных гликопротеинов содержат обычно до 15 – 20 моносахаридных компонентов, у протеогликанов они построены из очень большого числа моносахаридных остатков (рис. 22).
Рис. 22. Гликопротеины
Гликопротеины широко распространены в природе. Они встречаются в секретах (слюне и т.д.), в составе клеточных мембран, клеточных стенок, межклеточного вещества, соединительной ткани и т.д. Многие ферменты и транспортные белки являются гликопротеинами.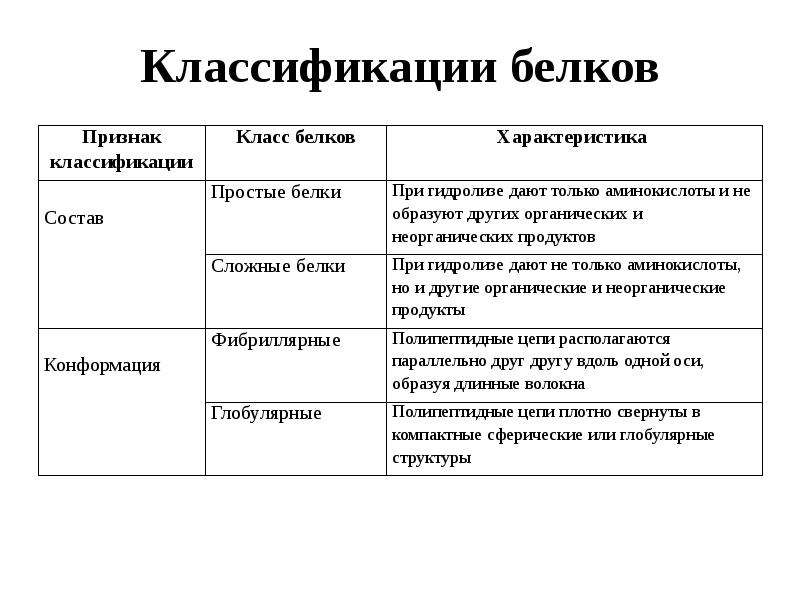
Классификация по функциям
По выполняемым функциям белки можно разделить на структурные, питательные и запасные белки, сократительные, транспортные, каталитические, защитные, рецепторные, регуляторные и др.
Структурные белки
К структурным белкам относятся коллаген, эластин, кератин, фиброин. Белки принимают участие в формировании клеточных мембран, в частности, могут образовывать в них каналы или выполнять другие функции ( рис. 23).
Рис. 23. Клеточная мембрана.
Питательные и запасные белки
Питательным белком является казеин, основная функция которого заключается в обеспечении растущего организма аминокислотами, фосфором и кальцием. К запасным белкам относятся яичный белок, белки семян растений. Эти белки потребляются во время развития зародышей. В организме человека и животных белки в запас не откладываются, они должны систематически поступать с пищей, в противном случае может развиться дистрофия.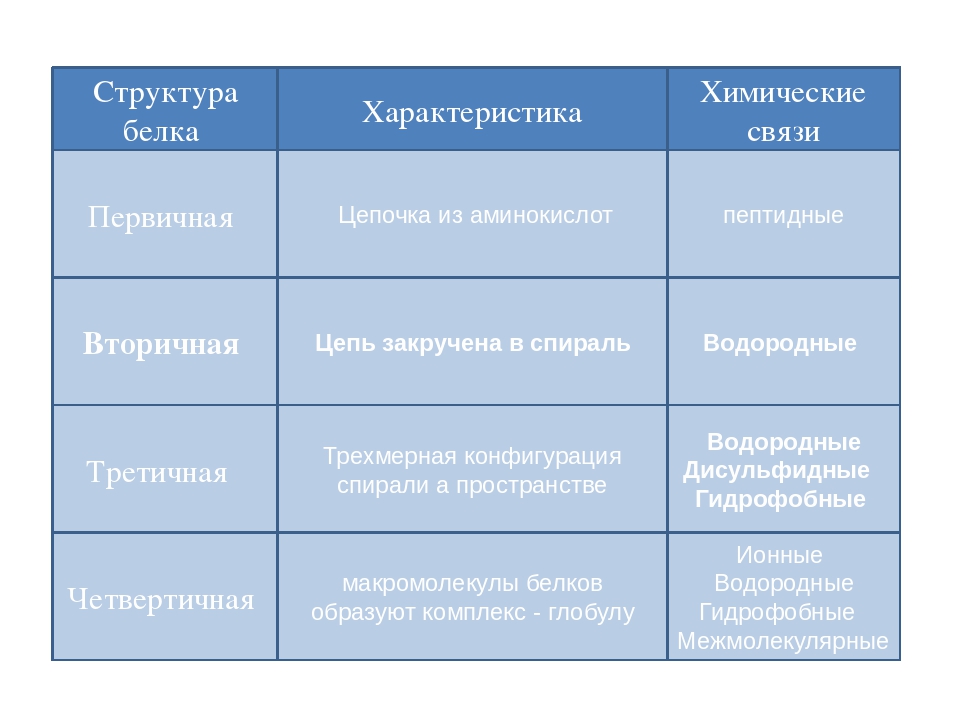
Сократительные белки
Сократительные белки обеспечивают работу мышц, движение жгутиков и ресничек у простейших, изменение формы клеток, перемещение органелл внутри клетки. Такими белками являются миозин и актин. Эти белки присутствуют не только в мышечных клетках, их можно обнаружить в клетках практически любой ткани животных.
Транспортные белки
Гемоглобин, рассмотренный в начале параграфа, является классическим примером транспортного белка. В крови присутствуют и другие белки, обеспечивающие транспорт липидов, гормонов и иных веществ. В клеточных мембранах находятся белки, способные переносить через мембрану глюкозу, аминокислоты, ионы и некоторые другие вещества. На рис. 24 схематически показана работа переносчика глюкозы.
Рис. 24. Транспорт глюкозы через клеточную мембрану
Белки-ферменты
Каталитические белки, или ферменты, представляют собой самую многообразную группу белков. Почти все химические реакции, протекающие в организме, протекают при участии ферментов. К настоящему времени открыто несколько тысяч ферментов. Более подробно они будут рассмотрены в следующих параграфах.
Почти все химические реакции, протекающие в организме, протекают при участии ферментов. К настоящему времени открыто несколько тысяч ферментов. Более подробно они будут рассмотрены в следующих параграфах.
Защитные белки
К этой группе относятся белки, защищающие организм от вторжения других организмов или предохраняющие его от повреждений. Иммуноглобулины, или антитела, способны распознавать проникшие в организм бактерии, вирусы или чужеродные белки, связываться с ними и способствовать их обезвреживанию.
Другие компоненты крови, тромбин и фибриноген, играют важную роль в процессе свертывания крови. Они предохраняют организм от потери крови при повреждении сосудов. Под действием тромбина от молекул фибриногена отщепляются фрагменты полипептидной цепи, в результате этого образуется фибрин:
фибриноген фибрин.
Образовавшиеся молекулы фибрина агрегируют, формируя длинные нерастворимые цепи. Сгусток крови вначале является рыхлым, затем он стабилизируется за счет межцепочечных сшивок. Всего в процессе свертывания крови участвует около 20 белков. Нарушения в структуре их генов является причиной такого заболевания, как гемофилия – сниженная свертываемость крови.
Сгусток крови вначале является рыхлым, затем он стабилизируется за счет межцепочечных сшивок. Всего в процессе свертывания крови участвует около 20 белков. Нарушения в структуре их генов является причиной такого заболевания, как гемофилия – сниженная свертываемость крови.
Рецепторные белки
Клеточная мембрана является препятствием для многих молекул, в том числе и для молекул, предназначенных для передачи сигнала внутрь клеток. Тем не менее клетка способна получать сигналы извне благодаря наличию на ее поверхности специальных рецепторов, многие из которых являются белками. Сигнальная молекула, например, гормон, взаимодействуя с рецептором, образует гормон-рецепторный комплекс, сигнал от которого передается далее, как правило, на белковый посредник. Последний запускает серию химических реакций, результатом которых является биологический ответ клетки на воздействие внешнего сигнала (рис. 25).
Рис.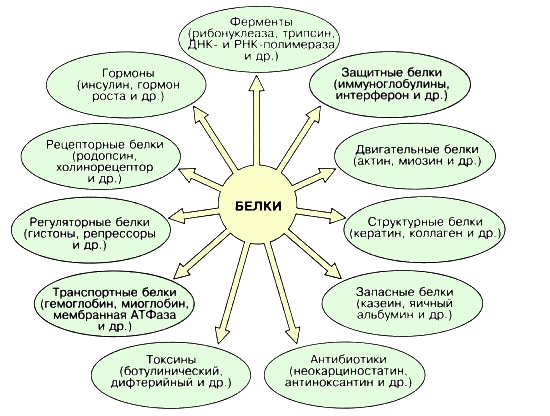 25. Передача внешних сигналов в клетку
25. Передача внешних сигналов в клетку
Регуляторные белки
Белки, участвующие в управлении биологическими процессами, относят к регуляторным белкам. К ним принадлежат некоторые гормоны. Инсулин и глюкагон регулируют уровень глюкозы в крови. Гормон роста, определяющий размеры тела, и паратиреоидный гормон, регулирующий обмен фосфатов и ионов кальция, являются регуляторными белками. К этому классу белков принадлежат и другие протеины, участвующие в регуляции обмена веществ.
Интересно знать! В плазме некоторых антарктических рыб содержатся белки со свойствами антифриза, предохраняющие рыб от замерзания, а у ряда насекомых в местах прикрепления крыльев находится белок резилин, обладающий почти идеальной эластичностью. В одном из африканских растений синтезируется белок монеллин с очень сладким вкусом.
что это такое, какие болезни вызывают
Инфекционные болезни могут развиваться не только из-за бактерий, вирусов и других хорошо известных врачам микроорганизмов - это ошеломляющее заявление в медицинской среде было сделано после того, как в 1982 году профессор неврологии и биохимии Стэнли Прузинер (США) обнаружил белковые соединения, способные вызывать заболевания. Открытие белков-прионов было настоящим прорывом в медицине, доказательством чему стало получение учёным Нобелевской премии в 1997 году.
Открытие белков-прионов было настоящим прорывом в медицине, доказательством чему стало получение учёным Нобелевской премии в 1997 году.
Прионы: биологическая сущность, свойства, среда обитания таинственных молекул
До недавнего времени исследователи считали, что в составе любой «живой» субстанции должны быть молекулы ДНК или РНК — нуклеиновых кислот, обусловливающих способность вирусов, бактерий, грибов и прочих организмов размножаться. Однако открытие прионов полностью трансформировало это представление. Устойчивость к высоким температурам, к различным видам излучений, действию нуклеаз (ферментов, способных расщеплять нуклеиновые кислоты), отсутствие роста на питательных средах – такими необычными свойствами обладал ранее не известный возбудитель.
Белковые соединения с определённой конфигурацией, способные трансформироваться в патогенные и вызывать нейродегенеративные процессы в организме, были названы прионами. Термин «прион» (prion) предложил Стэнли Прузинер.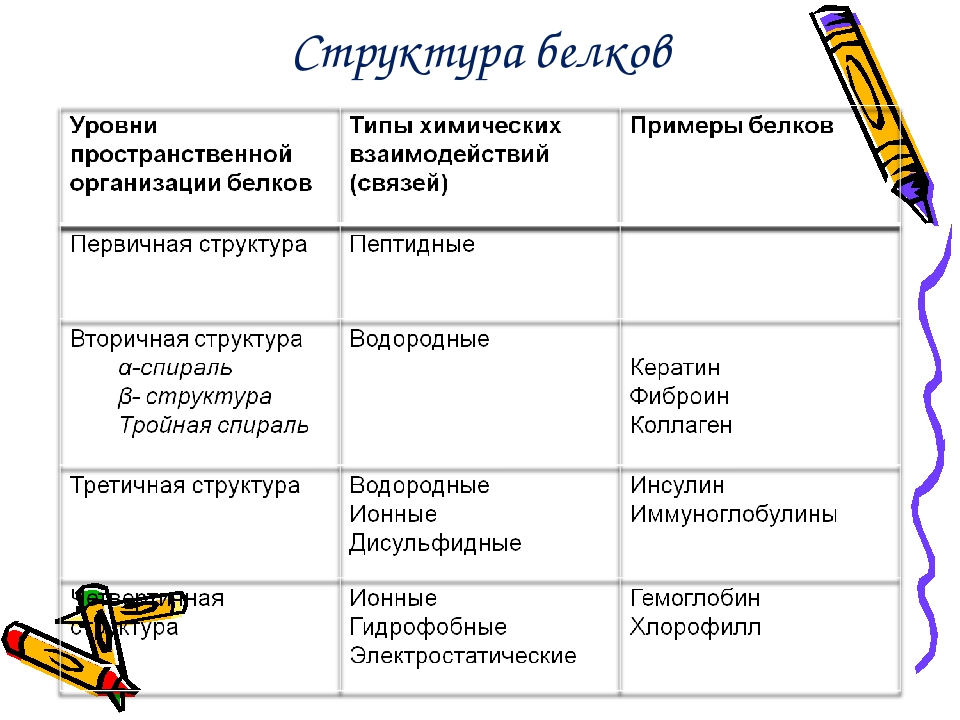 Термин происходит от фрагментов английских слов protein (белок) и infection (инфекция). Прионы способны размножаться. Этот процесс более продолжителен по времени, чем размножение патогенных микроорганизмов, поэтому от момента попадания прионов в организм до клинических проявлений болезни может пройти несколько месяцев или лет.
Термин происходит от фрагментов английских слов protein (белок) и infection (инфекция). Прионы способны размножаться. Этот процесс более продолжителен по времени, чем размножение патогенных микроорганизмов, поэтому от момента попадания прионов в организм до клинических проявлений болезни может пройти несколько месяцев или лет.
Молекула приона в «нормальной» форме имеется на поверхности нервных клеток у каждого человека. Обычные молекулы белка, вступая в контакт с патологическими, сами превращаются в них, изменяя при этом собственную пространственную структуру. Что является пусковым механизмом подобной трансформации, до конца не известно. Из этого следует, что прион, выступая в роли инфекционного агента, заражает нормальные молекулы, вызывая «молекулярную эпидемию».
Токсичные белковые бляшки на клетке приводят к её гибели, а на месте погибшей клетки образуется пустота, которая заполняется жидкостью. Количество пустот в головном мозге с течением времени будет увеличиваться, пока он не превратится в «губку».
Как можно заразиться прионами?
На сегодняшний день выделяют следующие основные пути заражения инфекционным белком-прионом:
1. Трансмиссивный. В этом случае молекулы белка передаются от одного вида млекопитающего к другому — например, от инфицированной коровы или овцы человеку. Заражение происходит при употреблении в пищу мяса или молока заражённого животного, либо использовании его тканей (роговицы, препаратов крови и т.п.), применении во время оперативных вмешательств биологического шовного материала.
2. Наследственный. Заболевание развивается на фоне генетической мутации, затрагивающей область 20-й хромосомы. Несмотря на слабую изученность функционирования этого участка генома, достоверно известно его участие в синтезе нормального прионного белка. В случае генных мутаций вместо здорового приона образуется патологический, а это приводит к развитию болезней.
3. Спорадический. При этом аномальный белок появляется в организме спонтанно, без видимых причин.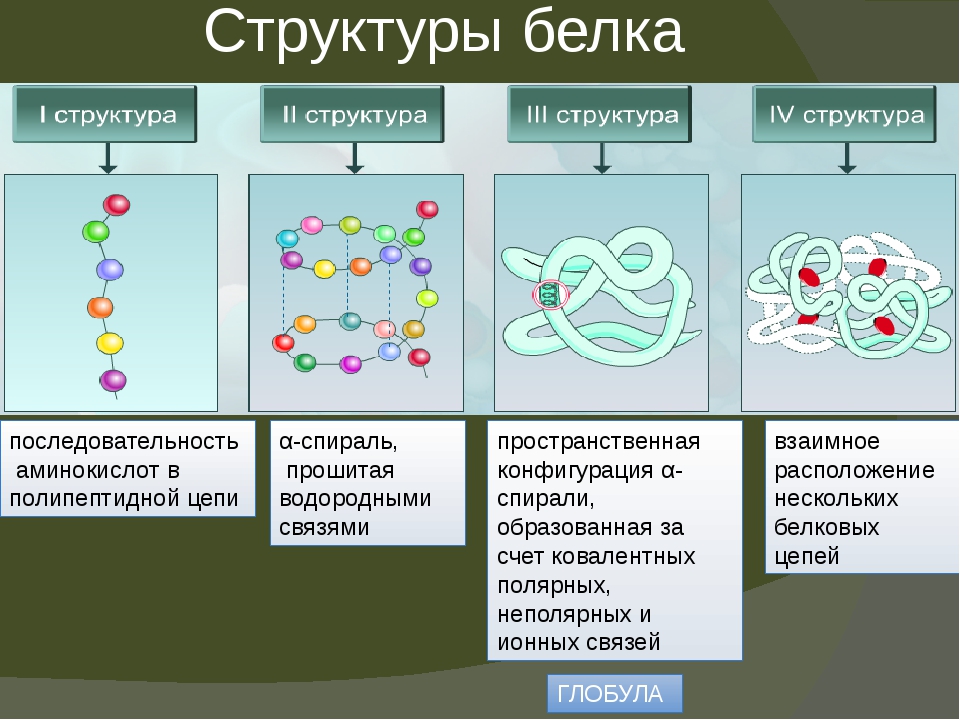
Вне зависимости от способа появления аномальный белок может стать причиной заражения других людей.
Прионные заболевания: особенности течения, лечения, прогноз
Отличительной особенностью болезней, вызываемых прионами, является длительный инкубационный период - от 2-3 месяцев до нескольких десятилетий. Подавляющее большинство прионных заболеваний человека являются спорадическими и имеют семейный характер наследования.
Куру, синдром Герстманна-Штреусслера-Шейнкера, болезнь Крейтцфельдта-Якоба, скрэпи – прионы вызывают заболевания, сопровождаемые поражением центральной нервной системы. Для них характерны такие признаки как деменция (слабоумие), зрительные и мозжечковые нарушения. При этом у больного могут отмечаться двигательные расстройства, бессонница, галлюцинации, нарушение речи.
К сожалению, эффективных методов лечения прионных болезней на сегодняшний день нет, хотя учёные пытаются предотвращать переход нормального белка в аномальный.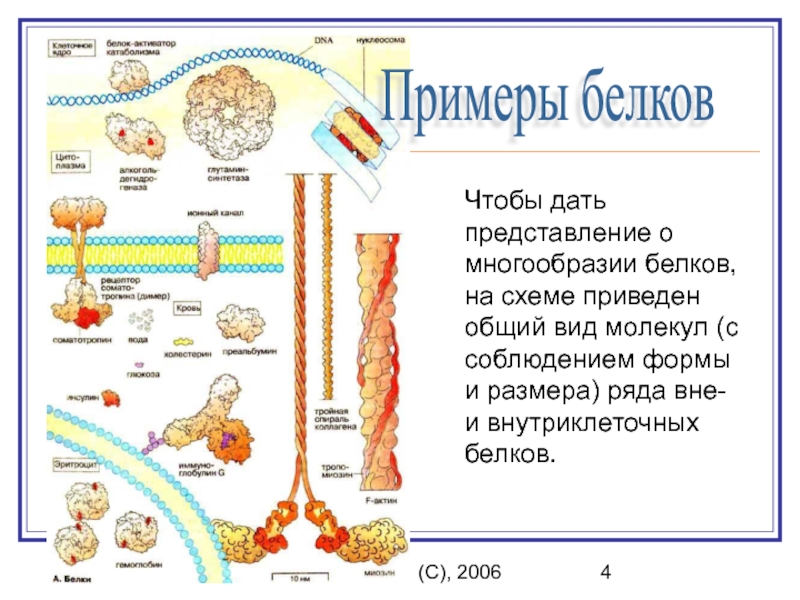 Пациентам назначается симптоматическая терапия с использованием противосудорожных средств для облегчения страданий. Прогноз пока неутешителен, так как все вышеперечисленные заболевания завершаются летальным исходом.
Пациентам назначается симптоматическая терапия с использованием противосудорожных средств для облегчения страданий. Прогноз пока неутешителен, так как все вышеперечисленные заболевания завершаются летальным исходом.
Перспективы
Недостаточная изученность проблемы прионов и прионных болезней способствует углублению исследований в этой области — учёные занимаются активным поиском средств борьбы с патогенными белками. Актуальность этого вопроса растёт в связи с возможностью возникновения «прионной эпидемии», например, из-за приёма лекарственных средств животного происхождения.
Раскрытие загадочных явлений, которыми окутаны прионы, возможно, поможет в понимании ряда серьёзных биомедицинских проблем человечества.
Севиля Ибраимова
Редакция рекомендует:
Не антибиотиком единым: «киллеры» бактерий – бактериофаги
Риск на грани. Как открыли хеликобактер пилори?
Перекрестная аллергия: пищевая, поллионез, таблицы
Что это такое
Причины возникновения аллергии
Симптомы
Как диагностировать перекрестную аллергию
Распространенные перекрестные реакции
Профилактика и лечение
Аллергия — это реакция иммунной системы на раздражитель. Симптомы обычно проявляются при повторном контакте с аллергеном, к которому человек чувствителен. В современном мире нарушение есть примерно у 40 % населения планеты. У многих возникает определенный вид аллергии, который проявляется атопическим дерматитом, зудом в ротовой области, слезоточивостью1. Бывают случаи, когда у человека с повышенной чувствительностью к пыльце растений возникает реакция на какой-то продукт питания. Информация о том, что такое перекрестная аллергия, по каким принципам она развивается и чем опасна, пригодится каждому, ведь от этого не застрахован никто.
Симптомы обычно проявляются при повторном контакте с аллергеном, к которому человек чувствителен. В современном мире нарушение есть примерно у 40 % населения планеты. У многих возникает определенный вид аллергии, который проявляется атопическим дерматитом, зудом в ротовой области, слезоточивостью1. Бывают случаи, когда у человека с повышенной чувствительностью к пыльце растений возникает реакция на какой-то продукт питания. Информация о том, что такое перекрестная аллергия, по каким принципам она развивается и чем опасна, пригодится каждому, ведь от этого не застрахован никто.
Перекрестная аллергия — это реакция организма на схожие по антигенному (антиген— генетически чужеродное вещество) составу аллергены. Такая аллергия достаточно часто возникает на ингаляционные (попадают в организм в процессе дыхания) и пищевые аллергены, инфекционные (бактерии, вирусы) и неинфекционные. По статистике, у 23–76 % пациентов с аллергическим ринитом (это реакция на пыльцу) есть повышенная чувствительность и к продуктам питания4.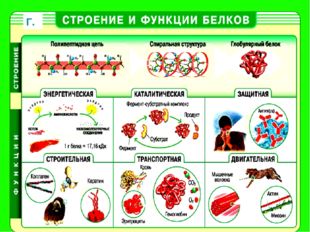
Аллергены разделяют на неинфекционные и инфекционные. К неинфекционным относятся пыльцевые, пищевые, бытовые, лекарственные, промышленные. Инфекционные аллергены — это компоненты бактерий, вирионов (частицы вирусов) и грибов1.
Известно более 700 видов аллергенных растений. Их пыльца вызывает высокий иммунный ответ, вызывая развитие поллиноза (сезонной аллергии). Чаще всего встречается аллергия на пыльцу березы, ольхи, злаков и сорных трав5.
Продукты, на которые чаще всего бывает аллергия, собраны в так называемую большую восьмёрку: коровье молоко, рыба и морепродукты, арахис, орехи, шоколад, куриное яйцо, соя, пшеница6.
Чаще всего это домашняя пыль, которая состоит из фрагментов шерсти домашних животных, насекомых, пылевых клещей, молекул средств для уборки, текстильных волокон.
Лекарственные
Любой лекарственный препарат может вызвать аллергию. При чувствительности к одному препарату могут возникать реакции и на другие если у них в составе содержится одинаковый антиген.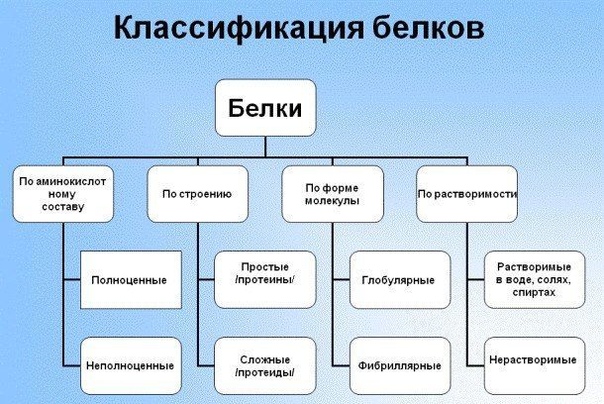
Очень часто приводят к развитию профессиональных болезней. Могут входить в состав пыли (папильонажная, мучная пыль) или представлять собой химические соединения в разных агрегатных состояниях (формальдегидные лаки, краски, пестициды, эпоксидные смолы).
Белковые фрагменты клеточных стенок бактерий, грибов, гельминтов могут вызывать аллергию. Иногда ее симптомы накладываются на клинику инфекционного заболевания, утяжеляя процесс1.
Аллергическая реакция возникает, когда есть сбой в работе иммунной системы. В ответ на аллерген в организме активируются иммунные клетки (В-лимфоциты), вырабатывающие специфические белковые молекулы — иммуноглобулины, которые затем фиксируются на поверхности тучных клеток (они составляют соединительные ткани как часть иммунной системы). Этот процесс называется сенсибилизацией. При повторном контакте с аллергеном происходит иммуноглобулин-зависимая активация тучных клеток, после чего выделяются биологически активные вещества: гистамин, триптаза и другие1.
Аллергическую реакцию в сенсибилизированном организме может спровоцировать не только специфический аллерген, но и другие, схожие по антигенному составу. Так развивается перекрестная аллергия
Обычное проявление перекрестной пищевой аллергии — оральный аллергический синдром. Такое состояние возникает в ответ на пищевые аллергены у пациентов с поллинозом.
Зуд
Покалывание губ и слизистой ротоглотки
Ощущение комка в горле
Временная охриплость или потеря голоса
Отек языка, губ, нёб
Воспаление кожи вокруг рт
Такие симптомы появляются внезапно при поступлении аллергена с пищей, сохраняются в течение нескольких минут и постепенно сходят на нет7.
Иногда при перекрестной аллергической реакции может возникнуть синдром оральной аллергии7.
Правильный диагноз может поставить аллерголог-иммунолог. В первую очередь врач собирает анамнез для выяснения сезонности заболевания, наследственной отягощенности и уточнения симптомов. Чтобы пациент не забыл сообщить врачу о проявлениях аллергии, удобно использовать специализированные опросники. После осмотра назначают лабораторные анализы, результаты которых помогут поставить правильный диагноз.
Чтобы пациент не забыл сообщить врачу о проявлениях аллергии, удобно использовать специализированные опросники. После осмотра назначают лабораторные анализы, результаты которых помогут поставить правильный диагноз.
Специфическую аллергодиагностику проводят с помощью кожных проб, это позволяет точно определить вид аллергена. Для подтверждения диагноза берут кровь на уровень IgE-антител. Наличие перекрестной аллергии подтверждается результатами орального провокационного теста. Для этого пациенту дают съесть предполагаемые аллергены, после чего наблюдают за симптомами аллергической реакции. Врач оценивает итог исследования как позитивный или негативный. Наиболее достоверный результат получают при использовании естественного аллергена4. При проведении провокационных тестов необходимо строго соблюдать технику выполнения, так как у пациента может появиться тяжелая аллергическая реакция или ложноотрицательный результат7.
Есть список веществ, при контакте с которыми аллергия развивается чаще всего. К настоящему времени определено и систематизировано большое количество антигенов1. Для возникновения перекрестной аллергической реакции достаточно, чтобы аллергены разного происхождения совпадали на 70 %. Данные по перекрестной чувствительности между веществами отражают в таблицах.
К настоящему времени определено и систематизировано большое количество антигенов1. Для возникновения перекрестной аллергической реакции достаточно, чтобы аллергены разного происхождения совпадали на 70 %. Данные по перекрестной чувствительности между веществами отражают в таблицах.
Очень часто встречается перекрестная аллергия между продуктами питания. Людям с аллергической предрасположенностью стоит ограничить в меню продукты из таблицы ниже.
Молоко коровье8
Молоко других животных, соя, продукты на основе молока, ферментные препараты на основе молочного белка, говядина
Яйца куриные10
Молоко других животных, соя, продукты на основе молока, ферментные препараты на основе молочного белка, говядина
Птичьи перья, препараты интерферонов, некоторые вакцины
Косточковые (слива, абрикос)11
Груша, чернослив, миндаль, яблочный уксус
Пыльца березы, полыни, злаков, латекс
Арахис, горох, чечевица, бобы
Пыльца злаковых трав
Киви, авокадо, дыня
У некоторых людей с аллергией на пыльцу нежелательные реакции возникают и на сырые фрукты и овощи11.
Пищевая перекрестная чувствительность
Яблоко, груша, абрикос, персик, слива, морковь, киви, вишня, черешня, банан, картофель, орехи, петрушка, укроп, сельдерей, тмин
Пиво, квас, зерновые, бобовые, помидоры, кукуруза, соя
Тмин, ромашка, фенхель, анис, семечки подсолнечника, кориандр, стручковый перец, сельдерей, укроп, картофель
Майонез, растительное масло, халва, горчица
Латекс делают из переработанного сока каучукового дерева. Из этого материала производят медицинские перчатки, соски для малышей, спортивное снаряжение, презервативы и т. д. В развитии аллергических реакций на латекс участвуют сразу несколько типов аллергенов11.
Чувствительные к латексу люди примерно в 35 % случаев склонны к возникновению перекрестных аллергических реакций на пищевые продукты. Чаще всего при изолированной сенсибилизации симптомы аллергии провоцируют бананы, киви, авокадо, каштан (синдром «латекс-фрукт»). Если возникает сочетанная аллергия, причиной симптомов могут выступать грибы, фрукты и овощи9.
У рыбных белков высокая перекрестная активность. Поэтому, если у человека аллергия на какой-то вид рыбы, вероятность появления нежелательной реакции при употреблении других видов составляет более 50 %. Такая аллергия возникает при употреблении в пищу моллюсков и ракообразных12.
Орехи очень часто содержатся в сладостях (нуге, конфетах и т. д.). Это важно учитывать, поскольку спровоцировать реакцию могут даже очень низкие дозы аллергена. У людей с аллергией на орехи также может наблюдаться повышенная чувствительность к пыльце деревьев и трав9.
Домашняя пыль часто провоцирует такие заболевания, как аллергический ринит, бронхиальная астма, атопический дерматит. Основной компонент домашней пыли — клещи. У людей, сенсибилизированных к клещевым аллергенам, может развиваться перекрёстная аллергическая реакция при употреблении в пищу морепродуктов (креветок)13.
Лекарства тоже могут вызывать аллергию. Симптомы различные — от сыпи на коже до бронхоспазма и даже анафилактического шока.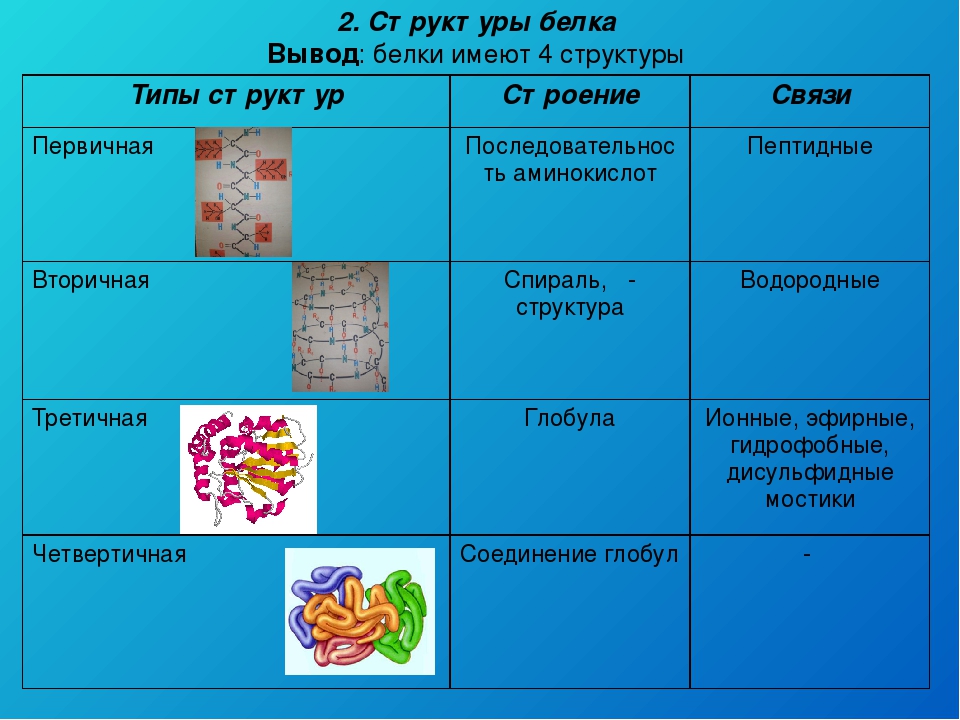 У лекарственных препаратов часто бывают перекрестные компоненты. Примеры в таблице13.
У лекарственных препаратов часто бывают перекрестные компоненты. Примеры в таблице13.
Лекарства, вызывающие перекрестную аллергию
Цефалоспорины, полусинтетические пенициллины
Олететрин, доксициклин, морфоциклин
Другие НПВС (анальгин, цитрамон, аскофен), таблетки в желтой оболочке
Местные анестетики и сульфаниламидные препараты
При терапии перекрестной аллергии стоит ограничить контакт с аллергеном, а также соблюдать исключающую диету.
Один из методов терапии — аллерген-специфическая иммунотерапия. В организм пациента вводят постепенно возрастающие дозы вещества, это приводит к снижению чувствительности к нему14. Такая терапия проводится только под контролем врача-аллерголога.
Задача симптоматической терапии — облегчить клинические проявления нарушения. Для этого используются антигистаминные препараты. Они блокируют рецепторы, с которыми связывается гистамин — вещество, ответственное за развитие симптомов аллергии.
Антигистаминные препараты есть первого и второго поколения . У средств первого поколения много нежелательных эффектов: они влияют на центральную нервную систему и вызывают сонливость, нарушение координации, вялость. Еще один недостаток — быстрое снижение лекарственного эффекта (тахифилаксия) и необходимость частой замены препарата.
У препаратов второго и третьго поколения антигистаминных средств нет таких побочных эффектов, как влияние на ЦНС или привыкание, а их действие обычно более продолжительно, чем у препаратов первого поколения. Одно из таких средств — это цетиризин. Его преимущества в том, что он избирательно блокирует Н1-гистаминовые рецепторы и угнетает выделение медиаторов поздней фазы аллергической реакции, обусловленной миграцией эозинофилов, нейтрофилов и базофилов в ответ на введение аллергена12.
Также могут применяться местные гормональные противовоспалительные средства, которые препятствуют выделению биологически активных веществ из тучных клеток15.
В качестве профилактических мер аллергикам необходимо тщательно продумывать меню, исключая высокоаллергенные продукты и пищу, вызывающую перекрестную аллергию. Следует своевременно лечить основное аллергическое заболевание и всегда сообщать врачу о наличии перекрестной аллергии, особенно при одновременном назначении нескольких препаратов или вакцинации16.
3.4 Белки. Биология 2e
Цели обучения
К концу этого раздела вы сможете делать следующее:
- Описывать функции, которые белки выполняют в клетке и тканях
- Обсудите связь между аминокислотами и белками
- Объясните четыре уровня организации белков
- Опишите, как связаны форма и функция белка
Белки являются одними из самых распространенных органических молекул в живых системах и обладают самым разнообразным набором функций среди всех макромолекул.Белки могут быть структурными, регуляторными, сократительными или защитными.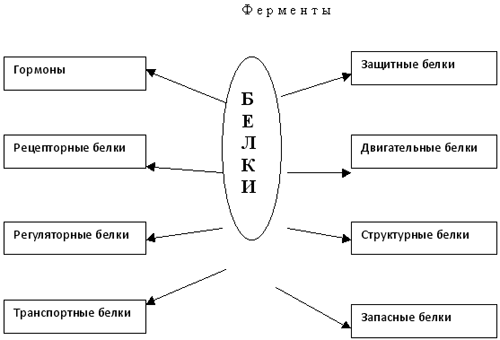 Они могут служить при транспортировке, хранении или мембранах; или они могут быть токсинами или ферментами. Каждая клетка живой системы может содержать тысячи белков, каждый из которых выполняет уникальную функцию. Их структура, как и их функции, сильно различаются. Однако все они представляют собой аминокислотные полимеры, расположенные в линейной последовательности.
Они могут служить при транспортировке, хранении или мембранах; или они могут быть токсинами или ферментами. Каждая клетка живой системы может содержать тысячи белков, каждый из которых выполняет уникальную функцию. Их структура, как и их функции, сильно различаются. Однако все они представляют собой аминокислотные полимеры, расположенные в линейной последовательности.
Типы и функции белков
Ферменты, вырабатываемые живыми клетками, являются катализаторами биохимических реакций (например, пищеварения) и обычно представляют собой сложные или сопряженные белки.Каждый фермент специфичен для субстрата (реагента, который связывается с ферментом), на который он действует. Фермент может помочь в реакциях распада, перегруппировки или синтеза. Мы называем ферменты, расщепляющие свои субстраты, катаболическими ферментами. Те, которые строят из своих субстратов более сложные молекулы, являются анаболическими ферментами, а ферменты, влияющие на скорость реакции, — каталитическими ферментами. Отметим, что все ферменты увеличивают скорость реакции и, следовательно, являются органическими катализаторами. Примером фермента является амилаза слюны, которая гидролизует свой субстрат амилозу, компонент крахмала.
Отметим, что все ферменты увеличивают скорость реакции и, следовательно, являются органическими катализаторами. Примером фермента является амилаза слюны, которая гидролизует свой субстрат амилозу, компонент крахмала.
Гормоны представляют собой химические сигнальные молекулы, обычно небольшие белки или стероиды, секретируемые эндокринными клетками, которые контролируют или регулируют определенные физиологические процессы, включая рост, развитие, обмен веществ и размножение. Например, инсулин — это белковый гормон, который помогает регулировать уровень глюкозы в крови. В таблице 3.1 перечислены основные типы и функции белков.
Типы белков и их функции
| Тип | Примеры | Функции | |
|---|---|---|---|
| пищеварительные ферменты | амилаза, липаза, пепсин, трипсин | . | |
| 120028 | Construal | Actin, Tubulin, Keratin | построить разные структуры, как цитоскелет |
| Гормоны | инсулин, тироксин | координата различных систем организма | |
| защита | Immunoglobulins | Тело из иностранных патогенов | |
| Actional | ACTIN, MYOSIN | Срок сокращения мышц | |
| Склад | |||
| Склад | Брубовые белки, яичные белые (альбумин) | обеспечивают питание в раннем развитии эмбриона и рассады |
Таблица
3. 1
1
Белки имеют разную форму и молекулярную массу. Некоторые белки имеют глобулярную форму; тогда как другие имеют волокнистую природу. Например, гемоглобин представляет собой глобулярный белок, а коллаген, находящийся в нашей коже, представляет собой волокнистый белок. Форма белка имеет решающее значение для его функции, и многие различные типы химических связей поддерживают эту форму. Изменения температуры, рН и воздействие химических веществ могут привести к необратимым изменениям формы белка, что приведет к потере функции или денатурации.Различное расположение одних и тех же 20 типов аминокислот составляют все белки. Недавно были обнаружены две новые редкие аминокислоты (селеноцистеин и пирролизин), и этот список может быть дополнен новыми открытиями.
Аминокислоты
Аминокислоты представляют собой мономеры, из которых состоят белки. Каждая аминокислота имеет одинаковую фундаментальную структуру, состоящую из центрального атома углерода или альфа-( α ) углерода, связанного с аминогруппой (NH 2 ), карбоксильной группой (COOH) и атомом водорода. атом.Каждая аминокислота также имеет другой атом или группу атомов, связанных с центральным атомом, известную как группа R (рис. 3.22).
атом.Каждая аминокислота также имеет другой атом или группу атомов, связанных с центральным атомом, известную как группа R (рис. 3.22).
Фигура
3,22
Аминокислоты имеют центральный асимметричный углерод, к которому присоединены аминогруппа, карбоксильная группа, атом водорода и боковая цепь (группа R).
Ученые используют название «аминокислота», потому что эти кислоты содержат в своей основной структуре как аминогруппу, так и карбоксильную группу. Как мы уже упоминали, в белках присутствует 20 распространенных аминокислот.Девять из них являются незаменимыми аминокислотами для человека, потому что человеческий организм не может их производить, и мы получаем их из нашего рациона. Для каждой аминокислоты группа R (или боковая цепь) различна (рис. 3.23).
Визуальная связь
Визуальная связь
Фигура
3,23
В белках обычно встречаются 20 аминокислот, каждая из которых имеет свою R-группу (вариантную группу), которая определяет ее химическую природу.
Какие категории аминокислот вы ожидаете найти на поверхности растворимого белка и какие вы ожидаете найти внутри? Какое распределение аминокислот вы ожидаете найти в белке, встроенном в двойной липидный слой?
Химическая природа боковой цепи определяет природу аминокислоты (то есть, является ли она кислотной, основной, полярной или неполярной).Например, аминокислота глицин имеет атом водорода в качестве группы R. Аминокислоты, такие как валин, метионин и аланин, являются неполярными или гидрофобными по своей природе, в то время как аминокислоты, такие как серин, треонин и цистеин, являются полярными и имеют гидрофильные боковые цепи. Боковые цепи лизина и аргинина заряжены положительно, поэтому эти аминокислоты также являются основными аминокислотами. Пролин имеет группу R, которая связана с аминогруппой, образуя кольцеобразную структуру. Пролин является исключением из стандартной структуры аминокислоты, поскольку его аминогруппа не отделена от боковой цепи (рис. 3. 23).
23).
Одна заглавная буква или трехбуквенное сокращение представляют собой аминокислоты. Например, буква V или трехбуквенный символ val обозначают валин. Так же, как некоторые жирные кислоты необходимы для диеты, некоторые аминокислоты также необходимы. Эти незаменимые аминокислоты для человека включают изолейцин, лейцин и цистеин. Незаменимые аминокислоты относятся к тем, которые необходимы для построения белков в организме, но не к тем, которые организм вырабатывает. Какие аминокислоты являются незаменимыми, варьируется от организма к организму.
Последовательность и количество аминокислот в конечном итоге определяют форму, размер и функцию белка. Ковалентная связь или пептидная связь присоединяется к каждой аминокислоте, образующейся в результате реакции дегидратации. Карбоксильная группа одной аминокислоты и аминогруппа входящей аминокислоты объединяются, высвобождая молекулу воды. Образовавшаяся связь представляет собой пептидную связь (рис. 3.24).
Фигура
3,24
Образование пептидной связи является реакцией синтеза дегидратации.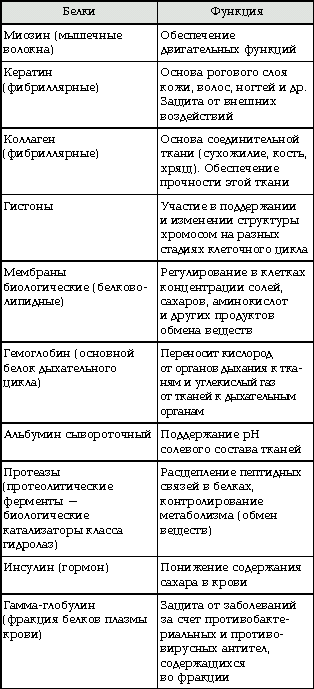 Карбоксильная группа одной аминокислоты связана с аминогруппой входящей аминокислоты.При этом выделяется молекула воды.
Карбоксильная группа одной аминокислоты связана с аминогруппой входящей аминокислоты.При этом выделяется молекула воды.
Продукты, образуемые такими связями, представляют собой пептиды. По мере того, как к этой растущей цепи присоединяется больше аминокислот, результирующая цепь представляет собой полипептид. Каждый полипептид имеет свободную аминогруппу на одном конце. Этот конец является N-концом или амино-концом, а другой конец имеет свободную карбоксильную группу, а также С-конец или карбоксильный конец. Хотя термины «полипептид» и «белок» иногда используются взаимозаменяемо, полипептид технически представляет собой полимер аминокислот, тогда как термин «белок» используется для полипептида или полипептидов, которые объединены вместе, часто имеют связанные непептидные простетические группы, имеют четкую форму. , и имеют уникальную функцию.После синтеза белка (трансляции) большинство белков модифицируются. Они известны как посттрансляционные модификации. Они могут подвергаться расщеплению, фосфорилированию или могут потребовать добавления других химических групп.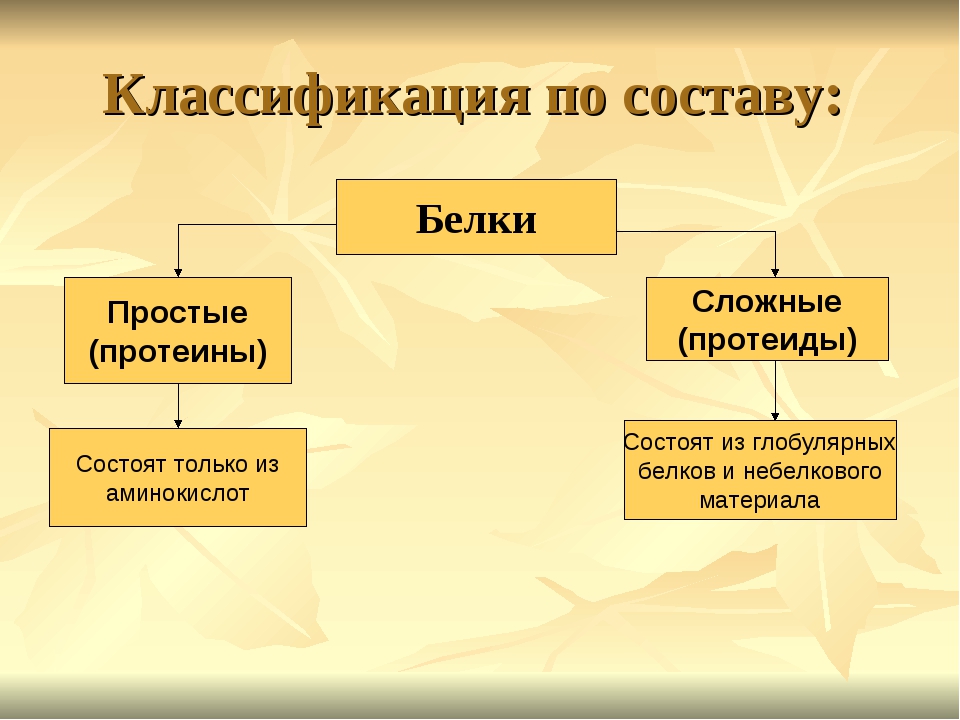 Только после этих модификаций белок становится полностью функциональным.
Только после этих модификаций белок становится полностью функциональным.
Ссылка на обучение
Ссылка на обучение
Просмотрите этапы синтеза белка в этом интерактивном руководстве.
Связь эволюции
Связь эволюции
Эволюционное значение цитохрома с Цитохром с является важным компонентом цепи переноса электронов, частью клеточного дыхания, и обычно он находится в клеточных органеллах, митохондриях.Этот белок имеет простетическую группу гема, и центральный ион гема попеременно восстанавливается и окисляется во время переноса электрона. Поскольку роль этого незаменимого белка в производстве клеточной энергии имеет решающее значение, она очень мало изменилась за миллионы лет. Секвенирование белка показало, что у разных видов существует значительная степень гомологии аминокислотной последовательности цитохрома с. Другими словами, мы можем оценить эволюционное родство, измеряя сходства или различия между последовательностями ДНК или белков разных видов.
Ученые определили, что цитохром с человека содержит 104 аминокислоты. Для каждой молекулы цитохрома с из разных организмов, которую ученые секвенировали на сегодняшний день, 37 из этих аминокислот появляются в одном и том же положении во всех образцах цитохрома с. Это указывает на то, что у них мог быть общий предок. При сравнении последовательностей белков человека и шимпанзе ученые не обнаружили различий в последовательностях. Когда исследователи сравнили последовательности человека и макаки-резус, единственное отличие было в одной аминокислоте.В другом сравнении секвенирование человека и дрожжей показывает разницу в 44-м положении.
Белковая структура
Как мы обсуждали ранее, форма белка имеет решающее значение для его функции. Например, фермент может связываться с конкретным субстратом в активном центре. Если этот активный центр изменен из-за локальных изменений или изменений в общей структуре белка, фермент может быть неспособен связываться с субстратом. Чтобы понять, как белок приобретает свою окончательную форму или конформацию, нам необходимо понять четыре уровня структуры белка: первичный, вторичный, третичный и четвертичный.
Чтобы понять, как белок приобретает свою окончательную форму или конформацию, нам необходимо понять четыре уровня структуры белка: первичный, вторичный, третичный и четвертичный.
Основная структура
Уникальная последовательность аминокислот
в полипептидной цепи является ее первичной структурой. Например, гормон поджелудочной железы инсулин имеет две полипептидные цепи, А и В, и они связаны друг с другом дисульфидными связями. N-концевая аминокислота цепи А представляет собой глицин; тогда как С-концевой аминокислотой является аспарагин (рис. 3.25). Аминокислотные последовательности в цепях А и В уникальны для инсулина.
Фигура
3,25
Инсулин бычьей сыворотки представляет собой белковый гормон, состоящий из двух пептидных цепей: А (длиной 21 аминокислота) и В (длиной 30 аминокислот).В каждой цепочке трехбуквенные аббревиатуры, представляющие названия аминокислот в том порядке, в котором они присутствуют, указывают на первичную структуру. Аминокислота цистеин (цис) имеет сульфгидрильную (SH) группу в качестве боковой цепи. Две сульфгидрильные группы могут реагировать в присутствии кислорода с образованием дисульфидной (S-S) связи. Две дисульфидные связи соединяют цепи А и В вместе, а третья помогает цепи А принять правильную форму. Обратите внимание, что все дисульфидные связи имеют одинаковую длину, но для ясности мы нарисовали их разного размера.
Аминокислота цистеин (цис) имеет сульфгидрильную (SH) группу в качестве боковой цепи. Две сульфгидрильные группы могут реагировать в присутствии кислорода с образованием дисульфидной (S-S) связи. Две дисульфидные связи соединяют цепи А и В вместе, а третья помогает цепи А принять правильную форму. Обратите внимание, что все дисульфидные связи имеют одинаковую длину, но для ясности мы нарисовали их разного размера.
Ген, кодирующий белок, в конечном итоге определяет уникальную последовательность для каждого белка. Изменение нуклеотидной последовательности кодирующей области гена может привести к добавлению другой аминокислоты к растущей полипептидной цепи, вызывая изменение структуры и функции белка. При серповидноклеточной анемии цепь гемоглобина β (небольшая часть которой показана на рис. 3.26) имеет единственную аминокислотную замену, вызывающую изменение структуры и функции белка. В частности, валин в цепи β заменяет глутаминовую аминокислоту. Что наиболее примечательно, так это то, что молекула гемоглобина состоит из двух альфа- и двух бета-цепей, каждая из которых состоит примерно из 150 аминокислот. Молекула, следовательно, имеет около 600 аминокислот. Структурная разница между молекулой нормального гемоглобина и молекулой серповидноклеточной анемии, которая резко сокращает продолжительность жизни, заключается в одной аминокислоте из 600. Что еще более примечательно, так это то, что три нуклеотида каждая кодирует эти 600 аминокислот, а изменение одного основания (точечная мутация), 1 из 1800 оснований вызывает мутацию.
Что наиболее примечательно, так это то, что молекула гемоглобина состоит из двух альфа- и двух бета-цепей, каждая из которых состоит примерно из 150 аминокислот. Молекула, следовательно, имеет около 600 аминокислот. Структурная разница между молекулой нормального гемоглобина и молекулой серповидноклеточной анемии, которая резко сокращает продолжительность жизни, заключается в одной аминокислоте из 600. Что еще более примечательно, так это то, что три нуклеотида каждая кодирует эти 600 аминокислот, а изменение одного основания (точечная мутация), 1 из 1800 оснований вызывает мутацию.
Фигура
3,26
Из-за этой замены одной аминокислоты в цепи молекулы гемоглобина образуют длинные волокна, искажающие двояковогнутую или
дискообразные эритроциты и заставляет их принимать серповидную или «серповидную» форму, которая закупоривает кровеносные сосуды (рис. 3.27). .его
3.4 • Белки 81
Бета (β)-цепь гемоглобина состоит из 147 аминокислот.
длина, но одна аминокислотная замена в первичной
последовательность приводит к изменениям во вторичном, третичном и четвертичном
структур и серповидноклеточной анемии. В нормальном гемоглобине
В нормальном гемоглобине
аминокислота в шестом положении – глутамат. В серповидноклеточной
глутамат гемоглобина заменен валином.
Авторы и права: Рао А., Таг А. Райан К. и Флетчер С. Департамент
биологии, Техасский университет A&M.
Из-за этой замены одной аминокислоты в цепи молекулы гемоглобина образуют длинные волокна, которые деформируют двояковогнутые или дискообразные эритроциты и заставляют их принимать серповидную или «серповидную» форму, что закупоривает кровеносные сосуды (рис. 3.27). Это может привести к множеству серьезных проблем со здоровьем, таких как одышка, головокружение, головные боли и боли в животе у тех, кто страдает этим заболеванием.Уильям Уоррик Кардозо показал, что серповидноклеточная анемия является наследственным заболеванием, а это означает, что разница в кодирующей области определенного гена передается от родителей к детям. Как вы узнаете из раздела генетики, наследование таких признаков определяется комбинацией генов от обоих родителей, и эти очень небольшие различия могут оказывать существенное влияние на организмы.
Фигура
3,27
В этом мазке крови, визуализированном при 535-кратном увеличении с использованием светлопольной микроскопии, серповидные клетки имеют форму полумесяца, а нормальные клетки имеют форму диска.(кредит: модификация работы Эда Утмана; данные масштабной линейки от Мэтта Рассела)
Вторичная конструкция
Локальная укладка полипептида в некоторых областях приводит к возникновению вторичной структуры белка. Наиболее распространены α -спиральные и β -складчатые листовые структуры (рис. 3.28). Обе структуры удерживаются в форме водородными связями. Водородные связи образуются между атомом кислорода в карбонильной группе одной аминокислоты и другой аминокислотой, которая находится на четыре аминокислоты дальше по цепи.
Фигура
3,28
Спираль α и складчатый лист β представляют собой вторичные белковые структуры, образующиеся при образовании водородных связей между карбонильным кислородом и
аминоводород в пептидном остове.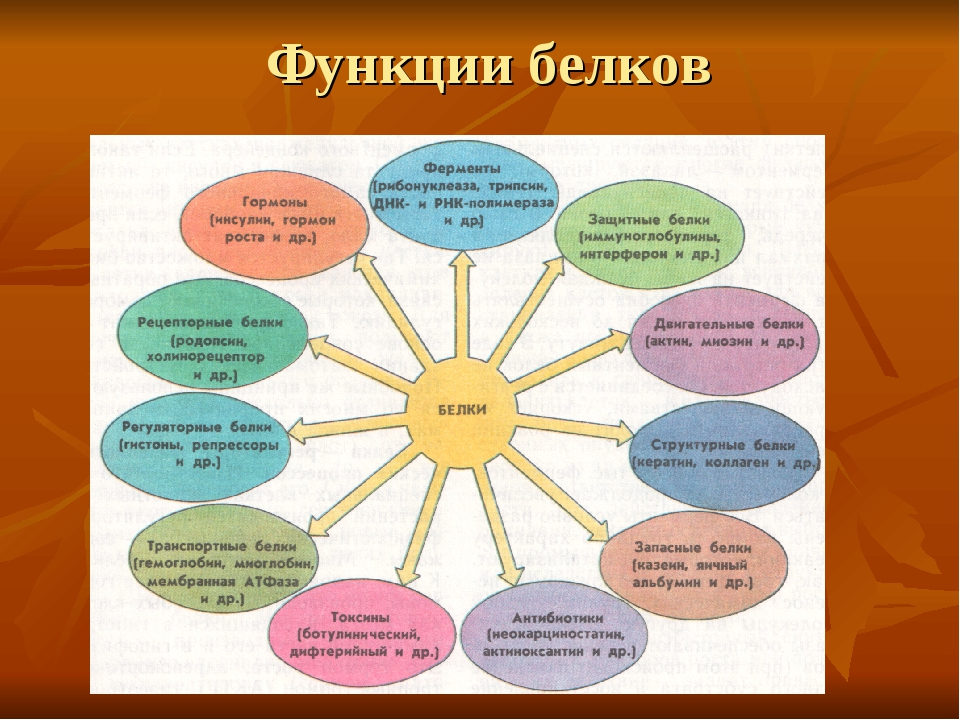 Некоторые аминокислоты имеют склонность к образованию α-спирали, в то время как другие способствуют образованию β-складок. Черный =
Некоторые аминокислоты имеют склонность к образованию α-спирали, в то время как другие способствуют образованию β-складок. Черный =
углерод, белый = водород, синий = азот и красный = кислород. Авторы и права: Рао, А., Райан, К. Флетчер, С. и Таг, А. Факультет биологии, Texas A&M
Университет.
На каждый спиральный виток альфа-спирали приходится 3,6 аминокислотных остатка. R-группы полипептида (вариантные группы) выступают из α -спиральной цепи. В складчатом листе β водородные связи между атомами в основной цепи полипептида образуют «складки». Группы R присоединены к атомам углерода и простираются выше и ниже складок складки. Складчатые сегменты располагаются параллельно или антипараллельно друг другу, а водородные связи образуются между частично положительным атомом водорода в аминогруппе и частично отрицательным атомом кислорода в карбонильной группе пептидного остова.Структуры α -спирали и β -складчатые листы присутствуют в большинстве глобулярных и волокнистых белков и играют важную структурную роль.
Третичная структура
Уникальная трехмерная структура полипептида — это его третичная структура (рис. 3.29). Эта структура частично обусловлена химическими взаимодействиями в полипептидной цепи. Прежде всего, взаимодействия между группами R создают сложную трехмерную третичную структуру белка. Природа групп R в задействованных аминокислотах может противодействовать образованию водородных связей, которые мы описали для стандартных вторичных структур.Например, группы R с одинаковыми зарядами отталкиваются друг от друга, а группы с разными зарядами притягиваются друг к другу (ионные связи). Когда происходит сворачивание белка, гидрофобные R-группы неполярных аминокислот находятся внутри белка; тогда как гидрофильные группы R лежат снаружи. Ученые также называют первые типы взаимодействия гидрофобными взаимодействиями. Взаимодействие между боковыми цепями цистеина образует дисульфидные связи в присутствии кислорода, единственную ковалентную связь, которая образуется во время фолдинга белка.
Фигура
3,29
Разнообразие химических взаимодействий определяет третичную структуру белков. К ним относятся гидрофобные взаимодействия, ионная связь, водородная связь и дисульфидные связи.
Все эти взаимодействия, слабые и сильные, определяют окончательную трехмерную форму белка. Когда белок теряет свою трехмерную форму, он может больше не функционировать.
Четвертичная структура
В природе некоторые белки формируются из нескольких полипептидов или субъединиц, и взаимодействие этих субъединиц образует четвертичную структуру.Слабые взаимодействия между субъединицами помогают стабилизировать общую структуру. Например, инсулин (глобулярный белок) имеет комбинацию водородных и дисульфидных связей, которые заставляют его слипаться в шарообразную форму. Инсулин начинается как один полипептид и теряет некоторые внутренние последовательности в присутствии посттрансляционной модификации после образования дисульфидных связей, которые удерживают вместе оставшиеся цепи. Шелк (волокнистый белок), однако, имеет β складчатую листовую структуру, которая является результатом водородных связей между различными цепями.
Шелк (волокнистый белок), однако, имеет β складчатую листовую структуру, которая является результатом водородных связей между различными цепями.
На рис. 3.30 показаны четыре уровня структуры белка (первичный, вторичный, третичный и четвертичный).
Фигура
3.30
Обратите внимание на четыре уровня структуры белка на этих иллюстрациях. Авторы и права: Рао, А. Райан, К. и Таг, А. Факультет биологии, Техас.
Университет A&M.
Денатурация и сворачивание белков
Каждый белок имеет свою уникальную последовательность и форму, которые скрепляются химическими взаимодействиями. Если белок подвержен изменениям температуры, рН или воздействию химических веществ, структура белка может измениться, потеряв свою форму без потери своей первичной последовательности в результате того, что ученые называют денатурацией.Денатурация часто бывает обратимой, потому что первичная структура полипептида сохраняется в процессе, если денатурирующий агент удален, что позволяет белку возобновить свою функцию.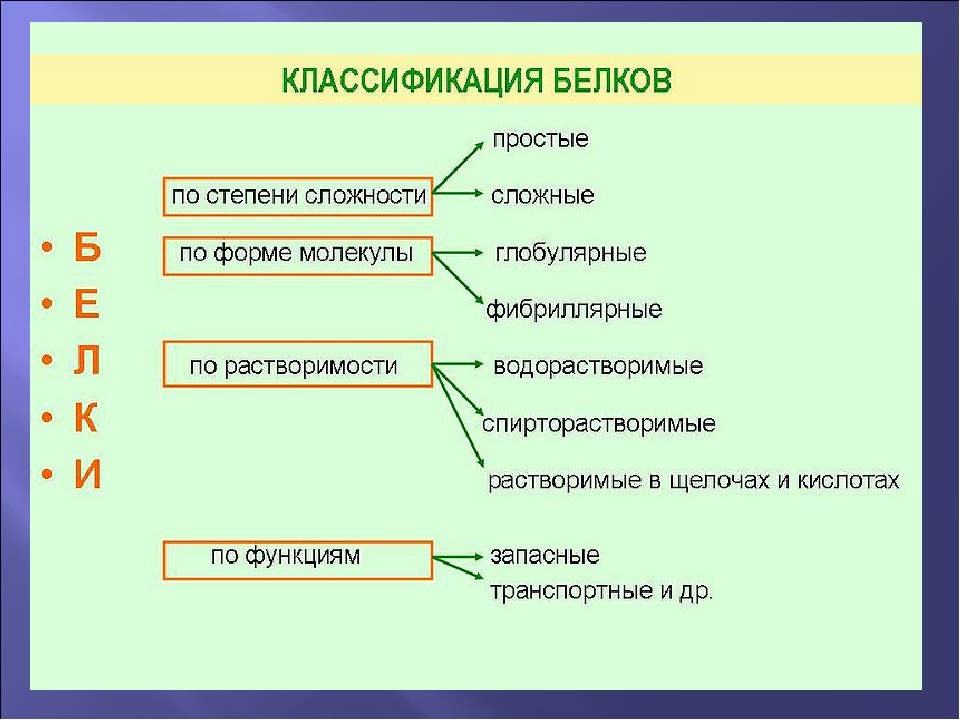 Иногда денатурация необратима и приводит к потере функции. Одним из примеров необратимой денатурации белка является жарка яиц. Белок альбумин в жидком яичном белке денатурирует при помещении на горячую сковороду. Не все белки денатурируют при высоких температурах. Например, бактерии, которые выживают в горячих источниках, имеют белки, функционирующие при температурах, близких к температуре кипения.Желудок также очень кислый, имеет низкий pH и денатурирует белки в процессе пищеварения; однако в этих условиях пищеварительные ферменты желудка сохраняют свою активность.
Иногда денатурация необратима и приводит к потере функции. Одним из примеров необратимой денатурации белка является жарка яиц. Белок альбумин в жидком яичном белке денатурирует при помещении на горячую сковороду. Не все белки денатурируют при высоких температурах. Например, бактерии, которые выживают в горячих источниках, имеют белки, функционирующие при температурах, близких к температуре кипения.Желудок также очень кислый, имеет низкий pH и денатурирует белки в процессе пищеварения; однако в этих условиях пищеварительные ферменты желудка сохраняют свою активность.
Сворачивание белка имеет решающее значение для его функции. Первоначально ученые думали, что сами белки ответственны за процесс сворачивания. Только недавно исследователи обнаружили, что часто они получают помощь в процессе фолдинга от белков-помощников или шаперонов (или шаперонинов), которые связываются с белком-мишенью в процессе фолдинга.Они действуют, предотвращая агрегацию полипептидов, составляющих полную структуру белка, и диссоциируют от белка, как только целевой белок свернут.
Ссылка на обучение
Ссылка на обучение
Чтобы получить дополнительную информацию о белках, просмотрите анимацию под названием «Биомолекулы: белки».
3.4 Белки — Биология для курсов AP®
Цели обучения
В этом разделе вы расследуете следующие вопросы:
- Каковы функции белков в клетках и тканях?
- Какая связь между аминокислотами и белками?
- Каковы четыре уровня организации белка?
- Какая связь между формой и функцией белка?
Соединение для AP
® Курсы
Белки представляют собой длинные цепочки различных последовательностей из 20 аминокислот, каждая из которых содержит аминогруппу (-NH 2 ), карбоксильную группу (-COOH) и вариабельную группу.(Подумайте, сколько белковых «слов» можно составить из 20 аминокислотных «букв»). Каждая аминокислота связана с соседней пептидной связью, образованной в результате реакции дегидратации. Длинная цепь аминокислот известна как полипептид. Белки выполняют множество функций в клетках. Они действуют как ферменты, которые катализируют химические реакции, обеспечивают структурную поддержку, регулируют прохождение веществ через клеточную мембрану, защищают от болезней и координируют клеточные сигнальные пути. Белковая структура организована на четырех уровнях: первичном, вторичном, третичном и четвертичном.Первичная структура представляет собой уникальную последовательность аминокислот. Изменение всего лишь одной аминокислоты может изменить структуру и функцию белка. Например, серповидноклеточная анемия возникает в результате замены всего одной аминокислоты в молекуле гемоглобина, состоящей из 574 аминокислот. Вторичная структура состоит из локальной укладки полипептида за счет образования водородной связи; что приводит к конформациям α-спирали и β-складчатого листа. В третичной структуре различные взаимодействия, например водородные связи, ионные связи, дисульфидные связи и гидрофобные взаимодействия между группами R, способствуют сворачиванию полипептида в различные трехмерные конфигурации.
Длинная цепь аминокислот известна как полипептид. Белки выполняют множество функций в клетках. Они действуют как ферменты, которые катализируют химические реакции, обеспечивают структурную поддержку, регулируют прохождение веществ через клеточную мембрану, защищают от болезней и координируют клеточные сигнальные пути. Белковая структура организована на четырех уровнях: первичном, вторичном, третичном и четвертичном.Первичная структура представляет собой уникальную последовательность аминокислот. Изменение всего лишь одной аминокислоты может изменить структуру и функцию белка. Например, серповидноклеточная анемия возникает в результате замены всего одной аминокислоты в молекуле гемоглобина, состоящей из 574 аминокислот. Вторичная структура состоит из локальной укладки полипептида за счет образования водородной связи; что приводит к конформациям α-спирали и β-складчатого листа. В третичной структуре различные взаимодействия, например водородные связи, ионные связи, дисульфидные связи и гидрофобные взаимодействия между группами R, способствуют сворачиванию полипептида в различные трехмерные конфигурации. Большинство ферментов имеют третичную конфигурацию. Если белок денатурируется, теряет свою трехмерную форму, он может больше не функционировать. Условия окружающей среды, такие как температура и pH, могут денатурировать белки. Некоторые белки, например гемоглобин, образуются из нескольких полипептидов, и взаимодействия этих субъединиц формируют четвертичную структуру белков.
Большинство ферментов имеют третичную конфигурацию. Если белок денатурируется, теряет свою трехмерную форму, он может больше не функционировать. Условия окружающей среды, такие как температура и pH, могут денатурировать белки. Некоторые белки, например гемоглобин, образуются из нескольких полипептидов, и взаимодействия этих субъединиц формируют четвертичную структуру белков.
Представленная информация и примеры, выделенные в разделе, вспомогательные концепции и цели обучения, изложенные в Большой идее 4 структуры учебного плана по биологии AP ® .Цели обучения, перечисленные в структуре учебного плана, обеспечивают прозрачную основу для курса биологии AP ® , основанного на запросах лабораторного опыта, учебных занятий и экзаменационных вопросов AP ® . Цель обучения объединяет необходимый контент с одной или несколькими из семи научных практик.
| Большая идея 4 | Биологические системы взаимодействуют, и эти системы и их взаимодействия обладают сложными свойствами.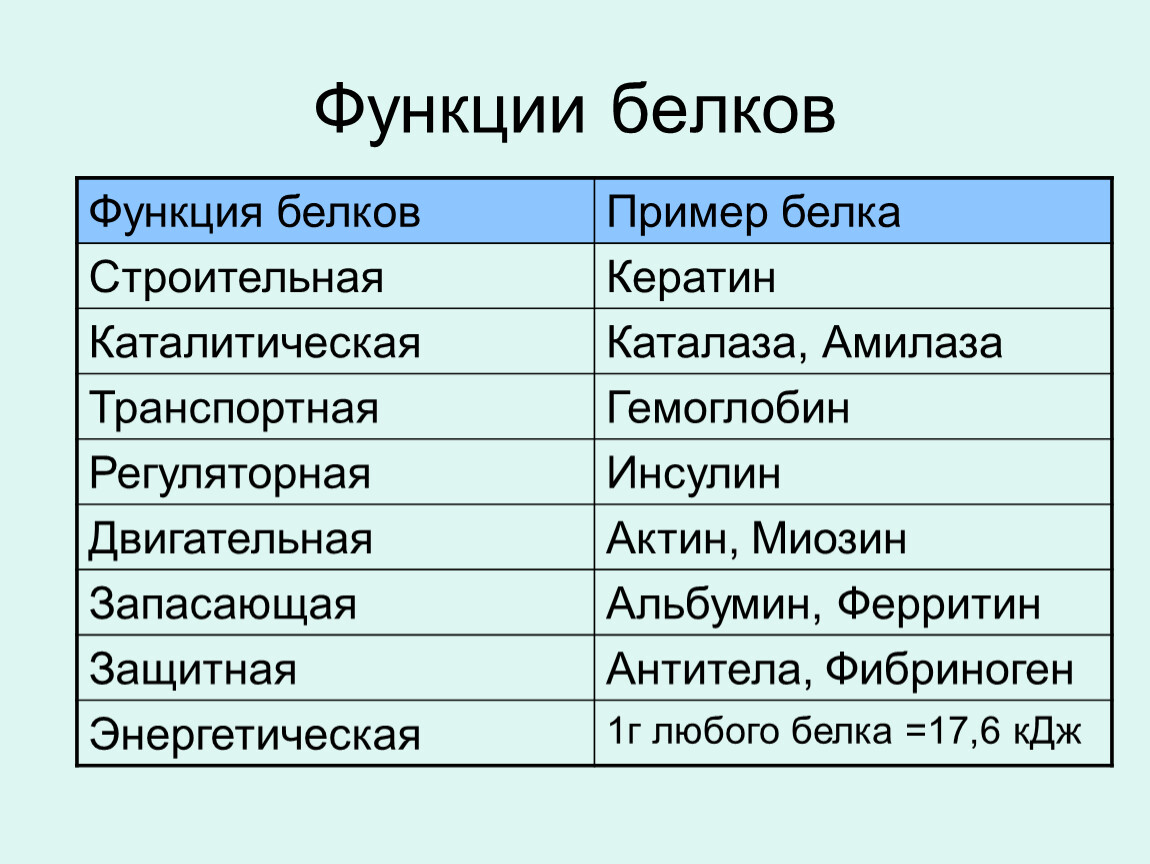 |
| Прочное понимание 4.A | Взаимодействия внутри биологических систем приводят к сложным свойствам. |
| Основные знания | 4.А.1 Подкомпоненты биологических молекул и их последовательность определяют свойства этой молекулы. |
| Научная практика | 7.1 Учащийся может связывать явления и модели в пространственных и временных масштабах. |
| Цель обучения | 4.1 Учащийся может объяснить связь между последовательностью и субкомпонентами биологического полимера и его свойствами. |
| Основные знания | 4.А.1 Подкомпоненты биологических молекул и их последовательность определяют свойства этой молекулы. |
| Научная практика | 1.3 Студент может уточнить представления и модели природных или искусственных явлений и систем в предметной области. 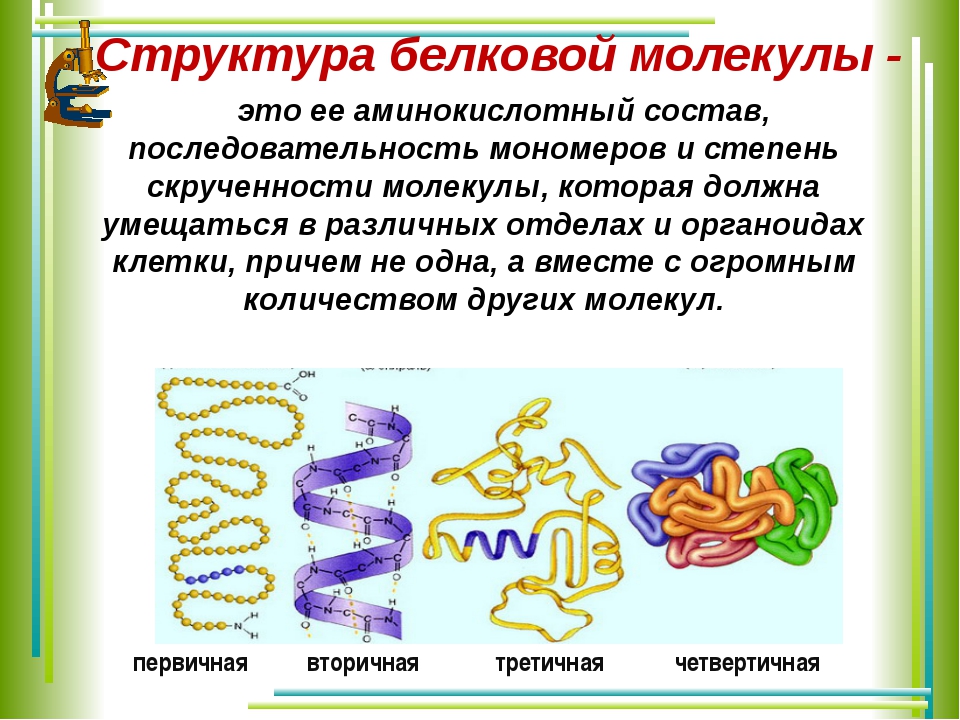 |
| Цель обучения | 4,2 Студент может уточнить представления и модели, чтобы объяснить, как субкомпоненты биологического полимера и их последовательность определяют свойства этого полимера. |
| Основные знания | 4.А.1 Подкомпоненты биологических молекул и их последовательность определяют свойства этой молекулы. |
| Научная практика | 6.1 Учащийся может обосновать утверждения доказательствами. |
| Научная практика | 6,4 Студент может делать заявления и прогнозы о природных явлениях на основе научных теорий и моделей. |
| Цель обучения | 4,3 Учащийся может использовать модели для прогнозирования и обоснования того, что изменения в субкомпонентах биологического полимера влияют на функциональность молекул.  |
Служба поддержки учителей
Двадцать аминокислот могут быть преобразованы в почти неограниченное количество различных белков. Последовательность аминокислот в конечном итоге определяет окончательную конфигурацию белковой цепи, придавая молекуле ее специфическую функцию.
Поддержка учителей
Подчеркните, что белки выполняют в организме различные функции. Таблица 3.1 содержит некоторые примеры этих функций. Обратите внимание, что не все ферменты работают в одинаковых условиях.Амилаза работает только в щелочной среде, например, в слюне, тогда как пепсин работает в кислой среде желудка. Обсудите другие материалы, которые могут переноситься белками в жидкостях организма, в дополнение к веществам, перечисленным для транспорта в тексте. Белки также переносят нерастворимые липиды в организме и транспортируют заряженные ионы, такие как кальций, магний и цинк.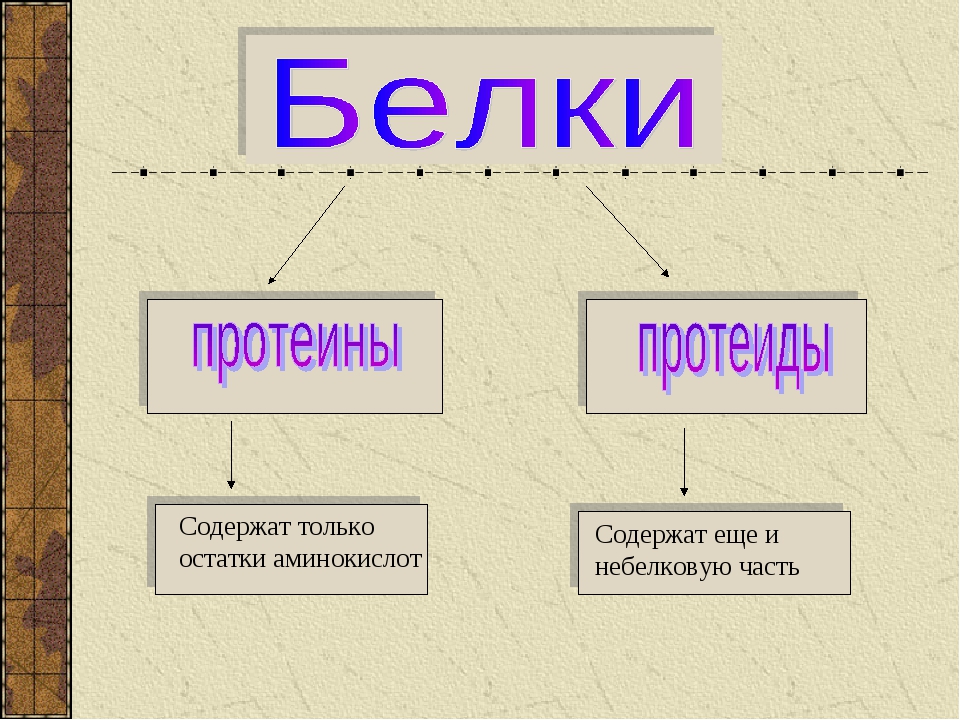 Обсудите другой важный структурный белок, коллаген, так как он содержится во всем организме, в том числе в большинстве соединительных тканей. Подчеркните, что не все гормоны являются белками, и что гормоны на основе стероидов обсуждались в предыдущем разделе.
Обсудите другой важный структурный белок, коллаген, так как он содержится во всем организме, в том числе в большинстве соединительных тканей. Подчеркните, что не все гормоны являются белками, и что гормоны на основе стероидов обсуждались в предыдущем разделе.
Аминогруппа аминокислоты теряет электрон и становится положительно заряженной. Карбоксильная группа легко получает электрон, становясь отрицательно заряженной. Это приводит к амфипатическому характеру аминокислот и придает соединениям растворимость в воде. Наличие обеих функциональных групп также позволяет дегидратационному синтезу соединять отдельные аминокислоты в пептидную цепь.
Белковая структура объясняется так, как будто она состоит из трех-четырех дискретных стадий.На самом деле структурные изменения, которые приводят к функциональному белку, происходят непрерывно. Поскольку первичная структура формируется из рибосом, полипептидная цепь претерпевает изменения, пока не будет достигнута окончательная конфигурация. Предложите учащимся представить себе спагетти, которые готовятся в прозрачной кастрюле. Изначально прядь прямая (не обращайте внимания на жесткость в этом примере). Во время приготовления прядь будет сгибаться и скручиваться и (опять же, для этого примера) сворачиваться в свободный шар, состоящий из нити макарон.Полученная прядь имеет особую форму. Спросите учащихся, какие типы химических связей или сил могут влиять на структуру белка. Эти формы определяются положением аминокислот вдоль цепи. Другие силы завершат складывание и сохранят конструкцию.
Предложите учащимся представить себе спагетти, которые готовятся в прозрачной кастрюле. Изначально прядь прямая (не обращайте внимания на жесткость в этом примере). Во время приготовления прядь будет сгибаться и скручиваться и (опять же, для этого примера) сворачиваться в свободный шар, состоящий из нити макарон.Полученная прядь имеет особую форму. Спросите учащихся, какие типы химических связей или сил могут влиять на структуру белка. Эти формы определяются положением аминокислот вдоль цепи. Другие силы завершат складывание и сохранят конструкцию.
Контрольные вопросы по научной практике содержат дополнительные тестовые вопросы для этого раздела, которые помогут вам подготовиться к экзамену AP. Эти вопросы касаются следующих стандартов:
[APLO 1.14] [APLO 2.12] [APLO 4.1] [APLO 4.3][APLO 4.15][APLO 4.22]
Типы и функции белков
Белки являются одними из самых распространенных органических молекул в живых системах и обладают самым разнообразным набором функций среди всех макромолекул. Белки могут быть структурными, регуляторными, сократительными или защитными; они могут служить при транспортировке, хранении или мембранах; или они могут быть токсинами или ферментами. Каждая клетка живой системы может содержать тысячи белков, каждый из которых выполняет уникальную функцию. Их структура, как и их функции, сильно различаются.Однако все они представляют собой полимеры аминокислот, расположенных в линейной последовательности.
Белки могут быть структурными, регуляторными, сократительными или защитными; они могут служить при транспортировке, хранении или мембранах; или они могут быть токсинами или ферментами. Каждая клетка живой системы может содержать тысячи белков, каждый из которых выполняет уникальную функцию. Их структура, как и их функции, сильно различаются.Однако все они представляют собой полимеры аминокислот, расположенных в линейной последовательности.
Ферменты, вырабатываемые живыми клетками, являются катализаторами биохимических реакций (например, пищеварения) и обычно представляют собой сложные или сопряженные белки. Каждый фермент специфичен для субстрата (реагента, который связывается с ферментом), на который он действует. Фермент может помочь в реакциях распада, перегруппировки или синтеза. Ферменты, которые расщепляют свои субстраты, называются катаболическими ферментами, ферменты, которые строят более сложные молекулы из своих субстратов, называются анаболическими ферментами, а ферменты, влияющие на скорость реакции, называются каталитическими ферментами. Следует отметить, что все ферменты увеличивают скорость реакции и поэтому считаются органическими катализаторами. Примером фермента является амилаза слюны, которая гидролизует свой субстрат амилозу, компонент крахмала.
Следует отметить, что все ферменты увеличивают скорость реакции и поэтому считаются органическими катализаторами. Примером фермента является амилаза слюны, которая гидролизует свой субстрат амилозу, компонент крахмала.
Гормоны представляют собой химические сигнальные молекулы, обычно небольшие белки или стероиды, секретируемые эндокринными клетками, которые контролируют или регулируют определенные физиологические процессы, включая рост, развитие, обмен веществ и размножение. Например, инсулин — это белковый гормон, который помогает регулировать уровень глюкозы в крови.Основные типы и функции белков перечислены в таблице 3.1.
Типы и функции белков
| Тип | Примеры | Функции |
|---|---|---|
| пищеварительные ферменты | амилаза, липаза, пепсин, трипсин | . Body |
| Структурные | ||
| ACTIN, TUBULIN, KERATIN | Создание различных конструкций, таких как цитоскелет | |
| Гормоны | ||
| Гормоны | ||
| , Thyroxine | Координация активности различных систем организма | |
| защита | Immunoglobulins | Защита организма от чужеродных патогенов |
| Сократительная | Актин, миозин | Эффект мышечного сокращения |
| Хранение | Белки бобовых, питание раннего развития эмбриона (альбумин) 9 900 рассада 9 0040 |
Таблица 3.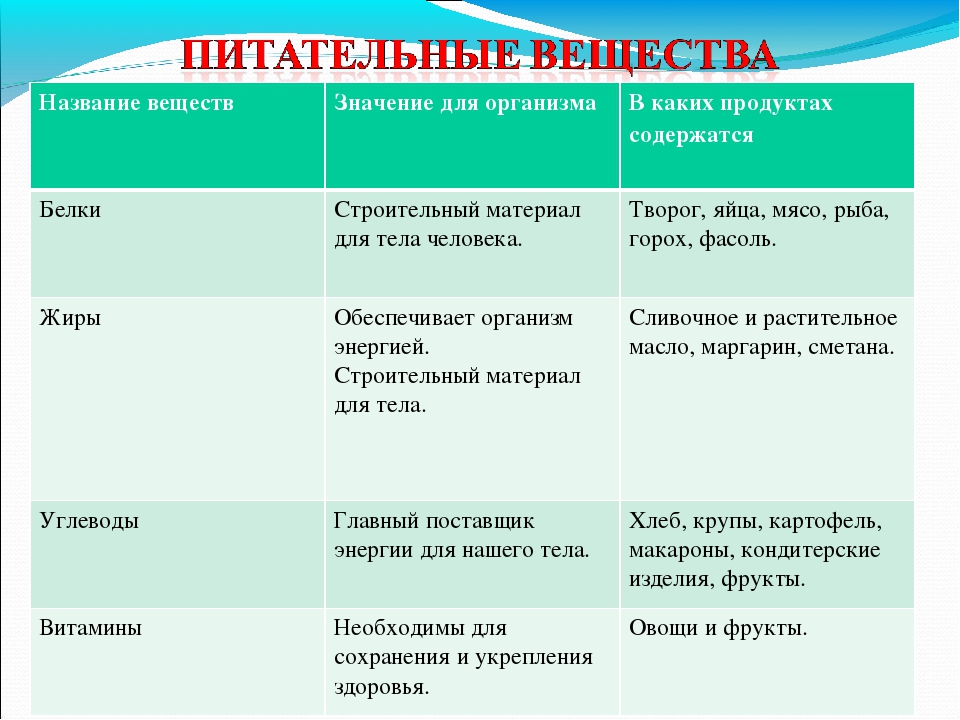 1
1
Белки имеют различную форму и молекулярную массу; некоторые белки имеют глобулярную форму, тогда как другие имеют волокнистую природу. Например, гемоглобин представляет собой глобулярный белок, а коллаген, обнаруженный в нашей коже, представляет собой волокнистый белок. Форма белка имеет решающее значение для его функции, и эта форма поддерживается множеством различных типов химических связей. Изменения температуры, рН и воздействие химических веществ могут привести к необратимым изменениям формы белка, что приведет к потере функции, известной как денатурация.Все белки состоят из различного расположения наиболее распространенных 20 типов аминокислот.
Аминокислоты
Аминокислоты — это мономеры, из которых состоят белки. Каждая аминокислота имеет одинаковую фундаментальную структуру, состоящую из центрального атома углерода, также известного как альфа-углерод ( α ), связанного с аминогруппой (NH 2 ), карбоксильной группой (COOH) и атом водорода. Каждая аминокислота также имеет другой атом или группу атомов, связанных с центральным атомом, известную как группа R (рис. 3.24).
Каждая аминокислота также имеет другой атом или группу атомов, связанных с центральным атомом, известную как группа R (рис. 3.24).
Рис. 3.24 Аминокислоты имеют центральный асимметричный углерод, к которому присоединены аминогруппа, карбоксильная группа, атом водорода и боковая цепь (группа R).
Название «аминокислоты» происходит от того факта, что они содержат как аминогруппу, так и карбоксильную кислотную группу в своей основной структуре. Как уже упоминалось, в белках присутствует 20 распространенных аминокислот. Девять из них считаются незаменимыми аминокислотами для человека, потому что человеческий организм не может их вырабатывать и они поступают с пищей.Для каждой аминокислоты группа R (или боковая цепь) различна (рис. 3.25).
Визуальное соединение
Рис. 3.25 Обычно в белках встречается 20 обычных аминокислот, каждая из которых имеет свою R-группу (вариантную группу), которая определяет ее химическую природу.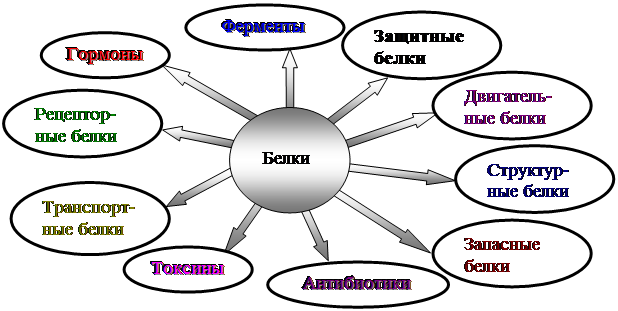
Какие категории аминокислот вы ожидаете найти на поверхности растворимого белка, а какие внутри?
- На поверхности будут обнаружены полярные и заряженные аминокислоты.Неполярные аминокислоты будут найдены внутри.
- Полярные и заряженные аминокислоты будут найдены внутри. Неполярные аминокислоты будут находиться на поверхности.
- Неполярные и незаряженные белки можно найти как на поверхности, так и внутри.
Химическая природа боковой цепи определяет природу аминокислоты (то есть, является ли она кислотной, основной, полярной или неполярной). Например, аминокислота глицин имеет атом водорода в качестве группы R.Аминокислоты, такие как валин, метионин и аланин, являются неполярными или гидрофобными по своей природе, в то время как аминокислоты, такие как серин, треонин и цистеин, являются полярными и имеют гидрофильные боковые цепи.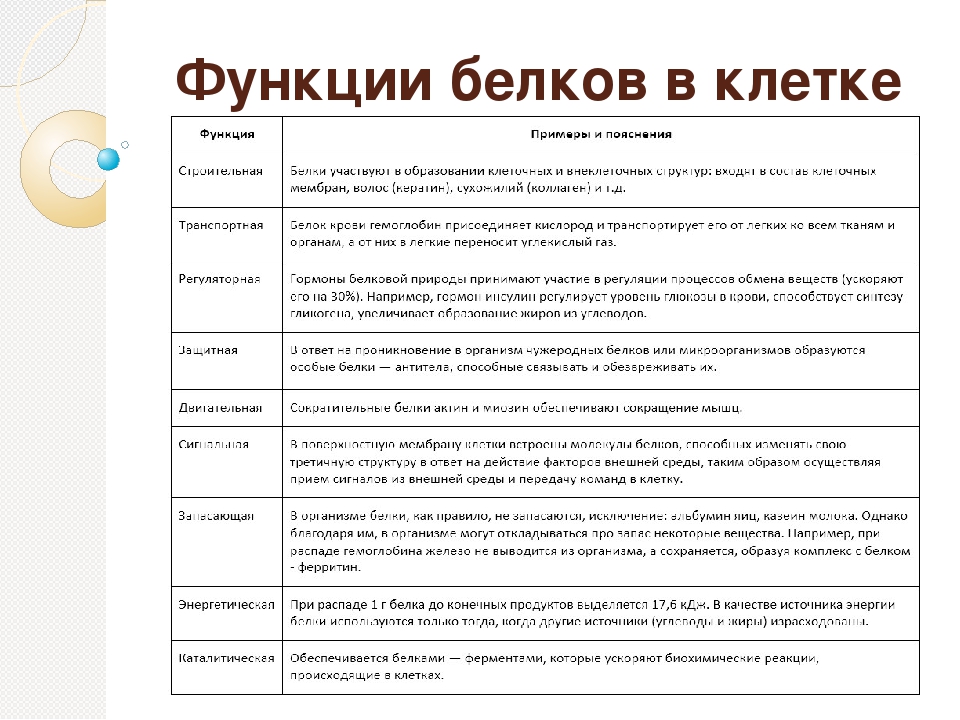 Боковые цепи лизина и аргинина заряжены положительно, поэтому эти аминокислоты также известны как основные аминокислоты. Пролин имеет группу R, которая связана с аминогруппой, образуя кольцеобразную структуру. Пролин является исключением из стандартной структуры аминокислоты, поскольку его аминогруппа не отделена от боковой цепи (рис. 3.25).
Боковые цепи лизина и аргинина заряжены положительно, поэтому эти аминокислоты также известны как основные аминокислоты. Пролин имеет группу R, которая связана с аминогруппой, образуя кольцеобразную структуру. Пролин является исключением из стандартной структуры аминокислоты, поскольку его аминогруппа не отделена от боковой цепи (рис. 3.25).
Аминокислоты обозначаются одной заглавной буквой или трехбуквенной аббревиатурой. Например, валин известен под буквой V или трехбуквенным символом val. Так же, как некоторые жирные кислоты необходимы для диеты, некоторые аминокислоты также необходимы. Они известны как незаменимые аминокислоты, и у человека они включают изолейцин, лейцин и цистеин. Незаменимые аминокислоты относятся к аминокислотам, необходимым для построения белков в организме, хотя и не вырабатываемым организмом; какие аминокислоты являются незаменимыми, варьируется от организма к организму.
Последовательность и количество аминокислот в конечном итоге определяют форму, размер и функцию белка.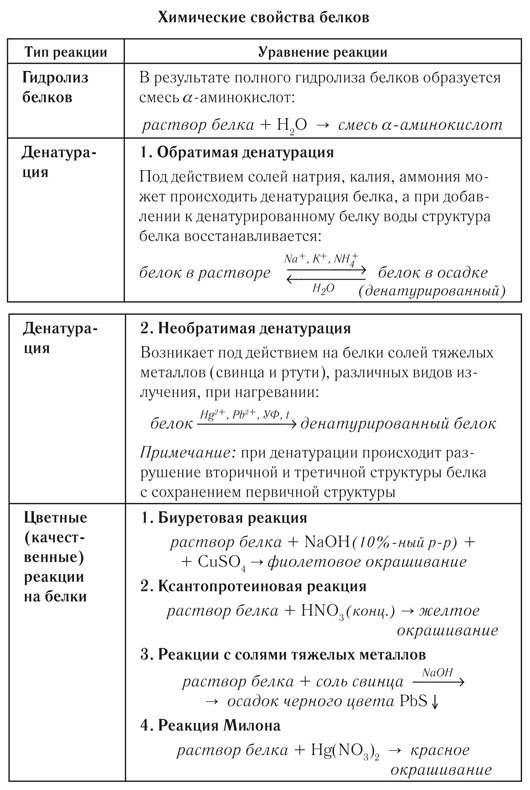 Каждая аминокислота связана с другой аминокислотой ковалентной связью, известной как пептидная связь, которая образуется в результате реакции дегидратации. Карбоксильная группа одной аминокислоты и аминогруппа входящей аминокислоты соединяются, высвобождая молекулу воды. Образовавшаяся связь представляет собой пептидную связь (рис. 3.26).
Каждая аминокислота связана с другой аминокислотой ковалентной связью, известной как пептидная связь, которая образуется в результате реакции дегидратации. Карбоксильная группа одной аминокислоты и аминогруппа входящей аминокислоты соединяются, высвобождая молекулу воды. Образовавшаяся связь представляет собой пептидную связь (рис. 3.26).
Рис. 3.26 Образование пептидной связи является реакцией синтеза дегидратации.Карбоксильная группа одной аминокислоты связана с аминогруппой входящей аминокислоты. При этом высвобождается молекула воды.
Продукты, образованные такими связями, называются пептидами. По мере того, как к этой растущей цепи присоединяется все больше аминокислот, получающаяся в результате цепь известна как полипептид. Каждый полипептид имеет свободную аминогруппу на одном конце. Этот конец называется N-концом или амино-концом, а другой конец имеет свободную карбоксильную группу, также известную как C или карбоксильный конец.Хотя термины «полипептид» и «белок» иногда используются взаимозаменяемо, полипептид технически представляет собой полимер аминокислот, тогда как термин «белок» используется для полипептида или полипептидов, которые объединены вместе, часто имеют связанные непептидные простетические группы, имеют четкую форму.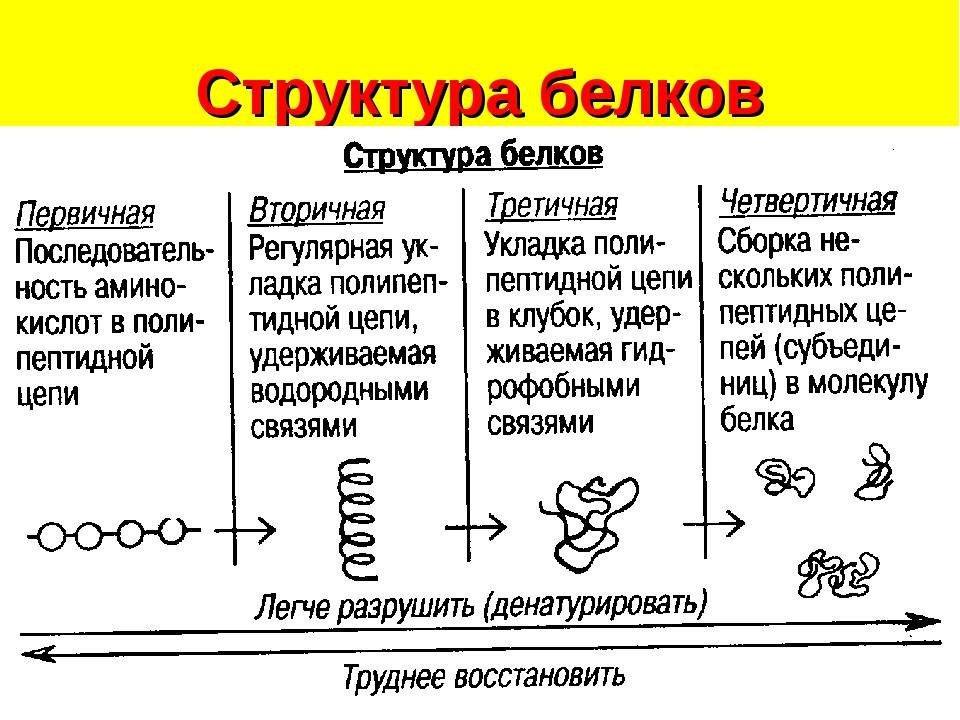 , и имеют уникальную функцию. После синтеза белка (трансляции) большинство белков модифицируются. Они известны как посттрансляционные модификации. Они могут подвергаться расщеплению или фосфорилированию или могут потребовать добавления других химических групп.Только после этих модификаций белок становится полностью функциональным.
, и имеют уникальную функцию. После синтеза белка (трансляции) большинство белков модифицируются. Они известны как посттрансляционные модификации. Они могут подвергаться расщеплению или фосфорилированию или могут потребовать добавления других химических групп.Только после этих модификаций белок становится полностью функциональным.
Ссылка на обучение
Просмотрите этапы синтеза белка в этом интерактивном руководстве.
Почему процесс синтеза белка имеет решающее значение для жизни?
- Белок является предпочтительным источником энергии для быстрого производства энергии.
- Белок хранится в печени и мышцах для обеспечения энергией для будущего использования.
- Белок необходим для образования тканей и входит в состав гормонов и ферментов.
- Белки необходимы для усвоения всех жирорастворимых витаминов.

Evolution Connection
Цитохром с является важным компонентом цепи переноса электронов, частью клеточного дыхания, и обычно он находится в клеточных органеллах, митохондриях. Этот белок имеет простетическую группу гема, и центральный ион гема попеременно восстанавливается и окисляется при переносе электрона. Поскольку роль этого незаменимого белка в производстве клеточной энергии имеет решающее значение, она очень мало изменилась за миллионы лет.Секвенирование белка показало, что у разных видов существует значительная степень гомологии аминокислотной последовательности цитохрома с; другими словами, эволюционное родство можно оценить, измерив сходство или различие последовательностей ДНК или белков различных видов.
Ученые определили, что цитохром с человека содержит 104 аминокислоты. Для каждой молекулы цитохрома с из разных организмов, которая была секвенирована на сегодняшний день, 37 из этих аминокислот появляются в одном и том же положении во всех образцах цитохрома с.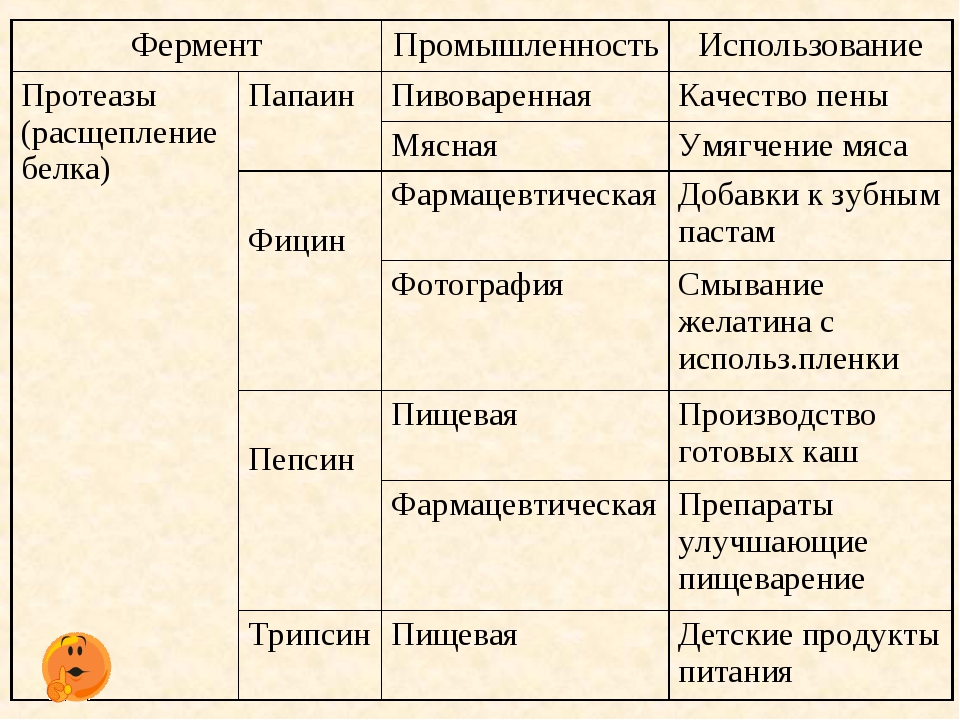 Это указывает на то, что у них мог быть общий предок. При сравнении последовательностей белков человека и шимпанзе различий в последовательностях обнаружено не было. Когда сравнивали последовательности человека и макаки-резуса, единственное обнаруженное различие заключалось в одной аминокислоте. В другом сравнении секвенирование человека и дрожжей показывает разницу в 44-м положении.
Это указывает на то, что у них мог быть общий предок. При сравнении последовательностей белков человека и шимпанзе различий в последовательностях обнаружено не было. Когда сравнивали последовательности человека и макаки-резуса, единственное обнаруженное различие заключалось в одной аминокислоте. В другом сравнении секвенирование человека и дрожжей показывает разницу в 44-м положении.
Белковая последовательность цитохрома с шимпанзе и человека идентична. Белковая последовательность цитохрома с макак-резус отличается от последовательности человека на одну аминокислоту.О чем говорят эти сравнения?
- Макаки-резусы более тесно связаны с людьми, чем шимпанзе.
- Шимпанзе более тесно связаны с макаками-резусами, чем с людьми.
- Люди связаны с шимпанзе, но не с макаками-резусами.
- Шимпанзе более тесно связаны с людьми, чем макаки-резусы.

Белковая структура
Как обсуждалось ранее, форма белка имеет решающее значение для его функции.Например, фермент может связываться со специфическим субстратом в месте, известном как активный центр. Если этот активный центр изменен из-за локальных изменений или изменений в общей структуре белка, фермент может быть неспособен связываться с субстратом. Чтобы понять, как белок приобретает свою окончательную форму или конформацию, нам необходимо понять четыре уровня структуры белка: первичный, вторичный, третичный и четвертичный.
Основная структура
Уникальная последовательность аминокислот в полипептидной цепи является ее первичной структурой.Например, гормон поджелудочной железы инсулин имеет две полипептидные цепи, А и В, и они связаны друг с другом дисульфидными связями. N-концевой аминокислотой А-цепи является глицин, тогда как С-концевой аминокислотой является аспарагин (рис. 3.27). Последовательности аминокислот в цепях А и В уникальны для инсулина.
Рис. 3.27 Инсулин бычьей сыворотки представляет собой белковый гормон, состоящий из двух пептидных цепей: А (длиной 21 аминокислота) и В (длиной 30 аминокислот). В каждой цепи первичная структура обозначается трехбуквенными аббревиатурами, представляющими названия аминокислот в том порядке, в котором они присутствуют.Аминокислота цистеин (цис) имеет сульфгидрильную (SH) группу в качестве боковой цепи. Две сульфгидрильные группы могут реагировать в присутствии кислорода с образованием дисульфидной (S-S) связи. Две дисульфидные связи соединяют цепи А и В вместе, а третья помогает цепи А принять правильную форму. Обратите внимание, что все дисульфидные связи имеют одинаковую длину, но для ясности нарисованы разными размерами.
Уникальная последовательность каждого белка в конечном счете определяется геном, кодирующим белок. Изменение нуклеотидной последовательности кодирующей области гена может привести к добавлению другой аминокислоты к растущей полипептидной цепи, вызывая изменение структуры и функции белка. При серповидноклеточной анемии цепь гемоглобина β (небольшая часть которой показана на рис. 3.28) имеет единственную аминокислотную замену, вызывающую изменение структуры и функции белка. В частности, аминокислота глутаминовая кислота заменена валином в цепи β . Что наиболее примечательно, так это то, что молекула гемоглобина состоит из двух альфа-цепей и двух бета-цепей, каждая из которых состоит примерно из 150 аминокислот. Молекула, следовательно, имеет около 600 аминокислот.Структурное различие между молекулой нормального гемоглобина и молекулой серповидноклеточной клетки, которая резко сокращает продолжительность жизни, заключается в одной аминокислоте из 600. Еще более примечательно то, что эти 600 аминокислот кодируются тремя нуклеотидами каждая, и мутация вызывается изменением одного основания (точечная мутация), 1 на 1800 оснований.
При серповидноклеточной анемии цепь гемоглобина β (небольшая часть которой показана на рис. 3.28) имеет единственную аминокислотную замену, вызывающую изменение структуры и функции белка. В частности, аминокислота глутаминовая кислота заменена валином в цепи β . Что наиболее примечательно, так это то, что молекула гемоглобина состоит из двух альфа-цепей и двух бета-цепей, каждая из которых состоит примерно из 150 аминокислот. Молекула, следовательно, имеет около 600 аминокислот.Структурное различие между молекулой нормального гемоглобина и молекулой серповидноклеточной клетки, которая резко сокращает продолжительность жизни, заключается в одной аминокислоте из 600. Еще более примечательно то, что эти 600 аминокислот кодируются тремя нуклеотидами каждая, и мутация вызывается изменением одного основания (точечная мутация), 1 на 1800 оснований.
Рис. 3.28 Бета-цепь гемоглобина состоит из 147 остатков, но одна аминокислотная замена приводит к серповидноклеточной анемии. В нормальном гемоглобине аминокислотой в седьмом положении является глутамат. В серповидноклеточном гемоглобине этот глутамат заменен валином.
В нормальном гемоглобине аминокислотой в седьмом положении является глутамат. В серповидноклеточном гемоглобине этот глутамат заменен валином.
Из-за этого изменения одной аминокислоты в цепи молекулы гемоглобина образуют длинные волокна, которые деформируют двояковогнутые или дискообразные эритроциты и заставляют их принимать серповидную или «серповидную» форму, что закупоривает кровеносные сосуды ( Рисунок 3.29). Это может привести к множеству серьезных проблем со здоровьем, таких как одышка, головокружение, головные боли и боли в животе у тех, кто страдает этим заболеванием.
Рис. 3.29 В этом мазке крови, визуализированном при 535-кратном увеличении с использованием светлопольной микроскопии, серповидные клетки имеют форму полумесяца, а нормальные клетки имеют форму диска. (кредит: модификация работы Эда Утмана; данные масштабной линейки от Мэтта Рассела)
Вторичная структура
Локальная укладка полипептида в некоторых областях приводит к возникновению вторичной структуры белка. Наиболее распространенными являются α -спиральные и β -складчатые листовые структуры (рис. 3.30). Обе структуры удерживаются вместе водородными связями. В структуре α -спирали водородные связи образуются между атомом кислорода в карбонильной группе одной аминокислоты и другой аминокислотой, которая находится на четыре аминокислоты дальше по цепи.
Наиболее распространенными являются α -спиральные и β -складчатые листовые структуры (рис. 3.30). Обе структуры удерживаются вместе водородными связями. В структуре α -спирали водородные связи образуются между атомом кислорода в карбонильной группе одной аминокислоты и другой аминокислотой, которая находится на четыре аминокислоты дальше по цепи.
Рисунок 3.30. Спираль α и складчатый лист β представляют собой вторичные структуры белков, которые образуются из-за водородных связей между карбонильными и аминогруппами в пептидном остове. Некоторые аминокислоты имеют склонность к образованию спирали α , в то время как другие имеют склонность к образованию складчатого листа β .
Каждый спиральный виток в альфа-спирали состоит из 3,6 аминокислотных остатков. Группы R (вариантные группы) полипептида выступают из цепи α -спирали. В складчатом листе β «складки» образованы водородными связями между атомами на основной цепи полипептидной цепи. Группы R присоединены к атомам углерода и простираются выше и ниже складок складки. Складчатые сегменты располагаются параллельно или антипараллельно друг другу, а водородные связи образуются между частично положительным атомом водорода в аминогруппе и частично отрицательным атомом кислорода в карбонильной группе пептидного остова.Структуры α -спирали и β -складчатые листы обнаруживаются в большинстве глобулярных и волокнистых белков и играют важную структурную роль.
Группы R (вариантные группы) полипептида выступают из цепи α -спирали. В складчатом листе β «складки» образованы водородными связями между атомами на основной цепи полипептидной цепи. Группы R присоединены к атомам углерода и простираются выше и ниже складок складки. Складчатые сегменты располагаются параллельно или антипараллельно друг другу, а водородные связи образуются между частично положительным атомом водорода в аминогруппе и частично отрицательным атомом кислорода в карбонильной группе пептидного остова.Структуры α -спирали и β -складчатые листы обнаруживаются в большинстве глобулярных и волокнистых белков и играют важную структурную роль.
Третичная структура
Уникальной трехмерной структурой полипептида является его третичная структура (рис. 3.31). Эта структура частично обусловлена химическими взаимодействиями в полипептидной цепи. Прежде всего, взаимодействия между группами R создают сложную трехмерную третичную структуру белка.Природа групп R, обнаруженных в вовлеченных аминокислотах, может противодействовать образованию водородных связей, описанных для стандартных вторичных структур. Например, группы R с одинаковыми зарядами отталкиваются друг от друга, а группы с разными зарядами притягиваются друг к другу (ионные связи). При сворачивании белка гидрофобные R-группы неполярных аминокислот находятся внутри белка, а гидрофильные R-группы — снаружи. Первые типы взаимодействий также известны как гидрофобные взаимодействия.Взаимодействие между боковыми цепями цистеина образует дисульфидные связи в присутствии кислорода, единственная ковалентная связь, образующаяся при сворачивании белка.
Прежде всего, взаимодействия между группами R создают сложную трехмерную третичную структуру белка.Природа групп R, обнаруженных в вовлеченных аминокислотах, может противодействовать образованию водородных связей, описанных для стандартных вторичных структур. Например, группы R с одинаковыми зарядами отталкиваются друг от друга, а группы с разными зарядами притягиваются друг к другу (ионные связи). При сворачивании белка гидрофобные R-группы неполярных аминокислот находятся внутри белка, а гидрофильные R-группы — снаружи. Первые типы взаимодействий также известны как гидрофобные взаимодействия.Взаимодействие между боковыми цепями цистеина образует дисульфидные связи в присутствии кислорода, единственная ковалентная связь, образующаяся при сворачивании белка.
Рис. 3.31 Третичная структура белков определяется множеством химических взаимодействий. К ним относятся гидрофобные взаимодействия, ионная связь, водородная связь и дисульфидные связи.
Все эти взаимодействия, слабые и сильные, определяют окончательную трехмерную форму белка.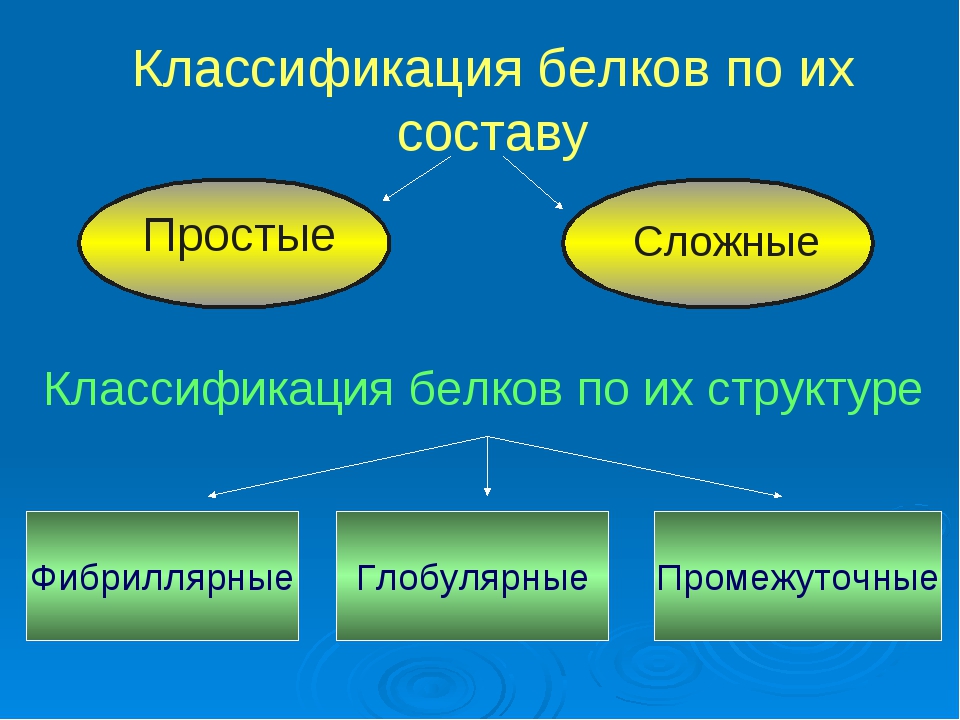 Когда белок теряет свою трехмерную форму, он может больше не функционировать.
Когда белок теряет свою трехмерную форму, он может больше не функционировать.
Четвертичная структура
В природе некоторые белки образуются из нескольких полипептидов, также известных как субъединицы, и взаимодействие этих субъединиц образует четвертичную структуру. Слабые взаимодействия между субъединицами помогают стабилизировать общую структуру. Например, инсулин (глобулярный белок) имеет комбинацию водородных и дисульфидных связей, которые заставляют его в основном слипаться в шарообразную форму. Инсулин начинается как один полипептид и теряет некоторые внутренние последовательности в присутствии посттрансляционной модификации после образования дисульфидных связей, которые удерживают вместе оставшиеся цепи.Шелк (волокнистый белок), однако, имеет β складчатую листовую структуру, которая является результатом водородных связей между различными цепями.
Четыре уровня структуры белка (первичный, вторичный, третичный и четвертичный) показаны на рис.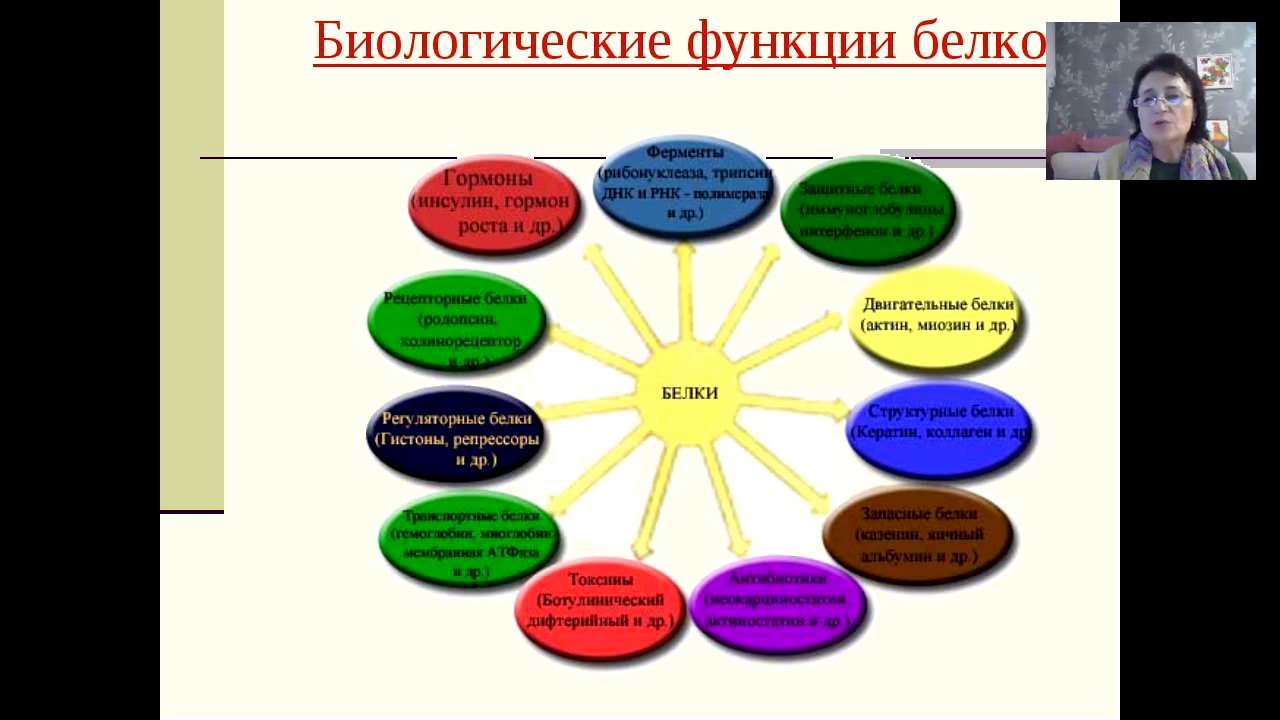 3.32.
3.32.
Рисунок 3.32 На этих иллюстрациях можно наблюдать четыре уровня структуры белка. (кредит: модификация работы Национального института исследования генома человека)
Денатурация и сворачивание белков
Каждый белок имеет свою уникальную последовательность и форму, которые удерживаются вместе за счет химических взаимодействий.Если белок подвергается изменениям температуры, изменениям pH или воздействию химических веществ, структура белка может измениться, потеряв свою форму без потери своей первичной последовательности в результате так называемой денатурации. Денатурация часто бывает обратимой, потому что первичная структура полипептида сохраняется в процессе, если денатурирующий агент удаляется, что позволяет белку возобновить свою функцию. Иногда денатурация необратима и приводит к потере функции. Одним из примеров необратимой денатурации белка является жарка яиц.Белок альбумин в жидком яичном белке денатурирует, когда его помещают на горячую сковороду. Не все белки денатурируют при высоких температурах; например, бактерии, которые выживают в горячих источниках, имеют белки, функционирующие при температурах, близких к температуре кипения. Желудок также очень кислый, имеет низкий pH и денатурирует белки в процессе пищеварения; однако пищеварительные ферменты желудка в этих условиях сохраняют свою активность.
Не все белки денатурируют при высоких температурах; например, бактерии, которые выживают в горячих источниках, имеют белки, функционирующие при температурах, близких к температуре кипения. Желудок также очень кислый, имеет низкий pH и денатурирует белки в процессе пищеварения; однако пищеварительные ферменты желудка в этих условиях сохраняют свою активность.
Сворачивание белка имеет решающее значение для его функции.Первоначально считалось, что сами белки ответственны за процесс фолдинга. Только недавно было обнаружено, что часто они получают помощь в процессе фолдинга от белков-помощников, известных как шапероны (или шаперонины), которые связываются с белком-мишенью во время процесса фолдинга. Они действуют, предотвращая агрегацию полипептидов, составляющих полную структуру белка, и диссоциируют от белка, как только целевой белок свернут.
Ссылка на обучение
Чтобы получить дополнительную информацию о белках, просмотрите анимацию под названием «Биомолекулы: белки.
Веганы — это люди, не употребляющие в своем рационе продукты животного происхождения. Почему веганам нужно уделять особое внимание белку, который они едят?
- Растительные белки содержат как незаменимые, так и заменимые аминокислоты.
- Труднее получить все незаменимые аминокислоты из одного растительного источника.
- Растительные белки содержат только заменимые аминокислоты.
- Белки растений не содержат всех заменимых аминокислот, но содержат незаменимые аминокислоты.
Соединение с научной практикой для курсов AP®
Подумай об этом
- Предскажите, что произойдет, если хотя бы одна аминокислота будет заменена другой в полипептиде, и приведите конкретный пример.
- Какие категории аминокислот вы ожидаете найти на поверхности растворимого белка и какие вы ожидаете найти внутри? Какое распределение аминокислот вы ожидаете найти в белке, встроенном в двойной липидный слой плазматической клеточной мембраны?
Деятельность
Сворачивание — важное свойство белков, особенно ферментов.Белки имеют узкий диапазон условий, в которых они правильно складываются; за пределами этого диапазона белки могут разворачиваться (денатурировать) и часто не могут повторно складываться и снова становиться функциональными. Исследуйте одно заболевание, возникающее в результате неправильного сворачивания белка. Опишите причины развития и последствия для молекулярной структуры полипептида, которые приводят к заболеванию.
Поддержка учителей
Первый вопрос «Подумай об этом» представляет собой применение задачи обучения 4.3 и научной практики 6.1 и 6.4, потому что учащиеся предсказывают, как изменение субкомпонентов молекулы может повлиять на свойства молекулы.
Второй вопрос «Подумайте об этом» является приложением цели обучения 4.2 и научной практики 1.3, поскольку учащиеся используют представления о молекулах вместе с моделью клеточной мембраны для описания того, как молекулярная структура аминокислот определяет их расположение в белке или другом веществе. структуру, такую как бислой фосфолипидов.
Упражнение является приложением цели обучения 4.1 и научная практика 7.1, цель обучения 4.2 и научная практика 1.3, а также цель обучения 4.3 и научная практика 6.1 и 6.4, потому что учащихся просят объяснить, как факторы окружающей среды могут изменить молекулярную структуру белка и как это изменение может привести к изменению в функции, т. е. болезни.
Набор задач о больших молекулах Задача 3: Третичная структура белка Третичная структура белка относится к:
Учебник
Биологический проект http://www.biology.arizona.edu | |
Глава 2: Структура белка – Химия
Глава 2: Структура белка
2.1 Структура и свойства аминокислот
2.2 Формирование пептидной связи и первичная структура белка
2.3 Вторичная структура белка
2.4 Супервторичная структура и белковые мотивы
2.5 Третичная и четвертичная структура белка
2.6 Сворачивание, денатурация и гидролиз белков
2.7 Каталожные номера
2.1 Структура и свойства аминокислот
Белки являются одними из самых распространенных органических молекул в живых системах и обладают самым разнообразным набором функций среди всех макромолекул.Белки могут быть структурными, регуляторными, сократительными или защитными; они могут служить при транспортировке, хранении или мембранах; или они могут быть токсинами или ферментами. Каждая клетка в живой системе может содержать тысячи различных белков, каждый из которых выполняет уникальную функцию. Их структура, как и их функции, сильно различаются. Однако все они представляют собой полимеры альфа-аминокислот, расположенных в линейной последовательности и соединенных друг с другом ковалентными связями.
Структура альфа-аминокислоты
Основные строительные блоки белков называются альфа (α) аминокислотами .Как следует из их названия, они содержат функциональную группу карбоновой кислоты и функциональную группу амина. Обозначение альфа используется для обозначения того, что эти две функциональные группы отделены друг от друга одной углеродной группой. В дополнение к амину и карбоновой кислоте альфа-углерод также присоединен к водороду и одной дополнительной группе, которая может различаться по размеру и длине. На схеме ниже эта группа обозначена как R-группа. В живых организмах в качестве строительных блоков белков используются 20 аминокислот.Они отличаются друг от друга только положением R-группы. Базовая структура аминокислоты показана ниже:
Рисунок 2.1 Общая структура альфа-аминокислоты
В состав белков обычно входят 20 альфа-аминокислот (рис. 2.x). Различные R-группы имеют разные характеристики в зависимости от природы атомов, включенных в функциональные группы. Существуют R-группы, которые преимущественно содержат углерод и водород и являются очень неполярными или гидрофобными.Другие содержат полярные незаряженные функциональные группы, такие как спирты, амиды и тиолы. Некоторые аминокислоты являются основными (содержат функциональные группы амина) или кислотными (содержат функциональные группы карбоновой кислоты). Эти аминокислоты способны образовывать полные заряды и могут иметь ионные взаимодействия. Каждая аминокислота может быть сокращена с использованием трехбуквенного и однобуквенного кода.
Рис. 2.2 Структура 20 альфа-аминокислот, используемых в синтезе белка. R-группы обозначены обведенной/закрашенной частью каждой молекулы. Цвета обозначают определенные классы аминокислот: гидрофобные — зеленый и желтый, гидрофильные полярные незаряженные — оранжевые, гидрофильные кислотные — синие, гидрофильные основные — розовые.
Нажмите здесь, чтобы загрузить версию таблицы аминокислот
Неполярные (гидрофобные) аминокислоты
Неполярные аминокислоты в основном можно разделить на два более конкретных класса: алифатические аминокислоты и ароматические аминокислоты.Алифатические аминокислоты (глицин, аланин, валин, лейцин, изолейцин и пролин) обычно содержат разветвленные углеводородные цепи, самые простые из которых представляют собой глицин, а более сложные структуры — лейцин и валин. Пролин также классифицируется как алифатическая аминокислота, но обладает особыми свойствами, поскольку углеводородная цепь зациклена с концевым амином, создавая уникальную 5-членную кольцевую структуру. Как мы увидим в следующем разделе, посвященном первичной структуре, пролин может значительно изменить трехмерную структуру из-за структурной жесткости кольцевой структуры, когда он включен в полипептидную цепь, и обычно обнаруживается в областях белка, где возникают складки или повороты.
Ароматические аминокислоты (фенилаланин, тирозин и триптофан), , как следует из их названия, содержат ароматические функциональные группы в своей структуре, что делает их в значительной степени неполярными и гидрофобными из-за высокого содержания углерода/водорода. Однако следует отметить, что гидрофобность и гидрофильность представляют собой скользящую шкалу, и каждая из различных аминокислот может иметь различные физические и химические свойства в зависимости от их структуры. Например, гидроксильная группа, присутствующая в тирозине, повышает его реакционную способность и растворимость по сравнению с фенилаланином.
Метионин, одна из серосодержащих аминокислот , обычно классифицируется как неполярная гидрофобная аминокислота, поскольку концевая метильная группа образует тиоэфирную функциональную группу, которая обычно не может образовывать постоянный диполь внутри молекулы и сохраняет низкую растворимость.
Полярные (гидрофильные) аминокислоты
Полярные гидрофильные аминокислоты можно разделить на три основных класса: полярные незаряженные, кислотные и основные функциональные группы.В пределах класса полярных незаряженных атомов боковые цепи содержат гетероатомы (O, S или N), которые способны образовывать постоянные диполи в R-группе. К ним относятся гидроксил- и сульфоксилсодержащие аминокислоты, серин, треонин и цистеин и амидосодержащие аминокислоты, глутамин и аспаригин. Две аминокислоты, глутаминовая кислота (глутамат) и аспарагиновая кислота (аспартат), составляют кислые аминокислоты и содержат боковые цепи с функциональными группами карбоновой кислоты, способными полностью ионизироваться в растворе.Основные аминокислоты , лизин, аргинин и гистидин содержат функциональные группы амина, которые могут быть протонированы для получения полного заряда.
Многие аминокислоты с гидрофильными R-группами могут участвовать в активном центре ферментов. Активный центр представляет собой часть фермента, которая непосредственно связывается с субстратом и осуществляет реакцию. Белковые ферменты содержат каталитических групп , состоящих из R-групп аминокислот, которые способствуют образованию и разрушению связей.Аминокислоты, играющие значительную роль в специфичности связывания активного сайта, обычно не соседствуют друг с другом в первичной структуре, а образуют активный сайт в результате сворачивания при создании третичной структуры, как вы увидите далее в глава.
Белковые структуры, построенные из основных аминокислот, могут состоять из сотен аминокислот. Таким образом, для простоты 20 аминокислот, используемых для синтеза белка, имеют как трехбуквенные, так и однобуквенные кодовые аббревиатуры (таблица 2.1). Эти сокращения обычно используются для описания белковых последовательностей в биоинформатических и исследовательских целях.
Таблица 2.1 Аббревиатуры α-аминокислот
Мысль Вопрос: Триптофан содержит функциональную группу амина, почему триптофан не является основным?
Ответ: Триптофан имеет структуру индольного кольца, включающую функциональную группу амина. Однако из-за близости структуры ароматического кольца и электроноакцепторной природы неподеленная пара электронов на атоме азота не может принять протон.Вместо этого они участвуют в формировании связей пи- внутри нескольких различных резонансных структур, возможных для индольного кольца. На рис. 2.3А показаны четыре возможные резонансные структуры индола. И наоборот, в иммидазольной кольцевой структуре гистидина есть два атома азота, один из которых участвует в формировании резонансных структур (азот №1 на рис. 2.3Б) и не может принимать протон, а другой (азот №3 ), у которого есть неподеленная пара электронов, которая может принять протон.
Рисунок 2.3 Сравнение структурной доступности неподеленной пары электронов на азоте для принятия протона в структурах индольного и иммидизольного колец . (A) Показаны четыре резонансные структуры индольного кольца, демонстрирующие, что неподеленная пара электронов на атоме азота участвует в образовании пи -связей. (B) Иммидазольная кольцевая структура имеет один атом азота (1), который участвует в резонансных структурах (не показаны) и не может принимать протон, в то время как второй атом азота (3) имеет неподеленную пару электронов, доступную для приема протона. как показано.
Работайте самостоятельно:
Используя приведенный выше пример, объясните, используя химическую схему, почему амидные атомы азота, содержащиеся в аспарагине и глутамине, не являются основными.
Альфа-аминокислоты представляют собой хиральные молекулы
Если вы изучите структуру альфа-углерода в каждой из аминокислот, вы заметите, что все аминокислоты, кроме глицина, являются хиральными молекулами (рис. 2.4) Хиральная молекула не совмещается со своим зеркальным отражением. Как левая и правая руки, в которых большой палец расположен в одном порядке, но являются зеркальными отражениями, а не одинаковыми, к хиральным молекулам присоединены одни и те же элементы в том же порядке, но они являются зеркальными отражениями, а не одним и тем же. Версии зеркального отображения хиральных молекул обладают физическими свойствами, которые почти идентичны друг другу, что делает очень трудным отличить их друг от друга или разделить.Из-за этой природы им дается специальное название стереоизомера, называемое энантиомеров , и фактически сами соединения имеют такое же название! Эти молекулы отличаются тем, как они вращают простой поляризованный свет, и тем, как они реагируют и взаимодействуют с биологическими молекулами. Молекулы, вращающие свет в правом направлении, называются правовращающими и обозначаются буквой D. Молекулы, которые вращают свет в левом направлении, называются левовращающими и обозначаются буквой L, чтобы отличить один энантиомер от другого.D- и L-формы аланина показаны на рис. 2.4B.
Хотя большинство аминокислот могут существовать как в левовращающих, так и в правовращающих формах, жизнь на Земле состоит почти исключительно из левовращающих аминокислот. Протеогенные аминокислоты, включаемые в белки рибосомами, всегда находятся в L-конформации. Некоторые бактерии могут включать D-аминокислоты в пептиды, не кодируемые рибосомами, но использование D-аминокислот в природе встречается редко. Интересно, что когда мы будем обсуждать структуру сахаров в главе XX, мы обнаружим, что сахара, входящие в состав углеводов, почти всегда находятся в D-конформации.Никто не знает, почему это так. Тем не менее, доктора. Джон Кронин и Сандра Пиццарелло показали, что из аминокислот, падающих на Землю из космоса на метеоритах, больше L-конформации, чем D-конформации. Таким образом, тот факт, что мы состоим преимущественно из L-аминокислот, может быть результатом аминокислот из космоса.
Почему аминокислоты в космосе предпочитают L-конформацию? Никто точно не знает, но известно, что излучение также может существовать в лево- и правосторонней формах. Итак, существует теория, называемая гипотезой Боннера , которая предполагает, что преобладающие формы излучения в космосе (т.например, от вращающейся нейтронной звезды) может привести к селективному образованию гомохиральных молекул, таких как L-аминокислоты и D-сахара. Это все еще спекулятивно, но недавние находки метеоритов делают эту гипотезу гораздо более правдоподобной.
Рис. 2.4 Хиральность аминокислот. За исключением простейшей аминокислоты, глицина, все остальные аминокислоты, входящие в состав белковых структур, являются хиральными по своей природе. (A) Демонстрирует хиральность основной альфа-аминокислотной структуры при использовании неспецифической R-группы.(B) Пара энантиомеров D- и L-аланина, верхняя диаграмма представляет модель шара и палочки, а нижняя диаграмма представляет линейную структуру.
Изображение (A) из НАСА
Обратите внимание, что D- и L-обозначения являются специальными терминами, используемыми для обозначения того, как молекула вращает простой поляризованный свет. Он не обозначает абсолютную стереоконфигурацию молекулы. Абсолютная конфигурация относится к пространственному расположению атомов хирального молекулярного образования (или группы) и его стереохимическому описанию, например.г. R или S , ссылаясь на Rectus или Sinister соответственно.
Абсолютные конфигурации хиральной молекулы (в чистом виде) чаще всего получают с помощью рентгеновской кристаллографии. Альтернативными методами являются оптическая вращательная дисперсия, колебательный круговой дихроизм, использование реагентов хирального сдвига в протонном ЯМР и визуализации кулоновского взрыва. Когда получена абсолютная конфигурация, назначение R или S основано на правилах приоритета Кана-Ингольда-Прелога, , которые можно просмотреть, перейдя по ссылке и на рисунке 2.5. Все хиральные аминокислоты, кроме цистеина, также находятся в S-конформации. Цистеин содержит атом серы, из-за чего R-группа имеет более высокий приоритет, чем функциональная группа карбоновой кислоты, что приводит к R-конформации для абсолютной стереохимии. Однако цистеин вращает простой поляризованный свет в левовращающем или левостороннем направлении. Таким образом, R- и S-обозначения не всегда соответствуют D- и L-конформации.
Рис. 2.5 Абсолютная конфигурация определяется обозначениями Rectus (R) и Sinister (S). В системе Cahn Ingold Prelog для наименования хиральных центров группы, присоединенные к хиральному центру, ранжируются в соответствии с их атомным номером, при этом наивысший атомный номер получает наивысший приоритет (A на диаграмме выше), а самый низкий атомный номер получает самый низкий приоритет. приоритет (D на схеме выше). Затем самый низкий приоритет отводится от зрителя, чтобы правильно сориентировать молекулу для дальнейшей оценки.Затем отслеживается путь приоритетов № 1, № 2 и № 3 (соответствующих A, B и C выше). Если путь идет по часовой стрелке, хиральному центру присваивается R-обозначение, тогда как если путь идет против часовой стрелки, ему присваивается S-обозначение.
Изображение из Википедия
Аминокислоты представляют собой цвиттерионы
В химии цвиттер-ион представляет собой молекулу с двумя или более функциональными группами, из которых по крайней мере одна имеет положительный, а одна — отрицательный электрический заряд, а суммарный заряд всей молекулы равен нулю при определенном рН.Поскольку они содержат по крайней мере один положительный и один отрицательный заряд, цвиттерионы также иногда называют внутренними солями . 90–104 Заряды различных функциональных групп уравновешивают друг друга, и молекула в целом может быть электрически нейтральной при определенном рН. pH, при котором это происходит, известен как изоэлектрическая точка .
В отличие от простых амфотерных соединений, которые могут образовывать только либо катионные, либо анионные частицы, цвиттер-ион одновременно имеет оба ионных состояния.Аминокислоты являются примерами цвиттер-ионов (рис. 2.6). Эти соединения содержат аммониевую и карбоксилатную группу, и их можно рассматривать как возникающие в результате своего рода внутримолекулярной кислотно-основной реакции: аминогруппа депротонирует карбоновую кислоту.
Рисунок 2.6 Аминокислоты представляют собой цвиттерионы. Аминокислота содержит как кислотные (фрагмент карбоновой кислоты), так и основные (фрагмент амина) центры. Изомер справа представляет собой цвиттерионную форму.
Поскольку аминокислоты являются цвиттер-ионами, а некоторые из них также обладают потенциалом ионизации в своих R-группах, их зарядовое состояние in vivo и, таким образом, их реакционная способность может варьироваться в зависимости от pH, температуры и состояния сольватации локальной микросреде, в которой они находятся.Таблица стандартных значений pK a для аминокислот показана в Таблице 2.1 и может использоваться для прогнозирования состояния ионизации/заряда аминокислот и полученных из них пептидов/белков. Однако следует отметить, что статус сольватации в микроокружении аминокислоты может изменить относительные значения этих функциональных групп и обеспечить уникальные реакционные свойства в пределах активных центров ферментов (таблица 2.1). Более подробное обсуждение эффектов десольватации будет дано в главе XX, посвященной механизмам ферментативных реакций.
Таблица 2.1
Версия для печати значений pKa
Как видно из таблицы 2.1, семь аминокислот содержат R-группы с ионизируемыми боковыми цепями и обычно находятся в активных центрах ферментов. Напомним, что pK a определяется как рН, при котором ионизированная и неионизированная формы ионизируемой функциональной группы в молекуле существуют в равных концентрациях. Таким образом, когда функциональная группа сдвигается выше или ниже своего значения pK или , будет происходить сдвиг в концентрациях ионизированных и неионизированных форм в пользу одного состояния по сравнению с другим.На рис. 2.7 показаны различные R-группы в их ионизированных и ионизированных состояниях, а также их предпочтительные состояния выше или ниже значения pK a .
Рис. 2.7 Ионизируемые функциональные группы в обычных аминокислотах. Во всех аминокислотах как функциональная группа карбоновой кислоты (С-конец), так и функциональная группа амина (N-конец) способны к ионизации. Кроме того, семь аминокислот (аспарагиновая кислота, глутаминовая кислота, аргинин, гистидин, лизин, тирозин и цистеин) также содержат ионизируемые функциональные группы в своих R-группах.Предпочтительные состояния функциональной группы показаны либо выше, либо ниже их соответствующих значений pK и .
Обычно ионизируемая группа будет поддерживать протонированное состояние в условиях pH ниже соответствующих значений pK и и будет способствовать депротонированному состоянию в условиях pH выше соответствующих значений pK a . Таким образом, значения pK и можно использовать для прогнозирования общего состояния заряда аминокислот и образующихся на их основе пептидов/белков в определенной среде.Например, если мы посмотрим на кривую титрования основной аминокислоты гистидина (рис. 2.8). По мере достижения каждого pK и состояние заряда аминокислоты изменяется в пользу депротонированного состояния. Таким образом, гистидин будет медленно прогрессировать от общего заряда +2 при очень низком рН (полностью протонированный) до общего заряда -1 при очень высоком рН (полностью депротонированный).
Рис. 2.8 Состояние ионизации гистидина в средах с различным pH. (A) Кривая титрования гистидина от низкого pH до высокого pH.Каждая точка эквивалентности (pK a ) указана. (B) Показывает благоприятное состояние ионизации гистидина после прохождения каждого значения pK a .
Изображение адаптировано из Л. Ван Уоррен
Дополнительная практика:
Нарисуйте глутаминовую кислоту и предскажите общее состояние заряда аминокислоты при pH = 1, pH = 3, pH = 7 и pH = 12.
Цистеин и образование дисульфидных связей
Цистеин также является уникальной аминокислотой, поскольку эта боковая цепь способна подвергаться обратимой окислительно-восстановительной ( окислительно-восстановительной ) реакции с другими остатками цистеина с образованием ковалентной дисульфидной связи в окисленном состоянии (рис. 2.9). Вспомним, что когда молекулы окисляются, они теряют электроны, а когда молекулы восстанавливаются, они их приобретают. В ходе биологических окислительно-восстановительных реакций ионы водорода ( протонов ) часто удаляются вместе с электронами из молекулы при окислении, а при восстановлении возвращаются. Таким образом, если реакция теряет или приобретает протоны, это хороший признак того, что она также теряет или приобретает электроны и что происходит окислительно-восстановительная реакция.Таким образом, присоединение или потеря протонов может быть простым способом идентифицировать этот тип реакции.
Дисульфидные связи являются неотъемлемой частью формирования трехмерной структуры белков и поэтому могут сильно влиять на функцию полученного белка. В клеточных системах образование/разрыв дисульфидных связей является реакцией, опосредованной ферментами, и может использоваться как механизм контроля активности белка. Дисульфидные связи будут более подробно обсуждаться в разделе 2.xx этой главы и в главе XX.
Рис. 2.9 Цистеин может быть окислен с образованием дисульфидных связей. Во время образования дисульфидной связи два цистеина окисляются с образованием молекулы цистина. Это требует потери двух протонов и двух электронов.
вернуться наверх
2.2 Образование пептидных связей и первичная структура белка
В клеточных системах белки связаны между собой большим комплексом ферментов, который содержит смесь РНК и белков.Этот комплекс называется рибосомой . Таким образом, поскольку аминокислоты связаны друг с другом, образуя определенный белок, они располагаются в совершенно определенном порядке, который диктуется генетической информацией, содержащейся в молекуле матричной РНК (мРНК). Этот специфический порядок аминокислот известен как первичная последовательность белка . Механизм трансляции, используемый рибосомой для синтеза белков, будет подробно рассмотрен в главе XX.В этой главе основное внимание будет уделено только химической реакции, происходящей во время синтеза, и физическим свойствам полученных пептидов/белков.
Первичная последовательность белка связывается вместе с помощью синтеза дегидратации (потеря воды), который объединяет карбоновую кислоту вышерасположенной аминокислоты с аминофункциональной группой нижележащей аминокислоты с образованием амидной связи (рис. 2.10). ). Точно так же обратная реакция представляет собой гидролиз и требует включения молекулы воды для разделения двух аминокислот и разрыва амидной связи.Примечательно, что рибосома служит ферментом, который опосредует реакции синтеза дегидратации, необходимые для построения белковых молекул, тогда как класс ферментов, называемых протеазами , необходим для гидролиза белка.
В белковых структурах амидная связь между аминокислотами известна как пептидная связь . Последующие аминокислоты будут присоединены к концевой карбоксильной кислоте растущего белка.Таким образом, белки всегда синтезируются направленно, начиная с амина и заканчивая хвостом карбоновой кислоты. Новые аминокислоты всегда добавляются к хвосту карбоновой кислоты, а не к амину первой аминокислоты в цепи. Направленность синтеза белка определяется рибосомой и известна как N-в C-синтез .
Рис. 2.10 Формирование пептидной связи. Добавление двух аминокислот для образования пептида требует дегидратационного синтеза.
Как отмечалось выше в разделе, посвященном цвиттерионам, амидные связи имеют резонансную структуру, которая не позволяет неподеленной паре электронов азота действовать как основание (рис. 2.11).
Рисунок 2.11 Резонансная структура амида. Во время амидного резонанса неподеленная пара электронов азота участвует в образовании pi -связи с карбонильным углеродом, образующим двойную связь. Таким образом, амидные атомы азота не являются основными. Кроме того, связь C-N внутри амидной структуры фиксирована в пространстве и не может вращаться из-за характера связи pi-.
Изображение В.К. Чанг
Вместо этого они участвуют в образовании связи пи- с карбонильным углеродом. Кроме того, связь C-N в амидной структуре фиксирована в пространстве и не может вращаться из-за характера связи pi-. Это создает фиксированное физическое расположение R-групп внутри растущего пептида либо в конформациях цис , либо транс . Поскольку R-группы могут быть довольно объемными, они обычно чередуются по обе стороны от растущей белковой цепи в конформации транс .Конформация цис предпочтительна только с одной конкретной аминокислотой, пролином . Это связано с циклической структурой R-группы пролина и стерическими затруднениями, возникающими, когда пролин принимает конформацию -транс- (рис. 2.12). Таким образом, остатки пролина могут оказывать большое влияние на трехмерную структуру получаемого пептида.
Рисунок 2.12 Цис и Транс Конформация аминокислотных R-групп. На верхней диаграмме показаны конформации цис и транс двух соседних аминокислот, отмеченных как X и Y, которые обозначают любую из 20 аминокислот, кроме пролина. В конформации транс R-группа аминокислоты X повернута на другую сторону молекулы по сравнению с R-группой аминокислоты Y. Эта конформация дает наименьшее количество стерических затруднений по сравнению с . цис-, где R-группы расположены на одной стороне и в непосредственной близости друг от друга.На нижней диаграмме любая аминокислота X расположена выше остатка пролина. Из-за циклизации R-группы пролина с амидным азотом в основной цепи это смещает положение R-группы пролина, чтобы она была ближе к R-группе от аминокислоты X, когда она принимает конформацию транс . . Таким образом, пролин предпочитает конформацию цис , которая имеет меньшие стерические затруднения.
Белки представляют собой очень большие молекулы, содержащие множество аминокислотных остатков, связанных друг с другом в очень определенном порядке.Размер белков варьируется от 50 аминокислот в длину до самого большого из известных белков, содержащего 33 423 аминокислоты. Макромолекулы, содержащие менее 50 аминокислот, известны как пептидов (рис. 2.13).
Рис. 2.13. Пептиды и белки представляют собой макромолекулы, построенные из длинных цепей аминокислот, соединенных амидными связями. Порядок и природа аминокислот в первичной последовательности белка определяют характер укладки белка в зависимости от окружающей среды белка (т. е. если он находится внутри клетки, он, вероятно, окружен водой в очень полярной среде). , тогда как, если белок встроен в плазматическую мембрану, он будет окружен очень неполярными углеводородными хвостами).
Благодаря большому количеству аминокислот, которые могут быть включены в каждую позицию в белке, существуют миллиарды различных возможных комбинаций белков, которые можно использовать для создания новых белковых структур! Например, подумайте о трипептиде, полученном из этого пула аминокислот. В каждой позиции есть 20 различных опций, которые могут быть включены. Таким образом, общее количество возможных трипептидов будет 20 X 20 X 20 или 20 3 , что равно 8000 различных вариантов трипептидов! А теперь подумайте, сколько вариантов было бы для небольшого пептида, содержащего 40 аминокислот.Было бы 20 40 вариантов или 1,09 X 10 52 потенциальных вариантов последовательности! Каждый из этих вариантов будет различаться по общей форме белка, поскольку природа боковых цепей аминокислот помогает определить взаимодействие белка с другими остатками в самом белке и с окружающей его средой.
Характер аминокислот в белке помогает белку складываться и формировать его трехмерную структуру. Именно эта трехмерная форма необходима для функциональной активности белка (т. форма белка = функция белка ). Для белков, находящихся внутри водной среды клетки, гидрофобные аминокислоты часто будут находиться внутри белковой структуры, тогда как водолюбивые гидрофильные аминокислоты будут находиться на поверхности, где они могут образовывать водородные связи и взаимодействовать с молекулами воды. Пролин уникален тем, что он имеет единственную R-группу, которая образует циклическую структуру с функциональной группой амина в основной цепи. Именно эта циклизация заставляет пролин принимать внутри остова конформацию цис , а не транс .Этот сдвиг структуры часто будет означать, что пролины представляют собой положения, в которых внутри белка происходят изгибы или изменения направления. Метионин уникален тем, что служит исходной аминокислотой почти для всех многих тысяч белков, известных в природе. Цистеины содержат тиоловые функциональные группы и поэтому могут окисляться другими цистеиновыми остатками с образованием ковалентных дисульфидных связей в структуре белка (рис. 2.14). Дисульфидные мостики добавляют дополнительную стабильность трехмерной структуре и часто необходимы для правильного фолдинга и функционирования белков (рис. 2.14).
Рисунок 2.14 Дисульфидные связи. Дисульфидные связи образуются между двумя остатками цистеина в пептидной или белковой последовательности или между различными пептидными или белковыми цепями. В приведенном выше примере изображены две пептидные цепи, образующие гормон инсулин. Дисульфидные мостики между двумя цепями необходимы для правильного функционирования этого гормона и регулирования уровня глюкозы в крови.
Изображение: CNX OpenStax через Wikimedia Commons
Форма и функция белка
Первичная структура каждого белка приводит к уникальному паттерну укладки, характерному для этого конкретного белка.Таким образом, первичная последовательность представляет собой линейный порядок аминокислот, поскольку они связаны друг с другом в белковой цепи (рис. 2.15). В следующем разделе мы обсудим укладку белков, которая приводит к образованию вторичных, третичных и иногда четвертичных структур белка.
Рис. 2.15 Первичная структура белка представляет собой линейную последовательность аминокислот.
(кредит: модификация работы Национального института исследования генома человека)
вернуться наверх
2.3 Вторичная структура белка
В предыдущем разделе мы отметили жесткость, создаваемую связью CN в амидной связи, когда аминокислоты соединяются друг с другом, и узнали, что это приводит к тому, что R-группы аминокислот склоняются к конформации -транс- (за исключением пролина, который предпочитает конформацию цис ). Эта жесткость с белковым остовом ограничивает потенциал складывания и структуру полученного белка. Однако связи, прикрепленные к α-углероду, могут свободно вращаться и способствовать гибкости и уникальным схемам складывания, наблюдаемым в белках.Чтобы оценить возможные модели вращения, которые могут возникнуть вокруг α-углерода, обычно измеряют торсионные углы Phi (Φ) и Psi (ψ). Торсионный угол Phi (Φ) измеряет вращение вокруг связи α-углерод-азот путем оценки угла между двумя соседними карбонильными атомами углерода, когда вы смотрите прямо вниз по связи α-углерод-азот в плоскость бумаги (рис. 2.16). ). И наоборот, торсионный угол Psi (ψ) измеряет вращение вокруг связи α-углерод — карбонильный углерод, оценивая угол между двумя соседними атомами азота, когда вы смотрите прямо на связь α-углерод — карбонильный углерод (рис. 2.16).
Рисунок 2.16 Углы кручения Phi (Φ) и Psi (ψ). (A) Торсионный угол Phi (Φ) является мерой вращения вокруг связи между α-углеродом и амидным азотом. Он измеряется как угол между двумя карбонильными атомами углерода, соседними со связью, как показано на нижней панели. (B) Торсионный угол Psi (ψ) является мерой вращения вокруг связи между α-углеродом и карбонильным углеродом. Он измеряется как угол между двумя атомами азота, примыкающими к связи, как показано на нижней панели.
В то время как связи вокруг α-углерода могут свободно вращаться, благоприятные торсионные углы ограничены меньшим подмножеством возможностей, поскольку соседние атомы избегают конформаций, которые имеют высокие стерические затруднения, связанные с ними. Г.Н. Рамачандран создал компьютерные модели малых пептидов для определения стабильных конформаций торсионных углов Phi (Φ) и Psi (ψ). С его результатами он создал то, что известно как график Рамачандрана, который графически отображает области перекрытия наиболее благоприятных углов кручения Phi (Φ) и Psi (ψ) (рис. 2.17)
Рис. 2.17. Заговор Рамачандрана. Благоприятные и очень благоприятные торсионные углы Phi (Φ) и Psi (ψ) обозначены желтым и красным цветом соответственно. Указаны валентные углы для общих вторичных белковых структур.
Изображение изменено с: J. Cooper
В каждом белке небольшие участки белка могут приобретать специфические повторяющиеся паттерны укладки. Эти специфические мотивы или узоры называются вторичной структурой .Две наиболее распространенные вторичные структурные особенности включают альфа-спираль и бета-гофрированный лист (рис. 2.18). Внутри этих структур внутримолекулярные взаимодействия, особенно водородные связи между основной аминной и карбонильной функциональными группами, имеют решающее значение для поддержания трехмерной формы.
Рис. 2.18 Вторичные структурные признаки в структуре белка. Правосторонняя альфа-спираль и бета-складчатая пластина являются общими структурными мотивами, обнаруженными в большинстве белков.Они удерживаются вместе водородными связями между амином и карбонильным кислородом в основной цепи аминокислоты.
Изображение изменено из: Wiki Школы биомедицинских наук
Альфа-Хеликс
Для альфа-спиральных структур правая спираль очень распространена, тогда как левосторонняя спираль очень редка. Это связано с углами закручивания Phi (Φ) и Psi (ψ), необходимыми для получения левосторонней альфа-спиральной структуры.Белку пришлось бы свернуться и закрутиться под многими неблагоприятными углами, прежде чем он получил бы правильную ориентацию для левой спирали. Таким образом, они не очень распространены в природе.
Для правосторонней альфа-спирали на каждый спиральный виток приходится 3,6 аминокислотных остатка (рис. 2.19). Группы R (вариантные группы) полипептида выступают из цепи α спирали. Полипептидный остов образует повторяющуюся спиральную структуру, которая стабилизирована водородными связями между карбонильным кислородом и аминным водородом.Эти водородные связи возникают через равные промежутки времени, одна водородная связь на каждую четвертую аминокислоту, и заставляют полипептидный остов образовывать спираль. Каждая аминокислота продвигает спираль вдоль своей оси на 1,5 Å. Каждый виток спирали состоит из 3,6 аминокислот; поэтому шаг спирали равен 5,4 Å. На спираль приходится в среднем десять аминокислотных остатков. Разные аминокислоты имеют разную склонность к образованию α -спирали. Аминокислоты, которые предпочитают принимать спиральные конформации в белках, включают метионин, аланин, лейцин, глутамат и лизин.Пролин и глицин почти не имеют склонности к образованию спиралей.
Рис. 2.19 Структура правосторонней альфа-спирали. (A) Модель с мячом и клюшкой, вид сбоку. Всего для образования одного витка спирали α требуется 3,6 аминокислоты. Водородные связи между карбонильным кислородом и азотом 4-й аминокислоты стабилизируют спиральную структуру. На показанной структуре черные атомы представляют собой альфа-углерод, серые — карбонильные атомы углерода, красные — кислород, синие — азот, зеленые — R-группы, а светло-фиолетовые — атомы водорода.(B) Расширенная линейная конструкция, вид сбоку и модель заполнения пространства (C) Расширенная линейная конструкция, вид сверху и модель заполнения пространства
Изображение A изменено от: Максим Изображения B и C от: Генри Якубовски
Основные сведения об Alpha Helix:
- Альфа-спираль более компактна, чем полностью вытянутая полипептидная цепь с углами phi/psi 180 o
- В белках среднее количество аминокислот в спирали равно 11, что дает 3 витка.
- Левосторонняя альфа-спираль, хотя и разрешена при осмотре участка Рамачандрана, редко наблюдается, поскольку аминокислоты, используемые для построения структуры белка, представляют собой L-аминокислоты и смещены в сторону формирования правосторонней спирали. Когда образуются левые спирали, они часто имеют решающее значение для правильного фолдинга белка, стабильности белка или непосредственно участвуют в формировании активного центра.
Рис. 2.20 Структура левосторонней альфа-спирали. На этой диаграмме левосторонняя альфа-спираль, показанная желтым цветом, является частью поворота шпильки в структуре белка и стабилизирована двумя дисульфидными мостиками, показанными желтым цветом.
Рисунок из: Annavarapu, S., Nanda, V. (2009) BMC Struct Biol 9, 61
- Сердцевина спирали плотно упакована. В спирали нет отверстий или пор.
- Все R-группы простираются наружу и в сторону от оси спирали. R-группы могут быть гидрофильными или гидрофобными и могут быть локализованы в определенных положениях на спирали, образуя амфипатические участки белка, или полностью гидрофобные спирали могут проходить через плазматическую мембрану, как показано на рис. 2.21
.
Рисунок 2.21 Расположение R-групп внутри альфа-спиральных структур. R-группы могут быть расположены внутри альфа-спирали для создания амфипатических областей в белке, где гидрофильные остатки расположены на одной стороне спирали, а гидрофобные — на другой, как показано на виде сбоку (А) или видах сверху вниз ( ДО НАШЕЙ ЭРЫ).R-группы также могут быть полностью гидрофобными внутри альфа-спиралей, которые охватывают плазматическую мембрану, как показано на (D).
Рисунок изменен из: Khara, J.S., et al. (2017) Acta Biomat 57:103-114 и Ryu, H., et al. (2019) Int J Mol Sci 20 (6) 1437
- Некоторые аминокислоты чаще встречаются в альфа-спиралях, чем другие. Вот аминокислоты, которые обычно НЕ находятся в альфа-спиральных структурах: Gly слишком малы и конформационно гибки, чтобы их можно было обнаружить с высокой частотой в альфа-спиралях, в то время как Pro слишком жесткие и в цис -конформации. Pro часто нарушает спиральную структуру, вызывая изгибы белка. Некоторые аминокислоты с не слишком длинными боковыми цепями, которые могут образовывать Н-связь ( Ser, Asp, и Asn ), действуют как конкуренты донора и акцептора Н-связи основной цепи и дестабилизируют альфа спирали. R-группы с ранним разветвлением, такие как Val и Ile, , дестабилизируют альфа-спираль из-за стерических взаимодействий объемных боковых цепей с основной цепью спирали.
- Краткое изложение склонности аминокислот к альфа-спирали (а также к бета-структуре)
- Альфа-кератины, основной компонент волос, кожи, меха, клюва и ногтей, почти полностью представляют собой альфа-спирали.
Jmol: Обновлено Изолированная спираль антифризного белка Jmol14 (Java) | JSMol (HTML5)
Бета-лист со складками:
В β-складчатом листе «складки» образуются за счет водородных связей между атомами в основной цепи полипептида.Группы R присоединены к атомам углерода и простираются выше и ниже складок складки в конформации -транс-. Складчатые сегменты располагаются параллельно или антипараллельно друг другу, а водородные связи образуются между частично положительным атомом азота в аминогруппе и частично отрицательным атомом кислорода в карбонильной группе пептидного остова (рис. 2.21).
Рис. 2.21 Структура бета-гофрированного листа. Складчатый лист с бета-складкой может быть ориентирован в параллельном или антипараллельном направлении, как показано на (A) выше, где лист с бета-складкой обозначен красными ленточными стрелками.Направление стрелки указывало на ориентацию белка, при этом стрелка проходила в направлении от N к C. Водородная связь между основной карбонильной и основной аминной функциональными группами стабилизировала как антипараллельную (B слева), так и параллельную (B справа) β-складчатую листовую структуру.
Изображение (A) из: Xenoblast Изображение (B) из: Fvasconcellos
Другие мотивы вторичной структуры:
Другие важные вторичные структуры включают витки, петли, шпильки и гибкие линкеры .Существует множество различных классификаций витков в структуре белка, включая α-витков, β-витков, γ-витков, δ-витков и π-витков . β-витки (наиболее распространенная форма) обычно содержат четыре аминокислотных остатка (рис. 2.22). Пролин и глицин обычно встречаются в поворотных мотивах, поскольку цис-конформация пролина способствует более резким конформационным изгибам, в то время как минимальная боковая цепь глицина позволяет более плотно упаковать аминокислоты, что способствует поворотной структуре.
Рис. 2.22 Схема β-витков I и II типов.
Изображение от: Маскид
ω-петля — это общий термин для более длинной, удлиненной или неправильной петли без фиксированной внутренней водородной связи. Шпилька является частным случаем поворота, при котором направление белкового остова меняется на противоположное и взаимодействуют фланкирующие элементы вторичной структуры. Например, бета-шпилька соединяет две антипараллельные β-нити, связанные водородными связями.Повороты иногда обнаруживаются внутри гибких линкеров или петель, соединяющих белковые домены. Линкерные последовательности различаются по длине и обычно богаты полярными незаряженными аминокислотами. Гибкие линкеры позволяют соединяющим доменам свободно скручиваться и вращаться для привлечения своих партнеров по связыванию за счет динамики белковых доменов.
вернуться наверх
2.4 Супервторичная структура и белковые мотивы
Между вторичной и третичной структурой белков находятся более крупные трехмерные элементы, которые были идентифицированы во множестве различных белковых структур.Они известны как супервторичная структура и как белковые мотивы . Супервторичная структура обычно состоит из двух вторичных структур, соединенных вместе витком, и включает спираль-виток-спираль, спираль-петлю-спираль, углы α-α, углы β-β и β-шпильку-β (рис. 2.23).
Рисунок 2.23 Примеры сверхвторичных структур. (A) Структуры β-шпильки-β характеризуются резким поворотом шпильки, который не нарушает водородные связи двух β-складчатых листовых структур.(B) Предлагаемая структура спираль-поворот-спираль белка Taspase1, (C) угловая структура α-α, присутствующая в белке Myoglobin.
Изображение A: Изабелла Дайдоне. Изображение B: Johannes van den Boom, et al. (2016) PLosONE 11(3):e0151431
Изображение C изменено из: Belles14104
Белковые мотивы представляют собой более сложные структуры, созданные из вторичных и супервторичных структурных компонентов, которые являются повторяющимися модальностями, визуализируемыми во многих белковых структурах.
Бета-цепи
имеют тенденцию скручиваться в правом направлении, что помогает минимизировать конформационную энергию. Это приводит к образованию интересных структурных мотивов, обнаруженных во многих типах белков. Две из этих структур включают скрученные листы или седла, а также бета-баррели (рис. 2.24)
Рис. 2.24 Общие структурные мотивы бета-нитей. (A) Правосторонний скрученный лист, вид сверху и сбоку, (B) Бета-ствол, вид сбоку, и (С) Бета-ствол, вид сверху
Изображение: Генри Якубовски
Структурные мотивы могут выполнять определенные функции в белках, например обеспечивать связывание субстратов или кофакторов.Например, укладка Россмана отвечает за связывание с кофакторами нуклеотидов, такими как никотинамидадениндинуклеотид (NAD + ) (рис. 2.25). Складка Россмана состоит из шести параллельных бета-тяжей, образующих расширенный бета-лист. Первые три цепи соединены α-спиралями, что приводит к структуре бета-альфа-бета-альфа-бета. Этот паттерн дублируется один раз, чтобы получить перевернутый тандемный повтор, содержащий шесть нитей. В целом нити расположены в порядке 321456 (1 = N-конец, 6 = C-конец).Пять скрученных складок, подобных Россману, расположены в порядке 32145. Общая третичная структура складки напоминает трехслойный бутерброд, в котором начинка состоит из расширенного бета-листа, а два ломтика хлеба образованы соединительными параллельными альфа-слоями. спирали.
Рис. 2.25 Складка Россмана. (A) Структура никотинамидадениндинуклеотида (NAD + ) (B) Мультипликационная схема складки Россмана (спирали AF красные и нити 1-6 желтые) от E.coli фермент малатдегидрогеназа. Кофактор NAD + связывается как молекула, заполняющая пространство. (C) Схематическая диаграмма шестинитевой складки Россмана.
Изображение изменено с: Boghog
Одной из особенностей складки Россмана является специфичность связывания кофактора. Наиболее консервативным сегментом складок Россмана является первый сегмент бета-альфа-бета. Поскольку этот сегмент находится в контакте с АДФ-частью динуклеотидов, таких как ФАД, НАД и НАДФ, его также называют «АДФ-связывающей бета-бета-складкой».
Интересно, что сходные структурные мотивы не всегда имеют общего эволюционного предка и могут возникать в результате конвергентной эволюции. Так обстоит дело с TIM Barrel, консервативной белковой складкой, состоящей из восьми α-спиралей и восьми параллельных β-цепей, чередующихся вдоль пептидного остова. Структура названа в честь триозофосфатизомеразы, консервативного метаболического фермента. Бочки TIM — одна из наиболее распространенных белковых складок. Одной из самых интригующих особенностей представителей этого класса белков является то, что, хотя все они демонстрируют одинаковую третичную укладку, между ними очень мало сходства последовательностей.По крайней мере 15 различных семейств ферментов используют этот каркас для создания соответствующей геометрии активного центра, всегда на С-конце восьми параллельных бета-цепей ствола.
Рис. 2.26 Цилиндр TIM. Бочки TIM считаются складками белка α / β, поскольку они включают чередующийся рисунок α-спиралей и β-цепей в одном домене. В цилиндре TIM спирали и нити (обычно по 8 штук) образуют соленоид, который изгибается, чтобы замкнуться на себя в форме пончика, топологически известного как тороид.Параллельные β-нити образуют внутреннюю стенку бублика (следовательно, β-бочку), тогда как α-спирали формируют внешнюю стенку бублика. Каждая β-цепь соединяется со следующей соседней нитью в стволе через длинную правую петлю, включающую одну из спиралей, так что раскраска ленты от N к C на виде сверху (A) происходит в радужном порядке вокруг бочка. Таким образом, ствол TIM также можно рассматривать как состоящий из 8 перекрывающихся правосторонних β-α-β сверхвторичных структур, как показано на виде сбоку (B).
Изображение изменено с: WillowW
Хотя на ленточной диаграмме цилиндра TIM показано отверстие в центральном ядре белка, боковые цепи аминокислот на этом изображении не показаны (рис. 2.26). Ядро белка на самом деле плотно упаковано, в основном с объемными гидрофобными аминокислотными остатками, хотя необходимо несколько глицинов, чтобы дать пространство для маневра, чтобы сильно ограниченный центр из 8 приблизительных повторов совпадал. Во взаимодействиях упаковки между цепями и спиралями также доминирует гидрофобность, а разветвленные алифатические остатки валина, лейцина и изолейцина составляют около 40% от общего количества остатков в β-цепях.
По мере того, как наши знания о бесчисленном множестве структурных мотивов, обнаруженных в природной сокровищнице белковых структур, продолжают расти, мы продолжаем получать представление о том, как структура белка связана с функцией, и у нас появляется больше возможностей характеризовать недавно полученные белковые последовательности, используя in silico . технологии.
вернуться наверх
2.5 Третичная и четвертичная структура белка
Полная трехмерная форма всего белка (или сумма всех вторичных структурных мотивов) известна как третичная структура белка и является уникальной и определяющей чертой этого белка (рис. 2.27). Прежде всего, взаимодействия между группами R создают сложную трехмерную третичную структуру белка. Природа групп R, обнаруженных в вовлеченных аминокислотах, может противодействовать образованию водородных связей, описанных для стандартных вторичных структур, таких как альфа-спираль. Например, группы R с одинаковыми зарядами отталкиваются друг от друга, а группы с разными зарядами притягиваются друг к другу (ионные связи). Незаряженные неполярные боковые цепи могут образовывать гидрофобные взаимодействия.Взаимодействие между боковыми цепями цистеина может привести к образованию дисульфидных связей.
Рис. 2.27 Третичная структура белка. Третичная структура белков определяется множеством химических взаимодействий. К ним относятся гидрофобные взаимодействия, ионная связь, водородная связь и дисульфидные связи.
Изображение: Школа биомедицинских наук Wiki
Все эти взаимодействия, слабые и сильные, определяют окончательную трехмерную форму белка.Когда белок теряет свою трехмерную форму, он обычно перестает быть функциональным.
В природе некоторые белки образуются из нескольких полипептидов, также известных как субъединицы, и взаимодействие этих субъединиц образует четвертичную структуру . Слабые взаимодействия между субъединицами помогают стабилизировать общую структуру. Например, инсулин (глобулярный белок) имеет комбинацию водородных и дисульфидных связей, которые заставляют его в основном слипаться в шарообразную форму.Инсулин начинается как один полипептид и теряет некоторые внутренние последовательности во время клеточного процессинга, которые образуют две цепи, удерживаемые вместе дисульфидными связями, как показано на рис. 2.14. Затем три из этих структур группируются, образуя неактивный гексамер (рис. 2.28). Гексамерная форма инсулина позволяет организму хранить инсулин в стабильной и неактивной конформации, чтобы он был доступен для высвобождения и реактивации в мономерной форме.
Рис. 2.28 Гормон инсулина является хорошим примером четвертичной структуры. Инсулин вырабатывается и хранится в организме в виде гексамера (единицы из шести молекул инсулина), а активной формой является мономер. Гексамер представляет собой неактивную форму с долговременной стабильностью, которая служит способом защиты высокореактивного инсулина, но в то же время легкодоступного.
Рисунок Автор: Исаак Йонемото
Предсказание паттерна укладки белка на основе его первичной последовательности является чрезвычайно сложной задачей из-за присущей аминокислотным остаткам гибкости, которые можно использовать для формирования различных вторичных признаков.Как описано Fujiwara и др., классификация SCOP (структурная классификация белков) и SCOPe (расширенная версия) являются основными базами данных, обеспечивающими подробное и исчерпывающее описание всех известных структур белков. Классификация SCOP основана на иерархических уровнях: первые два уровня, семейство и надсемейство , описывают близкие и дальние эволюционные отношения, тогда как третий, кратность , описывает геометрические отношения и структурные мотивы внутри белка.В рамках схемы складчатой классификации большинство белков относятся к одному из четырех структурных классов: (1) все α-спирали, (2) все β-слои, (3) α/β для белков с дисперсным рисунком и (4) α + β для белков с участками, в которых преобладает тот или иной тип паттерна.
На основании их формы, функции и расположения белки можно охарактеризовать как волокнистые, глобулярные, мембранные или неупорядоченные.
Волокнистые белки
Волокнистые белки характеризуются удлиненной белковой структурой.Эти типы белков часто объединяются в нити или пучки, образуя структурные каркасы в биологических системах. У животных два наиболее распространенных семейства волокнистых белков — это α-кератин и коллаген.
α-кератин
α-кератин является ключевым структурным элементом, из которого состоят волосы, ногти, рога, когти, копыта и внешний слой кожи. Из-за своей плотно намотанной структуры он может функционировать как один из самых прочных биологических материалов и имеет различное применение у млекопитающих, от хищных когтей до волос для тепла.α-кератин синтезируется в результате биосинтеза белка с использованием транскрипции и трансляции, но по мере созревания клетки и заполнения ее α-кератином она погибает, образуя сильную несосудистую единицу ороговевшей ткани.
Первые последовательности α-кератинов были определены Ханукоглу и Фуксом. Эти последовательности показали, что существует два различных, но гомологичных семейства кератинов, которые были названы кератинами типа I и кератинами типа II. У человека имеется 54 гена кератина, 28 из которых кодируют тип I, а 26 — тип II. Белки типа I являются кислыми, то есть содержат больше кислых аминокислот, таких как аспарагиновая кислота, а белки типа II являются основными, то есть содержат больше основных аминокислот, таких как лизин. Эта дифференциация особенно важна для α-кератинов, потому что при синтезе димера его субъединицы, спиральной катушки , одна белковая спираль должна быть типа I, а другая должна быть типа II (рис. 2.29). Даже в типах I и II есть кислые и основные кератины, которые особенно дополняют друг друга в каждом организме.Например, в коже человека К5, α-кератин II типа, в основном соединяется с K14, α-кератином I типа, с образованием α-кератинового комплекса эпидермального слоя клеток кожи.
Затем
спирально-скрученных димеров собираются в протофиламенты, очень стабильный левозакрученный суперспиральный мотив, который далее мультимеризуется, образуя филаменты, состоящие из множества копий мономеров кератина (рис. 2.29). Главной силой, которая удерживает спирально-спиральные структуры связанными друг с другом, являются гидрофобные взаимодействия между неполярными остатками вдоль спиральных сегментов кератина.
Рисунок 2.29. Формирование промежуточной нити. Промежуточные филаменты состоят из суперспирального комплекса α-кератина. Первоначально два мономера кератина (A) образуют спиральную спиральную димерную структуру (B). Два спиральных спиральных димера соединяются, образуя тетрамер, расположенный в шахматном порядке (C), тетрамеры начинают соединяться вместе (D), в конечном итоге образуя лист из восьми тетрамеров (E ). Затем лист из восьми тетрамеров скручивается в левостороннюю спираль, образуя конечную промежуточную нить (E). Электронная микрофотография промежуточной нити показана в верхнем левом углу.
Изображение: Правительство США
Коллаген
Волокнистый белок, Коллаген является наиболее распространенным белком у млекопитающих, составляющим от 25% до 35% общего содержания белка в организме. Он находится преимущественно во внеклеточном пространстве в различных соединительных тканях организма. Коллаген содержит уникальную четвертичную структуру из трех белковых нитей, свернутых вместе в тройную спираль.Он в основном встречается в волокнистых тканях, таких как сухожилия, связки и кожа.
В зависимости от степени минерализации коллагеновые ткани могут быть жесткими (кость), податливыми (сухожилия) или иметь градиент жесткости к податливости (хрящи). Его также много в роговице, кровеносных сосудах, кишечнике, межпозвонковых дисках и дентине зубов. В мышечной ткани он служит основным компонентом эндомизия. Коллаген составляет от одного до двух процентов мышечной ткани и составляет 6 % веса сильных сухожильных мышц.Фибробласт является наиболее распространенной клеткой, которая создает коллаген. Желатин, используемый в пищевой промышленности и промышленности, представляет собой необратимо гидролизованный коллаген. Кроме того, частично и полностью гидролизованные порошки коллагена используются в качестве пищевых добавок. Коллаген имеет множество медицинских применений при лечении осложнений костей и кожи.
Название коллаген происходит от греческого ( kólla ), что означает «клей», и суффикса -gen , обозначающего «производящий». Это относится к раннему использованию соединения в процессе варки кожи и сухожилий лошадей и других животных для получения клея.
Более 90% коллагена в организме человека относится к типу I. Однако по состоянию на 2011 г. было идентифицировано, описано 28 типов коллагена, которые разделены на несколько групп в зависимости от структуры, которую они образуют. Пять наиболее распространенных типов:
- Тип I: кожа, сухожилия, сосуды, органы, кости (основной компонент органической части кости)
- Тип II: хрящ (основной коллагеновый компонент хряща)
- Тип III: ретикулярный (основной компонент ретикулярных волокон), обычно встречается наряду с типом I
- Тип IV: образует базальную мембрану, секретируемый эпителием слой базальной мембраны
- Тип V: поверхность клеток, волосы и плацента
Здесь мы сосредоточимся на уникальных свойствах коллагена I типа.Коллаген типа I имеет необычный аминокислотный состав и последовательность:
.
- Глицин встречается почти в каждом третьем остатке.
- Пролин составляет около 17% коллагена.
- Коллаген содержит две необычные производные аминокислоты, не вставленные непосредственно во время трансляции. Эти аминокислоты находятся в определенных местах по сравнению с глицином и посттрансляционно модифицируются различными ферментами, оба из которых требуют витамина С в качестве кофактора (рис. 2.30).
- Гидроксипролин, полученный из пролина
- Гидроксилизин, полученный из лизина — в зависимости от типа коллагена гликозилировано различное количество гидроксилизинов (в основном с присоединенными дисахаридами).
Рисунок 2.30. Гидроксилирование пролина и лизина во время посттрансляционной модификации коллагена типа I. Ферменты пролилгидроксилаза и лизилгидроксилаза необходимы для гидроксилирования остатков пролина (А) и лизина (В) соответственно. (Примечание: хотя положение 3 показано выше, остатки пролила могут альтернативно быть гидроксилированы в положении 4). Ферменты гидроксилазы модифицируют аминокислотные остатки после того, как они были включены в белок в качестве посттрансляционной модификации, и требуют витамина С (аскорбат) в качестве кофактора.(C) Дальнейшая модификация остатков гидроксилизина путем гликозилирования может привести к включению дисахарида (галактоза-глюкоза) в оксикислород.
Большинство коллагенов образуются сходным образом. Процесс синтеза коллагена типа I описан ниже и демонстрирует сложность фолдинга и процессинга белка (рис. 2.31).
- Внутри клетки
- При трансляции на рибосомах вдоль шероховатого эндоплазматического ретикулума (РЭР) образуются два типа альфа-цепей: альфа-1 и альфа-2 цепи.Эти пептидные цепи (известные как препроколлаген) имеют регистрационные пептиды на каждом конце и сигнальный пептид.
- полипептидных цепей высвобождаются в просвет RER.
- расщепляются внутри RER, и их цепи теперь известны как про-альфа-цепи.
- Внутри просвета происходит гидроксилирование аминокислот лизина и пролина. Этот процесс зависит от аскорбиновой кислоты (витамин С) в качестве кофактора.
- Происходит гликозилирование определенных остатков гидроксилизина.
- Тройная альфа-спиральная структура формируется внутри эндоплазматического ретикулума из двух альфа-1-цепей и одной альфа-2-цепи.
- Проколлаген доставляется в аппарат Гольджи, где он упаковывается и секретируется путем экзоцитоза.
Сигнальные пептиды
- Вне камеры
- Пептиды регистрации расщепляются и образуется тропоколлаген пептидазой проколлагена.
- Множественные молекулы тропоколлагена образуют коллагеновые фибриллы посредством ковалентного сшивания (альдольная реакция) лизилоксидазой, которая связывает остатки гидроксилизина и лизина.Несколько коллагеновых фибрилл образуют коллагеновые волокна.
- Коллаген может быть прикреплен к клеточным мембранам через несколько типов белков, включая фибронектин, ламинин, фибулин и интегрин.
Рисунок 2.31. Синтез коллагена типа I. Полипептидные цепи синтезируются в эндоплазматическом ретикулуме и высвобождаются в просвет, где они гидроксилируются и гликозилируются. Тройная спираль проколлагена формируется и транспортируется через аппарат Гольджи, где происходит дальнейшая обработка.Проколлаген секретируется во внеклеточный матрикс, где расщепляется до тропоколлагена. Тропоколлаген собирается в коллагеновую фибриллу, где происходит перекрестное связывание и образование водородных связей с образованием окончательного коллагенового волокна.
Изображение изменено: E.V. Вонг и Британская энциклопедия
Дефицит витамина С вызывает цингу, серьезное и болезненное заболевание, при котором дефект коллагена препятствует образованию прочной соединительной ткани. Десны портятся и кровоточат, с потерей зубов; кожа обесцвечивается, а раны не заживают.До 18 века это состояние было печально известно среди длительных военных, особенно военно-морских, экспедиций, во время которых участников лишали продуктов, содержащих витамин С.
Аутоиммунное заболевание, такое как красная волчанка или ревматоидный артрит, может поражать здоровые волокна коллагена. Кортизол стимулирует расщепление коллагена до аминокислот, что позволяет предположить, что стресс может усугубить эти болезненные состояния.
Многие бактерии и вирусы выделяют факторы вирулентности, такие как фермент коллагеназа, который разрушает коллаген или препятствует его выработке.
вернуться наверх
Глобулярные белки
Глобулярные белки или Сферопротеины представляют собой сферические («шаровидные») белки и являются одним из распространенных типов белков. Глобулярные белки в некоторой степени растворимы в воде (образуя коллоиды в воде), в отличие от волокнистых или мембранных белков. Существует множество классов глобулярных белков с укладки, поскольку существует множество различных архитектур, которые могут складываться в примерно сферическую форму.
Термин глобин может более конкретно относиться к белкам, включая глобиновую складку. Глобиновая складка является обычной трехмерной складкой в белках и определяет суперсемейство глобиноподобных белков (рис. 2.32). Эта складка обычно состоит из восьми альфа-спиралей, хотя некоторые белки имеют на концах дополнительные спиральные удлинения. Глобиновая складка встречается в одноименных семействах глобиновых белков: гемоглобинах и миоглобинах, а также в фикоцианинах.Поскольку миоглобин был первым белком, структура которого была решена, глобиновая складка была, таким образом, первой обнаруженной белковой складкой. Поскольку глобиновая складка содержит только спирали, она классифицируется как полностью альфа-белковая складка.
Рис. 2.32. Складка Глобина. (A) Пример глобиновой складки, переносящего кислород белка миоглобина (PBD ID 1MBA) моллюска Aplysia limacina. (B) Структура тетрамерного белка гемоглобина, содержащего в общей сложности четыре глобиновые складки.
Изображение A: Википедия Изображение B: Zephyris
Термин «глобулярный белок» довольно старый (датируемый, вероятно, 19 веком) и в настоящее время несколько архаичный, учитывая сотни тысяч белков и более элегантный и описательный словарь структурных мотивов. Сферическая структура индуцируется третичной структурой белка. Неполярные (гидрофобные) аминокислоты молекулы связаны внутри молекулы, тогда как полярные (гидрофильные) аминокислоты связаны снаружи, обеспечивая диполь-дипольные взаимодействия с растворителем, что объясняет растворимость молекулы.
В отличие от волокнистых белков, которые играют преобладающую структурную функцию, глобулярные белки могут действовать как:
- Ферменты, катализирующие органические реакции, протекающие в организме в мягких условиях и обладающие высокой специфичностью. Эту роль выполняют различные эстеразы.
- Посланники, передавая сообщения для регулирования биологических процессов. Эту функцию выполняют гормоны, т. е. инсулин и т. д.
- Транспортеры других молекул через мембраны
- Запасы аминокислот.
- Регуляторные роли также выполняют глобулярные белки, а не волокнистые белки.
- Структурные белки, например актин и тубулин, глобулярные и растворимые в виде мономеров, но полимеризующиеся с образованием длинных жестких волокон
Многие белки, которые будут подробно описаны в последующих главах, попадают в этот класс белков.
Мембранные белки
Мембранные белки — это белки, которые являются частью биологических мембран или взаимодействуют с ними.Они включают: 1) интегральные мембранные белки, которые являются частью мембраны или постоянно прикреплены к ней, и 2) периферические мембранные белки, которые временно присоединены к мембране через интегральные белки или липидный бислой. Интегральные мембранные белки далее классифицируются как трансмембранные белки, которые пересекают мембрану, или интегральные монотопные белки, которые должны быть прикреплены только к одной стороне мембраны.
Часто встречаются мембранные белки, такие как растворимые глобулярные белки, волокнистые белки и неупорядоченные белки. Мембранные белки, символизирующие их важность в медицине, являются мишенями для более чем 50% всех современных лекарственных препаратов. Подсчитано, что 20–30% всех генов в большинстве геномов кодируют мембранные белки. По сравнению с другими классами белков определение структуры мембранных белков остается сложной задачей в значительной степени из-за сложности создания экспериментальных условий, которые могут сохранить правильную конформацию белка в изоляции от его нативной среды (рис. 2.33).
Мембранные белки выполняют множество функций, жизненно важных для выживания организмов:
- Белки мембранных рецепторов передают сигналы между внутренней и внешней средой клетки.
- Транспортные белки перемещают молекулы и ионы через мембрану. Их можно классифицировать в соответствии с базой данных Transporter Classification.
- Мембранные ферменты могут иметь множество активностей, таких как оксидоредуктазы, трансферазы или гидролазы.
- Молекулы клеточной адгезии позволяют клеткам идентифицировать друг друга и взаимодействовать.Например, белки, участвующие в иммунном ответе.
Рис. 2.33. Схематическое изображение трансмембранных белков. 1. одиночная трансмембранная α-спираль (битопный мембранный белок) 2. политопный трансмембранный α-спиральный белок 3. политопный трансмембранный белок β-слоя. Мембрана представлена светло-коричневым цветом.
Интегральные мембранные белки прочно прикреплены к мембране. Такие белки можно отделить от биологических мембран только с помощью детергентов, неполярных растворителей или иногда денатурирующих агентов.Их можно классифицировать в соответствии с их отношением к бислою:
- Интегральные политопные белки представляют собой трансмембранные белки, которые пересекают мембрану более одного раза. Эти белки могут иметь различную трансмембранную топологию. Эти белки имеют одну из двух структурных архитектур:
- белки пучка спирали, присутствующие во всех типах биологических мембран;
- бета-бочкообразных белков, которые обнаруживаются только во внешних мембранах грамотрицательных бактерий, а также во внешних мембранах митохондрий и хлоропластов.
- Битопические белки представляют собой трансмембранные белки, которые пересекают мембрану только один раз. Трансмембранные спирали этих белков имеют значительно отличающееся распределение аминокислот по сравнению с трансмембранными спиралями политопных белков.
- Интегральные монотопные белки представляют собой интегральные мембранные белки, которые прикрепляются только к одной стороне мембраны и не охватывают всю ее поверхность.
Рис. 2.34 Схематическое изображение различных типов взаимодействия между монотопными мембранными белками и клеточной мембраной. 1. взаимодействие посредством амфипатической α-спирали, параллельной плоскости мембраны (мембранная спираль в плоскости) 2. взаимодействие посредством гидрофобной петли 3. взаимодействие посредством ковалентно связанного мембранного липида ( липидирование ) 4. электростатические или ионные взаимодействия с мембранные липиды.
Изображение от : Foobar
Белки периферической мембраны временно присоединены либо к липидному бислою, либо к интегральным белкам за счет комбинации гидрофобных, электростатических и других нековалентных взаимодействий.Периферические белки диссоциируют после обработки полярным реагентом, таким как раствор с повышенным pH или высокой концентрацией солей.
Интегральные и периферические белки могут быть посттрансляционно модифицированы с добавлением жирных кислот, диацилглицериновых или пренильных цепей или GPI (гликозилфосфатидилинозитол), которые могут быть закреплены в липидном бислое.
Неупорядоченные белки
Внутренне неупорядоченный белок ( IDP ) представляет собой белок, в котором отсутствует фиксированная или упорядоченная трехмерная структура (рис. 2.35). IDP охватывают спектр состояний от полностью неструктурированных до частично структурированных и включают случайные клубки, (пре-)расплавленные глобулы и большие многодоменные белки, связанные гибкими линкерами. Они составляют один из основных типов белков (наряду с глобулярными, фиброзными и мембранными белками).
Рис. 2.35 Конформационная гибкость белка SUMO-1 (PDB:1a5r). Центральная часть показывает относительно упорядоченную структуру. И наоборот, N- и C-концевые области (левый и правый, соответственно) демонстрируют «внутренний беспорядок», хотя в N-концевом хвосте сохраняется короткая спиральная область.Были преобразованы десять альтернативных моделей ЯМР. Элементы вторичной структуры: α-спирали (красные), β-тяжи (синие стрелки).
Изображение: Лукаш Козловски
Открытие IDP бросило вызов традиционной парадигме структуры белка, согласно которой функция белка зависит от фиксированной трехмерной структуры. Эта догма была оспорена за последние двадцать лет увеличением количества данных из различных областей структурной биологии, предполагающих, что динамика белков может иметь большое значение для таких систем.Несмотря на отсутствие стабильной структуры, IDP представляют собой очень большой и функционально важный класс белков. В некоторых случаях IDP могут принимать фиксированную трехмерную структуру после связывания с другими макромолекулами. В целом, IDP во многих отношениях отличаются от структурированных белков и, как правило, обладают отличными свойствами с точки зрения функции, структуры, последовательности, взаимодействия, эволюции и регуляции.
В 1930-1950-х годах первые структуры белков были решены с помощью кристаллографии белков.Эти ранние структуры предполагали, что для обеспечения биологических функций белков обычно может потребоваться фиксированная трехмерная структура. Утверждая, что белки имеют только одну однозначно определенную конфигурацию, Мирски и Полинг не понимали, что работа Фишера подкрепила бы их тезис с его моделью «Замок и ключ» (1894). Эти публикации укрепили центральную догму молекулярной биологии о том, что последовательность определяет структуру, которая, в свою очередь, определяет функцию белков.В 1950 году Каруш написал о «конфигурационной адаптивности», противоречащей всем предположениям и исследованиям XIX века. Он был убежден, что белки имеют более одной конфигурации на одном и том же энергетическом уровне и могут выбирать одну из них при связывании с другими субстратами. В 1960-х годах парадокс Левинталя предположил, что систематический конформационный поиск длинного полипептида вряд ли даст единственную свернутую белковую структуру в биологически релевантных временных масштабах (т. е. от секунд до минут). Любопытно, что для многих (небольших) белков или белковых доменов можно наблюдать относительно быструю и эффективную рефолдинг in vitro .Как указано в «Догме Анфинсена» 1973 года, фиксированная трехмерная структура этих белков уникально закодирована в своей первичной структуре (аминокислотной последовательности), кинетически доступна и стабильна в ряде (близких) физиологических условий и, следовательно, может рассматриваться как нативное состояние таких «упорядоченных» белков.
Однако в течение последующих десятилетий многие крупные белковые области не могли быть отнесены к наборам рентгеновских данных, что указывает на то, что они занимают несколько позиций, которые усредняются на картах электронной плотности.Отсутствие фиксированных, уникальных положений относительно кристаллической решетки предполагало, что эти области «неупорядочены». Спектроскопия ядерного магнитного резонанса белков также продемонстрировала наличие больших гибких линкеров и концов во многих решенных структурных ансамблях. В настоящее время общепризнано, что белки существуют как ансамбль подобных структур, причем некоторые области более ограничены, чем другие. Внутренне неструктурированные белки (IUP) занимают крайний край этого спектра гибкости, тогда как IDP также включают белки со значительной тенденцией к локальной структуре или гибкие многодоменные сборки.Эти очень динамичные неупорядоченные области белков впоследствии были связаны с такими функционально важными явлениями, как аллостерическая регуляция и ферментативный катализ.
Многие неупорядоченные белки имеют аффинность связывания с их рецепторами, регулируемую посттрансляционной модификацией, поэтому было высказано предположение, что гибкость неупорядоченных белков способствует различным конформационным требованиям для связывания модифицирующих ферментов, а также их рецепторов. Внутреннее расстройство особенно обогащено белками, участвующими в клеточной передаче сигналов, транскрипции и функциях ремоделирования хроматина.
Гибкие линкеры
Неупорядоченные области часто встречаются в виде гибких линкеров или петель, соединяющих домены. Линкерные последовательности сильно различаются по длине, но обычно богаты полярными незаряженными аминокислотами. Гибкие линкеры позволяют соединяющим доменам свободно скручиваться и вращаться, чтобы рекрутировать своих партнеров по связыванию посредством динамики белковых доменов. Они также позволяют своим партнерам по связыванию вызывать крупномасштабные конформационные изменения с помощью дальнодействующей аллостерии.
Линейные мотивы
Линейные мотивы представляют собой короткие неупорядоченные сегменты белков, которые опосредуют функциональные взаимодействия с другими белками или другими биомолекулами (РНК, ДНК, сахара и т. д.).). Многие роли линейных мотивов связаны с клеточной регуляцией, например, с контролем формы клеток, субклеточной локализацией отдельных белков и регулируемым оборотом белков. Часто посттрансляционные модификации, такие как фосфорилирование, настраивают сродство (нередко на несколько порядков) отдельных линейных мотивов к конкретным взаимодействиям. В отличие от глобулярных белков, IDP не имеют пространственно расположенных активных карманов. Тем не менее, в 80% IDP (~ 3 дюжины), подвергнутых подробной структурной характеристике с помощью ЯМР, присутствуют линейные мотивы, называемые PreSMos (предварительно структурированные мотивы), которые представляют собой временные вторичные структурные элементы, предназначенные для распознавания мишеней.В нескольких случаях было продемонстрировано, что эти переходные структуры становятся полноценными и стабильными вторичными структурами, например, спиралями, при связывании с мишенью. Следовательно, PreSMos являются предполагаемыми активными сайтами у ВПЛ.
Парное складывание и переплет
Многие неструктурированные белки претерпевают переходы в более упорядоченные состояния при связывании со своими мишенями. Парное сворачивание и связывание могут быть локальными, вовлекая только несколько взаимодействующих остатков, или они могут вовлекать весь белковый домен.Недавно было показано, что совмещенное сворачивание и связывание позволяют закопать большую площадь поверхности, что было бы возможно только для полностью структурированных белков, если бы они были намного больше. Более того, определенные неупорядоченные области могут служить «молекулярными переключателями» в регуляции определенных биологических функций, переключаясь на упорядоченную конформацию при молекулярном распознавании, например, связывание малых молекул, связывание ДНК/РНК, взаимодействие ионов.
Расстройство в связанном состоянии (нечеткие комплексы)
Внутренне неупорядоченные белки могут сохранять свою конформационную свободу, даже если они специфически связываются с другими белками.Структурный беспорядок в связанном состоянии может быть статическим или динамическим. В нечетких комплексах для функционирования требуется структурная множественность, и манипуляции со связанными неупорядоченными участками изменяют активность. Конформационный ансамбль комплекса модулируется посредством посттрансляционных модификаций или белковых взаимодействий. Специфичность ДНК-связывающих белков часто зависит от длины нечетких участков, которая варьируется путем альтернативного сплайсинга. Внутренне неупорядоченные белки адаптируют множество различных структур in vivo в соответствии с условиями клетки, создавая структурный или конформационный ансамбль.
Таким образом, их структура тесно связана с функциями. Однако лишь немногие белки полностью разупорядочены в нативном состоянии. Нарушение в основном обнаруживается в внутренне неупорядоченных областях (IDR) в хорошо структурированном белке. Таким образом, термин внутренне неупорядоченный белок (IDP) включает белки, содержащие IDR, а также полностью неупорядоченные белки.
Существование и тип белкового нарушения закодированы в его аминокислотной последовательности.В целом ИДП характеризуются низким содержанием объемных гидрофобных аминокислот и высокой долей полярных и заряженных аминокислот, что обычно называют низкой гидрофобностью. Это свойство приводит к хорошему взаимодействию с водой. Кроме того, высокие суммарные заряды способствуют беспорядку из-за электростатического отталкивания, возникающего из-за одинаково заряженных остатков. Таким образом, неупорядоченные последовательности не могут в достаточной степени скрыть гидрофобное ядро, чтобы свернуться в стабильные глобулярные белки. В некоторых случаях гидрофобные кластеры в неупорядоченных последовательностях дают ключ к идентификации областей, которые подвергаются сопряженному сворачиванию и связыванию (обратитесь к биологическим ролям).
Многие неупорядоченные белки обнаруживают области без регулярной вторичной структуры. Эти области можно назвать гибкими по сравнению со структурированными петлями. В то время как последние являются жесткими и содержат только один набор углов Рамачандрана, IDP включают несколько наборов углов. Термин гибкость также используется для хорошо структурированных белков, но описывает другое явление в контексте неупорядоченных белков. Гибкость структурированных белков связана с равновесным состоянием, в отличие от IDP.Многие неупорядоченные белки также обнаруживают последовательности низкой сложности, т. е. последовательности с чрезмерным представлением нескольких остатков. Хотя последовательности низкой сложности являются явным признаком беспорядка, обратное не обязательно верно, то есть не все неупорядоченные белки имеют последовательности низкой сложности. Неупорядоченные белки имеют низкое содержание предсказанной вторичной структуры.
вернуться наверх
2.6 Сворачивание, денатурация и гидролиз белков
Сворачивание белка — это физический процесс, посредством которого белковая цепь приобретает свою нативную трехмерную структуру, конформацию, которая обычно биологически функциональна, быстрым и воспроизводимым образом (рис. 2.36). Это физический процесс, при котором полипептид сворачивается в свою характерную и функциональную трехмерную структуру из случайного клубка. Каждый белок существует в виде развернутого полипептида или случайного клубка при трансляции последовательности мРНК в линейную цепь аминокислот. У этого полипептида отсутствует какая-либо стабильная (длительная) трехмерная структура (левая часть первого рисунка). Поскольку полипептидная цепь синтезируется рибосомой, линейная цепь начинает складываться в свою трехмерную структуру.Сворачивание начинает происходить уже во время трансляции полипептидной цепи. Аминокислоты взаимодействуют друг с другом, образуя четко определенную трехмерную структуру, свернутый белок (правая часть рисунка), известный как нативное состояние. Результирующая трехмерная структура определяется аминокислотной последовательностью или первичной структурой (догма Анфинсена).
Рис. 2.36 Белок до и после сворачивания
Изображение: DrKjaergaard
Правильная трехмерная структура необходима для функционирования, хотя некоторые части функциональных белков могут оставаться развернутыми или, как в случае IDP, оставаться гибкими, так что важна динамика белка.Неспособность свернуться в нативную структуру обычно приводит к неактивным белкам, но в некоторых случаях неправильно свернутые белки имеют модифицированную или токсическую функциональность. Считается, что некоторые нейродегенеративные и другие заболевания возникают в результате накопления неправильно свернутых белков, таких как амилоидные фибриллы, обнаруженные у пациентов с болезнью Альцгеймера.
Складывание – это самопроизвольный процесс, который в основном направляется гидрофобными взаимодействиями, образованием внутримолекулярных водородных связей, силами Ван-дер-Ваальса, и ему противостоит конформационная энтропия.Процесс укладки часто начинается котрансляционно, так что N-конец белка начинает складываться, в то время как С-концевая часть белка все еще синтезируется рибосомой; однако молекула белка может спонтанно складываться во время или после биосинтеза. Хотя эти макромолекулы можно рассматривать как «сворачивающиеся», процесс также зависит от растворителя (вода или липидный бислой), концентрации солей, рН, температуры, возможного присутствия кофакторов и молекулярных шаперонов.Белки будут иметь ограничения на их способность складываться из-за ограниченных углов изгиба или возможных конформаций, как описано на графике Рамачандрана.
Рисунок 2.37 Гидрофобный коллапс. В компактной складке (справа) гидрофобные аминокислоты (показаны черными сферами) схлопываются по направлению к центру, защищаясь от водной среды.
Изображение: Tomixdf
Сворачивание белка должно быть термодинамически благоприятным внутри клетки, чтобы оно было спонтанной реакцией.Поскольку известно, что сворачивание белка является спонтанной реакцией, то она должна принимать отрицательное значение свободной энергии Гиббса. Свободная энергия Гиббса при сворачивании белка напрямую связана с энтальпией и энтропией. Для возникновения отрицательного ΔG и для того, чтобы фолдинг белка стал термодинамически благоприятным, благоприятными должны быть либо энтальпия, либо энтропия, либо оба члена.
Минимизация количества гидрофобных боковых цепей, подвергающихся воздействию воды, является важной движущей силой процесса складывания. Гидрофобный эффект (рис. 2.37) — это явление, при котором гидрофобные цепи белка коллапсируют в ядро белка (вдали от гидрофильной среды). В водной среде молекулы воды имеют тенденцию агрегировать вокруг гидрофобных областей или боковых цепей белка, создавая водные оболочки упорядоченных молекул воды. Упорядочивание молекул воды вокруг гидрофобной области увеличивает порядок в системе и, следовательно, способствует отрицательному изменению энтропии (меньше энтропии в системе).Молекулы воды зафиксированы в этих водяных клетках, что приводит к гидрофобному коллапсу или сворачиванию гидрофобных групп внутрь (рис. 2.38).
Рис. 2.38 Формирование водного клатрата. Хлороформ является гидрофобным соединением, поэтому при его растворении в воде с образованием гидрата гидрофобная гидратация сопровождается отрицательным изменением энтропии из-за повышенного порядка в окружающей воде и положительным изменением теплоемкости, что часто вызывает положительное ΔГ. Подобные водные клетки могут связываться вокруг гидрофобных белковых остатков до правильного фолдинга.
Гидрофобный коллапс возвращает энтропию в систему за счет разрушения водяных клеток, что высвобождает упорядоченные молекулы воды. Множество гидрофобных групп, взаимодействующих внутри ядра глобулярно свернутого белка, в значительной степени способствует стабильности белка после сворачивания из-за значительного накопления ван-дер-ваальсовых сил (в частности, лондонских дисперсионных сил).Гидрофобный эффект существует как движущая сила в термодинамике только при наличии водной среды с амфифильной молекулой, содержащей большой гидрофобный участок. Прочность водородных связей зависит от их окружения; таким образом, водородные связи, заключенные в гидрофобное ядро, вносят больший вклад, чем водородные связи, находящиеся в водной среде, в стабильность нативного состояния.
Сопровождающие
Молекулярные шапероны представляют собой класс белков, которые помогают в правильной укладке других белков in vivo (рис. 2.39). Шапероны существуют во всех клеточных компартментах и взаимодействуют с полипептидной цепью, чтобы обеспечить формирование нативной трехмерной конформации белка; однако сами шапероны не включаются в окончательную структуру белка, которому они помогают. Шапероны могут способствовать сворачиванию, даже когда рибосома синтезирует формирующийся полипептид. Молекулярные шапероны действуют путем связывания, чтобы стабилизировать в противном случае нестабильную структуру белка на пути его сворачивания, но шапероны не содержат необходимой информации, чтобы знать правильную нативную структуру белка, которому они помогают; скорее, шапероны работают, предотвращая неправильные конформации складывания.
Рисунок 2.39. Вид сверху на комплекс бактериальных шаперонов GroES/GroEL, модель
Изображение: Википедия
Таким образом, шапероны на самом деле не увеличивают скорость отдельных шагов, вовлеченных в путь сворачивания к нативной структуре; вместо этого они работают, уменьшая возможные нежелательные скопления полипептидной цепи, которые в противном случае могли бы замедлить поиск правильного промежуточного соединения, и они обеспечивают более эффективный путь для принятия полипептидной цепью правильных конформаций.Шапероны не следует путать с катализаторами фолдинга, которые на самом деле катализируют медленные этапы пути фолдинга. Примерами катализаторов укладки являются протеиндисульфидизомеразы и пептидилпролилизомеразы, которые могут участвовать в образовании дисульфидных связей или взаимопревращении между цис и транс стереоизомерами соответственно.
Показано, что шапероны имеют решающее значение в процессе сворачивания белка in vivo , потому что они обеспечивают белку помощь, необходимую для принятия его правильного выравнивания и конформации достаточно эффективно, чтобы стать «биологически релевантным».Это означает, что полипептидная цепь теоретически может складываться в свою нативную структуру без помощи шаперонов, как показано в экспериментах по сворачиванию белков, проведенных in vitro ; однако этот процесс оказывается слишком неэффективным или слишком медленным, чтобы существовать в биологических системах; следовательно, шапероны необходимы для сворачивания белка in vivo. Показано, что наряду со своей ролью в содействии формированию нативной структуры шапероны участвуют в различных ролях, таких как транспорт белков, деградация и даже позволяют денатурированным белкам, подвергающимся воздействию определенных внешних денатурирующих факторов, рефолдироваться в их правильные нативные структуры.
Денатурация белков
В полностью денатурированном белке отсутствует как третичная, так и вторичная структура, однако первичная последовательность белка остается неповрежденной, и белок существует в виде случайного клубка (рис. 2.39). При определенных условиях некоторые белки могут рефолдироваться; однако во многих случаях денатурация необратима. Клетки иногда защищают свои белки от денатурирующего воздействия тепла с помощью ферментов, известных как белки теплового шока (разновидность шаперонов), , которые помогают другим белкам как сворачиваться, так и оставаться свернутыми (рис. 2.40). Белки теплового шока экспрессируются в ответ на повышенные температуры или другие стрессы. Некоторые белки вообще никогда не сворачиваются в клетках, кроме как с помощью шаперонов, которые либо изолируют отдельные белки, чтобы их фолдинг не прерывался взаимодействиями с другими белками, либо помогают разворачивать неправильно свернутые белки, позволяя им сворачиваться в правильную нативную структуру. Эта функция имеет решающее значение для предотвращения риска осаждения нерастворимых аморфных агрегатов.
Рис. 2.40 Денатурация белков. На рисунке (1) изображен правильно свернутый интактный белок. На этапе (2) к системе применяется тепло, превышающее порог поддержания внутримолекулярных белковых взаимодействий. Шаг (3) показывает развернутый или денатурированный белок. Окрашенные области в денатурированном белке соответствуют окрашенным областям нативно свернутого белка, показанного на (1).
Схема предоставлена: Scurran15
Внешние факторы, участвующие в денатурации белков или нарушении нативного состояния, включают температуру, внешние поля (электрические, магнитные), молекулярную скученность и даже ограниченность пространства, которые могут иметь большое влияние на сворачивание белков.Высокие концентрации растворенных веществ, экстремальные значения pH, механические воздействия и присутствие химических денатурантов также могут способствовать денатурации белка. Эти отдельные факторы классифицируются вместе как стрессы. Показано, что шапероны существуют в возрастающих концентрациях во время клеточного стресса и помогают правильной укладке новых белков, а также денатурированных или неправильно свернутых.
При некоторых условиях белки не сворачиваются в свои биохимически функциональные формы.Температуры выше или ниже диапазона, в котором обычно живут клетки, заставят термически нестабильные белки разворачиваться или денатурировать (вот почему кипячение делает яичный белок непрозрачным). Однако термостабильность белков далека от постоянной; например, были обнаружены гипертермофильные бактерии, которые растут при температурах до 122 °C, что, конечно, требует, чтобы их полный набор жизненно важных белков и белковых комплексов был стабилен при этой температуре или выше.
Гидолиз
Гидролиз представляет собой разрушение первичной белковой последовательности путем добавления воды для преобразования мономерных звеньев отдельных аминокислот (рис. 2.41).
Рисунок 2.41 Гидролиз белков. В реакции гидролиза вода добавляется через амидную связь, включающую группу -ОН с карбонильным углеродом, и преобразует карбоновую кислоту. Водород из воды преобразует амин.
Белки участвуют во многих клеточных функциях. Белки могут действовать как ферменты, которые увеличивают скорость химических реакций. Фактически 99% ферментативных реакций внутри клетки опосредованы белками.Таким образом, они являются неотъемлемой частью процессов построения или разрушения клеточных компонентов. Белки также могут действовать как структурные леса внутри клетки, помогая поддерживать клеточную форму. Белки также могут участвовать в клеточной передаче сигналов и коммуникации, а также в транспорте молекул из одного места в другое. В экстремальных условиях, таких как голодание, белки также могут использоваться в качестве источника энергии внутри клетки.
вернуться наверх
2.7 Каталожные номера
OpenStax, Белки. OpenStax CNX. 30 сентября 2016 г. http://cnx.org/contents/bf17f4df-605c-4388-88c2-25b0f000b0ed@2.
Файл:Хиральность с руками.jpg. (2017, 16 сентября). Wikimedia Commons, бесплатный репозиторий мультимедиа . Получено 17:34, 10 июля 2019 г., с https://commons.wikimedia.org/w/index.php?title=File:Chirality_with_hands.jpg&oldid=258750003.
автора Википедии. (2019, 6 июля). Цвиттерион. В Википедия, Бесплатная энциклопедия .Получено 21:48, 10 июля 2019 г., с https://en.wikipedia.org/w/index.php?title=Zwitterion&oldid=
9721
.
автора Википедии. (2019, 8 июля). Абсолютная конфигурация. В Википедия, Бесплатная энциклопедия . Получено 15:28, 14 июля 2019 г., с https://en.wikipedia.org/w/index.php?title=Absolute_configuration&oldid=
2423
.
Структурная биохимия/фермент/активный центр. (2019, 1 июля). Викиучебники, Проект бесплатных учебников . Получено 16:55, 16 июля 2019 г., с https://en.wikibooks.org/w/index.php?title=Structural_Biochemistry/Enzyme/Active_Site&oldid=3555410.
Структурная биохимия/белки. (2019, 24 марта). Викиучебники, Проект бесплатных учебников . Получено 19:16, 18 июля 2019 г., с https://en.wikibooks.org/w/index.php?title=Structural_Biochemistry/Proteins&oldid=3529061.
Fujiwara, K., Toda, H., and Ikeguchi, M. (2012) Зависимость склонности аминокислот к α-спирали и β-слою от общего типа укладки белка. BMC Структурная биология 12:18.Доступно по ссылке: https://bmcstructbiol.biomedcentral.com/track/pdf/10.1186/1472-6807-12-18
автора Википедии. (2019, 16 июля). Кератин. В Википедия, Бесплатная энциклопедия . Получено 17:50, 19 июля 2019 г., с https://en.wikipedia.org/w/index.php?title=Keratin&oldid=
8340
.
автора Википедии. (2019, 13 июля). Альфа-кератин. В Википедия, Бесплатная энциклопедия . Получено 18:17, 19 июля 2019 г., с https://en.wikipedia.org/w/index.php?title=Альфа-кератин&oldid=
7410
Инициатива открытого обучения. (2019) Покровные уровни организации. Университет Карнеги Меллон. В анатомии и физиологии. Доступно по адресу: https://oli.cmu.edu/jcourse/webui/syllabus/module.do?context=43480020ca6010f804da8baf7ba.
автора Википедии. (2019, 16 июля). Коллаген. В Википедия, Бесплатная энциклопедия . Получено 03:42, 20 июля 2019 г., с https://en.wikipedia.org/w/index.php?title=Collagen&oldid=
9954
.
автора Википедии.(2019, 2 июля). Складка Россмана. В Википедия, Бесплатная энциклопедия . Получено 16:01, 20 июля 2019 г., с https://en.wikipedia.org/w/index.php?title=Rossmann_fold&oldid=
.
автора Википедии. (2019, 30 мая). ствол ТИМ. В Википедия, Бесплатная энциклопедия . Получено 16:46, 20 июля 2019 г., с https://en.wikipedia.org/w/index.php?title=TIM_barrel&oldid=899459569
.
автора Википедии. (2019, 16 июля). Сворачивание белков. В Википедия, Бесплатная энциклопедия .Получено 18:30, 20 июля 2019 г., с https://en.wikipedia.org/w/index.php?title=Protein_folding&oldid=
4145
.
автора Википедии. (2019, 11 июня). Глобулярный белок. В Википедия, Бесплатная энциклопедия . Получено 18:49, 20 июля 2019 г., с https://en.wikipedia.org/w/index.php?title=Globular_protein&oldid=
0467
.
автора Википедии. (2019, 11 июля). Внутренне неупорядоченные белки. В Википедия, Бесплатная энциклопедия . Получено 19:52, 20 июля 2019 г., с https://en.wikipedia.org/w/index.php?title=Intrinsically_disordered_proteins&oldid=2287
3.3A: Типы и функции белков
Белки выполняют множество важных физиологических функций, включая катализ биохимических реакций.
Цели обучения
- Различать типы и функции белков
Ключевые моменты
- Белки необходимы для основных физиологических процессов жизни и выполняют функции в каждой системе человеческого организма.
- Форма белка определяет его функцию.
- Белки состоят из субъединиц аминокислот, образующих полипептидные цепи.
- Ферменты катализируют биохимические реакции, ускоряя химические реакции, и могут либо расщеплять свой субстрат, либо строить более крупные молекулы из своего субстрата.
- Форма активного центра фермента соответствует форме субстрата.
- Гормоны представляют собой тип белка, используемого для передачи сигналов и связи между клетками.
Ключевые термины
- аминокислота : Любая из 20 встречающихся в природе α-аминокислот (имеющих амино- и карбоксильные группы на одном и том же атоме углерода) и различные боковые цепи, которые объединяются посредством пептидных связей с образованием белков.
- полипептид : любой полимер (одинаковых или разных) аминокислот, соединенных пептидными связями.
- катализатор : Для ускорения процесса.
Типы и функции белков
Белки выполняют важные функции во всех системах человеческого организма.Эти длинные цепочки аминокислот критически важны для:
- катализирующие химические реакции
- синтез и восстановление ДНК
- транспортировка материалов по камере
- получение и отправка химических сигналов
- в ответ на раздражители
- обеспечение структурной поддержки
Белки (полимеры) представляют собой макромолекулы, состоящие из субъединиц аминокислот (мономеров). Эти аминокислоты ковалентно связаны друг с другом, образуя длинные линейные цепи, называемые полипептидами, которые затем складываются в определенную трехмерную форму.Иногда эти свернутые полипептидные цепи функциональны сами по себе. В других случаях они объединяются с дополнительными полипептидными цепями, чтобы сформировать окончательную структуру белка. Иногда в конечном белке также требуются неполипептидные группы. Например, белок крови гемогобин состоит из четырех полипептидных цепей, каждая из которых также содержит молекулу гема, имеющую кольцевую структуру с атомом железа в центре.
Белки имеют разную форму и молекулярную массу в зависимости от аминокислотной последовательности.Например, гемоглобин представляет собой глобулярный белок, что означает, что он сворачивается в компактную шаровидную структуру, а коллаген, обнаруженный в нашей коже, является волокнистым белком, что означает, что он сворачивается в длинную вытянутую волокнообразную цепочку. Вы, вероятно, похожи на членов вашей семьи, потому что у вас одинаковые белки, но вы выглядите иначе, чем незнакомцы, потому что белки в ваших глазах, волосах и остальном теле отличаются.
Рисунок \(\PageIndex{1}\): Гемоглобин человека : Структура гемоглобина человека.Субъединицы α и β белков показаны красным и синим цветом, а железосодержащие гемовые группы — зеленым. Из базы белков.
Поскольку форма определяет функцию, любое незначительное изменение формы белка может привести к его дисфункции. Небольшие изменения в аминокислотной последовательности белка могут вызвать разрушительные генетические заболевания, такие как болезнь Гентингтона или серповидноклеточная анемия.
Ферменты
Ферменты — это белки, катализирующие биохимические реакции, которые в противном случае не происходили бы.Эти ферменты необходимы для химических процессов, таких как пищеварение и клеточный метаболизм. Без ферментов большинство физиологических процессов протекали бы так медленно (или вообще не протекали бы), что жизнь не могла бы существовать.
Поскольку форма определяет функцию, каждый фермент специфичен для своего субстрата. Субстраты – это реагенты, вступающие в химическую реакцию, катализируемую ферментом. Место, где субстраты связываются с ферментом или взаимодействуют с ним, известно как активный центр, потому что это место, где происходит химия.Когда субстрат связывается со своим активным центром фермента, фермент может способствовать его распаду, перестройке или синтезу. Придавая субстрату определенную форму и микроокружение в активном центре, фермент стимулирует протекание химической реакции. Существует два основных класса ферментов:
Рисунок \(\PageIndex{1}\): Ферментативная реакция : Катаболическая ферментативная реакция, показывающая, что субстрат точно соответствует форме активного центра.
- Катаболические ферменты: ферменты, расщепляющие свой субстрат
- Анаболические ферменты: ферменты, которые строят более сложные молекулы из своих субстратов
Ферменты необходимы для пищеварения: процесс расщепления больших молекул пищи на субъединицы, достаточно мелкие, чтобы диффундировать через клеточную мембрану и использоваться клеткой.К таким ферментам относятся амилаза, катализирующая переваривание углеводов во рту и тонком кишечнике; пепсин, катализирующий переваривание белков в желудке; липаза, которая катализирует реакции, необходимые для эмульгирования жиров в тонком кишечнике; и трипсин, который катализирует дальнейшее переваривание белков в тонком кишечнике.
Ферменты также необходимы для биосинтеза: процесса создания новых сложных молекул из более мелких субъединиц, которые предоставляются клетке или генерируются ею.Эти ферменты биосинтеза включают ДНК-полимеразу, которая катализирует синтез новых нитей генетического материала перед делением клетки; синтетаза жирных кислот, которая синтезирует новые жирные кислоты для образования жировых или мембранных липидов; и компоненты рибосомы, катализирующей образование новых полипептидов из мономеров аминокислот.
Гормоны
Некоторые белки функционируют как химические сигнальные молекулы, называемые гормонами. Эти белки секретируются эндокринными клетками, которые контролируют или регулируют определенные физиологические процессы, включая рост, развитие, обмен веществ и размножение.Например, инсулин — это белковый гормон, который помогает регулировать уровень глюкозы в крови. Другие белки действуют как рецепторы, определяя концентрацию химических веществ и отправляя ответные сигналы. Некоторые типы гормонов, такие как эстроген и тестостерон, являются липидными стероидами, а не белками.
Другие функции белка
Белки выполняют важные функции во всех системах человеческого организма. В дыхательной системе гемоглобин (состоящий из четырех белковых субъединиц) переносит кислород для использования в клеточном метаболизме.Дополнительные белки в плазме крови и лимфе переносят питательные вещества и продукты метаболизма по всему телу. Белки актин и тубулин образуют клеточные структуры, в то время как кератин формирует структурную поддержку мертвых клеток, которые становятся ногтями и волосами. Антитела, также называемые иммуноглобинами, помогают распознавать и уничтожать чужеродные патогены в иммунной системе. Актин и миозин позволяют мышцам сокращаться, а альбумин обеспечивает раннее развитие эмбриона или проростка.
Рисунок \(\PageIndex{1}\): Тубулин : структурный белок тубулин, окрашенный в красный цвет в клетках мыши.
2.4 Белок – Основы анатомии и физиологии
К концу этого раздела вы сможете:
- Описать функции белков в клетке и тканях
- Обсудите связь между аминокислотами и белками
- Объясните четыре уровня организации белков
- Опишите, как связаны форма и функция белка
Белки являются одними из самых распространенных органических молекул в живых системах и обладают самым разнообразным набором функций среди всех макромолекул.Белки могут быть структурными, регуляторными, сократительными или защитными. Они могут служить при транспортировке, хранении или мембранах; или они могут быть токсинами или ферментами. Каждая клетка живой системы может содержать тысячи белков, каждый из которых выполняет уникальную функцию. Их структура, как и их функции, сильно различаются. Однако все они представляют собой полимеры из 90 260 аминокислот и 90 261, расположенных в линейной последовательности.
Типы и функции белков
Ферменты, вырабатываемые живыми клетками, являются катализаторами биохимических реакций (например, пищеварения) и обычно представляют собой сложные или сопряженные белки.Каждый фермент специфичен для субстрата (реагента, который связывается с ферментом), на который он действует. Фермент может помочь в реакциях распада, перегруппировки или синтеза. Мы называем ферменты, расщепляющие свои субстраты, катаболическими ферментами. Те, которые строят из своих субстратов более сложные молекулы, являются анаболическими ферментами, а ферменты, влияющие на скорость реакции, — каталитическими ферментами. Отметим, что все ферменты увеличивают скорость реакции и, следовательно, являются органическими катализаторами. Примером фермента является амилаза слюны, которая гидролизует свой субстрат амилозу, компонент крахмала.
Гормоны — это химически сигнальные молекулы, обычно небольшие белки или стероиды, секретируемые эндокринными клетками, которые контролируют или регулируют определенные физиологические процессы, включая рост, развитие, метаболизм и размножение. Например, инсулин — это белковый гормон, который помогает регулировать уровень глюкозы в крови. В таблице 2.4.1 перечислены основные типы и функции белков.
Типы белков и их функции
Таблица 2.4.1. Виды белков и их функции.
| Тип | Примеры | Функции |
| Пищеварительные ферменты | Амилаза, липаза, пепсин, трипсин | Помощь пище путем катаболизма питательных веществ в мономерные единицы |
| Транспорт | Гемоглобин, альбумин | Переносят вещества с кровью или лимфой по всему телу |
| Структурный | Актин, тубулин, кератин | Создание различных структур, таких как цитоскелет |
| Гормоны | Инсулин, тироксин | Координация деятельности различных систем организма |
| Защита | Иммуноглобулины | Защита организма от чужеродных патогенов |
| Сократительный | Актин, миозин | Эффект сокращения мышц |
| Хранение | Запасные белки бобовых, яичный белок (альбумин) | Обеспечение питания в период раннего развития эмбриона и посева |
Белки имеют разную форму и молекулярную массу.Некоторые белки имеют глобулярную форму; тогда как другие имеют волокнистую природу, например, гемоглобин представляет собой глобулярный белок, а коллаген, расположенный в нашей коже, представляет собой волокнистый белок. Форма белка имеет решающее значение для его функции, и многие различные типы химических связей поддерживают эту форму. Изменения температуры, pH и воздействие химических веществ могут привести к необратимым изменениям формы белка, что приведет к потере функции или денатурации. Различное расположение одних и тех же 20 типов аминокислот составляют все белки.Недавно были обнаружены две новые редкие аминокислоты (селеноцистеин и пирролизин), и этот список может быть дополнен новыми открытиями.
Аминокислоты
Аминокислоты – это мономеры, из которых состоят белки. Каждая аминокислота имеет одинаковую фундаментальную структуру, состоящую из центрального атома углерода или альфа-( α ) углерода, связанного с аминогруппой (-Nh3), карбоксильной группой (-COOH) и атомом водорода. . Каждая аминокислота также имеет другой атом или группу атомов, связанных с центральным атомом, известную как группа R (рис. 2.4.1).
Рисунок 2.4.1. Аминокислоты. Аминокислоты имеют центральный асимметричный углерод, к которому присоединены аминогруппа, карбоксильная группа, атом водорода и боковая цепь (группа R).
Ученые используют название «аминокислота», потому что эти кислоты содержат в своей основной структуре как аминогруппу, так и карбоксильную группу. Как мы уже упоминали, в белках присутствует 20 распространенных аминокислот. Девять из них являются незаменимыми аминокислотами для человека, потому что человеческий организм не может их производить, и мы получаем их из нашего рациона.Для каждой аминокислоты группа R (или боковая цепь) различна (рис. 2.4.2).
Рисунок 2.4.2. Общие аминокислоты. В белках обычно встречается 20 аминокислот, каждая из которых имеет свою R-группу (вариантную группу), которая определяет ее химическую природу.
Какие категории аминокислот вы ожидаете обнаружить на поверхности растворимого белка, а какие — внутри? Какое распределение аминокислот вы ожидаете найти в белке, встроенном в двойной липидный слой?
Химическая природа боковой цепи определяет природу аминокислоты (то есть, является ли она кислотной, основной, полярной или неполярной).Например, аминокислота глицин имеет атом водорода в качестве группы R. Аминокислоты, такие как валин, метионин и аланин, являются неполярными или гидрофобными по своей природе, в то время как аминокислоты, такие как серин, треонин и цистеин, являются полярными и имеют гидрофильные боковые цепи. Боковые цепи лизина и аргинина заряжены положительно, поэтому эти аминокислоты также являются основными аминокислотами. Пролин имеет группу R, которая связана с аминогруппой, образуя кольцеобразную структуру. Пролин является исключением из стандартной структуры аминокислоты, поскольку его аминогруппа не отделена от боковой цепи (рис. 2.4.2).
Одна заглавная буква или трехбуквенная аббревиатура представляют собой аминокислоты, например, буква «V» или трехбуквенный символ «val» представляют собой аминокислоту валин. Так же, как некоторые жирные кислоты необходимы для диеты, некоторые аминокислоты также необходимы. Эти незаменимые аминокислоты для человека включают изолейцин, лейцин и цистеин. Незаменимые аминокислоты относятся к тем, которые необходимы для построения белков в организме, но не к тем, которые организм вырабатывает. Какие аминокислоты являются незаменимыми, варьируется от организма к организму.
Последовательность и количество аминокислот в конечном итоге определяют форму, размер и функцию белка. Ковалентная связь или пептидная связь присоединяется к каждой аминокислоте, которая образуется в результате реакции дегидратации. Карбоксильная группа одной аминокислоты и аминогруппа входящей аминокислоты объединяются, высвобождая молекулу воды. Образовавшаяся связь представляет собой пептидную связь (рис. 2.4.3).
Рисунок 2.4.3. Пептидная связь. Образование пептидной связи является реакцией синтеза дегидратации.Карбоксильная группа одной аминокислоты связана с аминогруппой входящей аминокислоты. При этом выделяется молекула воды.
Продукты, образуемые такими связями, представляют собой пептиды. По мере того, как к этой растущей цепи присоединяется больше аминокислот, результирующая цепь представляет собой полипептид. Каждый полипептид имеет свободную аминогруппу на одном конце. Этот конец является N-концом или амино-концом, а другой конец имеет свободную карбоксильную группу, а также С-конец или карбоксильный конец. Хотя термины «полипептид» и «белок» иногда используются взаимозаменяемо, полипептид технически представляет собой полимер аминокислот, тогда как термин «белок» используется для полипептида или полипептидов, которые объединены вместе, часто имеют связанные непептидные простетические группы, имеют четкую форму. , и имеют уникальную функцию.После синтеза белка (трансляции) большинство белков модифицируются. Они известны как посттрансляционные модификации. Они могут подвергаться расщеплению, фосфорилированию или могут потребовать добавления других химических групп. Только после этих модификаций белок становится полностью функциональным.
Соединение эволюции
Эволюционное значение цитохрома c
Цитохром с является важным компонентом цепи переноса электронов, частью клеточного дыхания, и обычно он находится в клеточных органеллах, митохондриях.Этот белок имеет простетическую группу гема, и центральный ион гема попеременно восстанавливается и окисляется во время переноса электрона. Поскольку роль этого незаменимого белка в производстве клеточной энергии имеет решающее значение, она очень мало изменилась за миллионы лет. Секвенирование белка показало, что у разных видов существует значительная степень гомологии аминокислотной последовательности цитохрома с. Другими словами, мы можем оценить эволюционное родство, измеряя сходства или различия между последовательностями ДНК или белков разных видов.
Ученые определили, что цитохром с человека содержит 104 аминокислоты. Для каждой молекулы цитохрома с из разных организмов, которую ученые секвенировали на сегодняшний день, 37 из этих аминокислот появляются в одном и том же положении во всех образцах цитохрома с. Это указывает на то, что у них мог быть общий предок. При сравнении последовательностей белков человека и шимпанзе ученые не обнаружили различий в последовательностях. Когда исследователи сравнили последовательности человека и макаки-резус, единственное отличие было в одной аминокислоте.В другом сравнении секвенирование человека и дрожжей показывает разницу в 44-м положении.
Белковая структура
Как обсуждалось ранее, форма белка имеет решающее значение для его функции, например, фермент может связываться с определенным субстратом в активном центре. Если этот активный центр изменен из-за локальных изменений или изменений в общей структуре белка, фермент может быть неспособен связываться с субстратом. Чтобы понять, как белок приобретает свою окончательную форму или конформацию, нам необходимо понять четыре уровня структуры белка: первичный, вторичный, третичный и четвертичный.
Первичная структура
Уникальной последовательностью аминокислот в полипептидной цепи является ее первичная структура . Например, гормон поджелудочной железы инсулин имеет две полипептидные цепи, А и В, и они связаны друг с другом дисульфидными связями. N-концевая аминокислота цепи А представляет собой глицин; тогда как С-концевая аминокислота представляет собой аспарагин (рис. 2.4.4). Аминокислотные последовательности в цепях А и В уникальны для инсулина.
Рисунок 2.4.4. Аминокислотная последовательность инсулина бычьей сыворотки .Инсулин бычьей сыворотки представляет собой белковый гормон, состоящий из двух пептидных цепей: А (длиной 21 аминокислота) и В (длиной 30 аминокислот). В каждой цепочке трехбуквенные аббревиатуры, представляющие названия аминокислот в том порядке, в котором они присутствуют, указывают на первичную структуру. Аминокислота цистеин (цис) имеет сульфгидрильную (SH) группу в качестве боковой цепи. Две сульфгидрильные группы могут реагировать в присутствии кислорода с образованием дисульфидной (S-S) связи. Две дисульфидные связи соединяют цепи А и В вместе, а третья помогает цепи А принять правильную форму.Обратите внимание, что все дисульфидные связи имеют одинаковую длину, но для ясности мы нарисовали их разного размера.
Ген, кодирующий белок, в конечном итоге определяет уникальную последовательность для каждого белка. Изменение нуклеотидной последовательности кодирующей области гена может привести к добавлению другой аминокислоты к растущей полипептидной цепи, вызывая изменение структуры и функции белка. При серповидноклеточной анемии в цепи гемоглобина β (небольшая часть которой показана на рис. 2.4.5) имеется единственная аминокислотная замена, вызывающая изменение структуры и функции белка.В частности, валин в цепи β заменяет глутаминовую аминокислоту. Что наиболее примечательно, так это то, что молекула гемоглобина состоит из двух альфа- и двух бета-цепей, каждая из которых состоит примерно из 150 аминокислот. Молекула, следовательно, имеет около 600 аминокислот. Структурная разница между молекулой нормального гемоглобина и молекулой серповидноклеточной анемии, которая резко сокращает продолжительность жизни, заключается в одной аминокислоте из 600. Что еще более примечательно, так это то, что три нуклеотида каждая кодирует эти 600 аминокислот, а изменение одного основания (точечная мутация), 1 из 1800 оснований вызывает мутацию.
Рисунок 2.4.5. Аминокислотный состав гемоглобина. Бета-цепь гемоглобина имеет длину 147 остатков, но одна аминокислотная замена приводит к серповидно-клеточной анемии. В нормальном гемоглобине аминокислотой в седьмом положении является глутамат. В серповидноклеточном гемоглобине валин заменяет глутамат.
Из-за этой замены одной аминокислоты в цепи молекулы гемоглобина образуют длинные волокна, которые деформируют двояковогнутые или дискообразные эритроциты и заставляют их принимать серповидную или «серповидную» форму, что закупоривает кровеносные сосуды (рис. 2.4.6). Это может привести к множеству серьезных проблем со здоровьем, таких как одышка, головокружение, головные боли и боли в животе у тех, кто страдает этим заболеванием.
Рисунок 2.4.6. Мазок крови. В этом мазке крови, визуализированном при 535-кратном увеличении с использованием светлопольной микроскопии, серповидные клетки имеют форму полумесяца, а нормальные клетки имеют форму диска. (Источник: модификация работы Эда Утмана; данные масштабной линейки от Мэтта Рассела).
Вторичная структура
Локальная укладка полипептида в некоторых областях приводит к возникновению вторичной структуры белка.Наиболее распространенными являются α — спиральная и β — складчатая листовая структура (рис. 2.4.7). Обе структуры удерживаются в форме водородными связями. Водородные связи образуются между атомом кислорода в карбонильной группе одной аминокислоты и другой аминокислотой, которая находится на четыре аминокислоты дальше по цепи.
Рисунок 2.4.7. Вторичная структура белка. α -спираль и β -складчатый лист представляют собой вторичные структуры белков, которые образуются из-за водородных связей между карбонильными и аминогруппами в пептидном остове.Некоторые аминокислоты имеют склонность к образованию α -спирали, в то время как другие имеют склонность к образованию складчатого листа β .
Каждый спиральный виток в альфа-спирали имеет 3,6 аминокислотных остатка. Группы R полипептида (вариантные группы) выступают из α -спиральной цепи. В складчатом листе β водородные связи между атомами в основной цепи полипептида образуют «складки». Группы R присоединены к атомам углерода и простираются выше и ниже складок складки.Складчатые сегменты располагаются параллельно или антипараллельно друг другу, а водородные связи образуются между частично положительным атомом водорода в аминогруппе и частично отрицательным атомом кислорода в карбонильной группе пептидного остова. Структуры α -спирали и β -складчатые листы присутствуют в большинстве глобулярных и волокнистых белков и играют важную структурную роль.
Третичная структура
Уникальной трехмерной структурой полипептида является его третичная структура (рис. 2.4.8). Эта структура частично обусловлена химическими взаимодействиями в полипептидной цепи. В первую очередь, взаимодействия между группами R создают сложную трехмерную третичную структуру белка. Природа групп R в задействованных аминокислотах может противодействовать образованию водородных связей, которые мы описали для стандартных вторичных структур. Например, группы R с одинаковыми зарядами отталкиваются друг от друга, а группы с разными зарядами притягиваются друг к другу (ионные связи). Когда происходит сворачивание белка, гидрофобные R-группы неполярных аминокислот находятся внутри белка; тогда как гидрофильные группы R лежат снаружи.Ученые также называют первые типы взаимодействия гидрофобными взаимодействиями. Взаимодействие между боковыми цепями цистеина образует дисульфидные связи в присутствии кислорода, единственную ковалентную связь, которая образуется во время фолдинга белка.
Рисунок 2.4.8. Третичная структура белка. Разнообразие химических взаимодействий определяет третичную структуру белков. К ним относятся гидрофобные взаимодействия, ионная связь, водородная связь и дисульфидные связи.
Все эти взаимодействия, слабые и сильные, определяют окончательную трехмерную форму белка.Когда белок теряет свою трехмерную форму, он может больше не функционировать.
Четвертичная структура
В природе некоторые белки формируются из нескольких полипептидов или субъединиц, и взаимодействие этих субъединиц образует четвертичную структуру . Слабые взаимодействия между субъединицами помогают стабилизировать общую структуру. Например, инсулин (глобулярный белок) имеет комбинацию водородных и дисульфидных связей, которые заставляют его в основном слипаться в форму шара.Инсулин начинается как один полипептид и теряет некоторые внутренние последовательности в присутствии посттрансляционной модификации после образования дисульфидных связей, которые удерживают вместе оставшиеся цепи. Однако шелк (волокнистый белок) имеет β складчатую листовую структуру, которая является результатом водородных связей между различными цепями.
На рис. 2.4.9 показаны четыре уровня структуры белка (первичный, вторичный, третичный и четвертичный).
Рис 2.4.9. Уровни структуры белка. Обратите внимание на четыре уровня структуры белка на этих иллюстрациях. (Источник: модификация работы Национального института исследования генома человека).
Денатурация и сворачивание белков
Каждый белок имеет свою уникальную последовательность и форму, которые скрепляются химическими взаимодействиями. Если белок подвержен изменениям температуры, pH или воздействию химических веществ, структура белка может измениться, потеряв свою форму без потери своей первичной последовательности в результате того, что ученые называют денатурацией .Денатурация часто бывает обратимой, потому что первичная структура полипептида сохраняется в процессе, если денатурирующий агент удален, что позволяет белку возобновить свою функцию. Иногда денатурация необратима и приводит к потере функции. Одним из примеров необратимой денатурации белка является жарка яиц. Белок альбумин в жидком яичном белке денатурирует при помещении на горячую сковороду. Не все белки денатурируют при высоких температурах. Например, бактерии, которые выживают в горячих источниках, имеют белки, функционирующие при температурах, близких к температуре кипения.Желудок также очень кислый, имеет низкий pH и денатурирует белки в процессе пищеварения; однако в этих условиях пищеварительные ферменты желудка сохраняют свою активность.
Сворачивание белка имеет решающее значение для его функции. Первоначально ученые думали, что сами белки ответственны за процесс сворачивания. Только недавно исследователи обнаружили, что часто они получают помощь в процессе фолдинга от белков-помощников или шаперонов (или шаперонинов), которые связываются с белком-мишенью в процессе фолдинга.Они действуют, предотвращая агрегацию полипептидов, составляющих полную структуру белка, и диссоциируют от белка, как только целевой белок свернут.
Белки представляют собой класс макромолекул, выполняющих разнообразные функции в клетке. Они помогают в обмене веществ, действуя как ферменты, переносчики или гормоны, и обеспечивают структурную поддержку. Строительными блоками белков (мономеры) являются аминокислоты. Каждая аминокислота имеет центральный углерод, который связан с аминогруппой, карбоксильной группой, атомом водорода и группой R или боковой цепью.Существует 20 часто встречающихся аминокислот, каждая из которых отличается группой R. Пептидная связь связывает каждую аминокислоту с соседними. Длинная цепь аминокислот представляет собой полипептид.
Белки организованы на четырех уровнях: первичном, вторичном, третичном и (необязательно) четвертичном. Первичная структура представляет собой уникальную последовательность аминокислот. Локальная укладка полипептида с образованием таких структур, как α -спираль и β -складчатый лист, составляет вторичную структуру.Общая трехмерная структура является третичной структурой. Когда два или более полипептида объединяются, чтобы сформировать полную структуру белка, конфигурация представляет собой четвертичную структуру белка. Форма и функция белка неразрывно связаны. Любое изменение формы, вызванное изменением температуры или рН, может привести к денатурации белка и потере его функции.
Щелкните раскрывающийся список ниже, чтобы просмотреть термины, изученные в этой главе.
Примечание: Содержимое и изображения из этой главы были адаптированы из 2-го издания биологии Мэри Энн Кларк, Юнга Чоя и Мэтью Дугласа и использованы по лицензии CC-BY.
Исследование разделения структурных типов белков в пространстве признаков аминокислотной последовательности
Abstract
Белки разнообразны своими последовательностями, структурами и функциями, поэтому важно изучить отношения между последовательностями, структурами и функциями. В этой статье мы проводим исследование, которое исследует отношения между белковыми последовательностями и их структурами. В этом исследовании мы используем признаки естественного вектора (NV) и фактора усредненных свойств (APF) для представления белковых последовательностей в векторах признаков, а также используем мультиклассовый метод MSE и методы выпуклой оболочки для разделения белков разных структурных классов на разные регионы.Мы обнаружили, что белки из разных структурных классов можно разделить гиперплоскостями и выпуклыми оболочками в естественном векторном пространстве признаков, где векторы признаков разных структурных классов разделены на непересекающиеся области или выпуклые оболочки в многомерных пространствах признаков. Естественный вектор превосходит метод усредненного коэффициента свойства при идентификации структур, а метод выпуклой оболочки превосходит мультиклассовый MSE при разделении характерных точек. Эти результаты подтверждают сильные связи между белковыми последовательностями и их структурами и могут означать, что состав аминокислот и расположение их последовательностей, представленных природными векторами, оказывают большее влияние на структуры, чем усредненные факторы физических свойств аминокислот.
Образец цитирования: Wan X, Tan X (2019) Исследование разделения структурных типов белков в пространстве признаков аминокислотной последовательности. ПЛОС ОДИН 14(12):
e0226768.
https://doi.org/10.1371/journal.pone.0226768
Редактор: Джинн-Мун Ян, Колледж биологических наук и технологий Национального университета Цзяодун, ТАЙВАНЬ
Поступила в редакцию: 16 июля 2019 г.; Принято: 3 декабря 2019 г.; Опубликовано: 23 декабря 2019 г.
Copyright: © 2019 Wan, Tan.Это статья с открытым доступом, распространяемая в соответствии с условиями лицензии Creative Commons Attribution License, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии указания автора и источника.
Доступность данных: Все соответствующие данные содержатся в рукописи и файлах вспомогательной информации.
Финансирование: Автор(ы) не получали специального финансирования для этой работы.
Конкурирующие интересы: Авторы заявили об отсутствии конкурирующих интересов.
Введение
Белок является важным органическим веществом в жизни. Он разнообразен по своей последовательности, структуре и функциям [1–7]. Считается, что на функции белков влияет их структура, а на структуру белков — их последовательность [1–7]. Структурная классификация/предсказание структуры белков является горячей темой исследований в области биоинформатики, в которых особое внимание уделяется отношениям между последовательностями белков и их структурами [8-16].
Типичными методами классификации/предсказания структуры белка являются e.г. методы искусственных нейронных сетей, методы ближайших соседей, методы опорных векторов [17]. Ding C и Dubchak I предложили два новых метода: уникальный метод «один против других» и метод «все против всех» в классификации белковых складок [8]. Эдлер Л. и Грассманн Дж. представили метод статистической классификации, включающий нейронные сети с прямой связью (FFN) для различения и прогнозирования классов укладки белков [9]. Huang C., Lin C. и Pal N представили три новые идеи для мультиклассовой классификации укладки белков [10].Джо Т. и др. разработали сетевой метод глубокого обучения (DN-Fold), чтобы предсказать, принадлежит ли данная пара белков запроса-шаблона к одной и той же структурной складке [11]. Хан М., Шахзад В. и Байг А. использовали технику анализа ассоциативных правил — ACO-AC для решения проблемы классификации белков в правильном наборе данных SCOP [12]. Марковец Ф., Эдлер Л. и Вингрон М. сравнили производительность машин опорных векторов (SVM) с методами нейронных сетей и стандартными методами статистической классификации, такими как дискриминантный анализ и классификация ближайших соседей, и обнаружили, что SVM представляют собой многообещающую альтернативу стандартной статистической классификации. и методы прогнозирования в функциональной геномике [13].Tan A, Gilbert D и Deville Y предложили новый метод машинного обучения ансамбля, который улучшает охват классификаторов в несбалансированных выборках из нескольких классов за счет интеграции знаний, полученных из разных базовых классификаторов [14]. Wei L и др. предложили новый таксономический метод предсказания укладки белка, названный PFPA, который характеризуется объединением нового набора признаков с помощью ансамблевого классификатора [15]. Wei L и Zou Q провели всестороннее обзорное исследование, посвященное последним вычислительным методам, особенно методам, основанным на машинном обучении, для распознавания белковых складок [16].Почти все методы используют информацию о последовательности белка для классификации/предсказания укладки белка.
В этой статье мы сосредоточимся на основных структурных классах CATH и SCOP. База данных CATH имеет три основных структурных класса, а именно преимущественно α-структуры, преимущественно β-структуры и смешанные α- и β-структуры [17–18]. База данных SCOP допускает четыре основных структурных класса, а именно все α-структуры, все β-структуры, α+β-структуры, α/β-структуры [17]. В этом исследовании мы используем репрезентативные методы признаков последовательностей белков, а именно естественный вектор [4] и фактор усредненных свойств [18], чтобы представить белковые последовательности в векторах признаков с действительными значениями.Естественный вектор интерпретирует аминокислотный состав и расположение последовательностей белковых последовательностей, в то время как фактор усредненных свойств интерпретирует физические свойства аминокислот для белковых последовательностей. Мы используем многоклассовый метод минимальной квадратичной ошибки (сокращенно многоклассовый MSE) метод классификации [19] и классификатор выпуклой оболочки [20] для разделения различных структурных классов в пространствах признаков. Мы обнаружили, что естественные векторы разных структурных классов отделимы гиперплоскостями MSE и выпуклыми оболочками, что указывает на то, что естественные векторы разных структурных классов занимают разные области в многомерном пространстве признаков.Установлено, что метод естественных векторов превосходит метод усредненных факторов свойств при идентификации структур. В этом исследовании рассматривается важность аминокислотного состава и расположения последовательностей при идентификации структур, а также тесные связи между белковыми последовательностями и их структурами.
Этот документ организован следующим образом. В разделе «Материалы и методы» мы приводим математическую формулу естественного вектора и коэффициент усредненного свойства для выделения признаков, а также вводим мультиклассовые методы MSE и выпуклой оболочки для разделения точек признаков.Мы определяем скорости классификации для методов MSE и выпуклых оболочек, чтобы количественно оценить разделение характерных точек. В разделе «Результаты» мы описываем исследования моделирования для трех наборов данных CATH и четырех наборов данных SCOP, где мы сравниваем наш анализ признаков с методами признаков PseAAC [21–23] и PSSM [24–25] и сравниваем анализ классификации с SVM. [26] и методом случайного леса [27–28]. В разделе «Обсуждение» обсуждаются результаты и эффективность структурного разделения, а также преимущества и недостатки методов признаков и методов классификации.Наконец, выводы этой статьи сделаны в разделе «Выводы». Данные этой статьи полностью доступны и могут быть найдены в разделе вспомогательной информации.
Материалы и методы
В этом разделе мы описываем методы естественного вектора (NV) и усредненного фактора свойства (APF) для выделения признаков белковой последовательности, многоклассовые методы MSE и методы выпуклой оболочки для классификации характерных точек, где мы определить понятие скорости классификации, которая количественно определяет качество разделения характерных точек.Все эти методы выделения признаков и классификации часто используются в исследованиях по классификации белков [4–6, 18–20].
Методы выделения белковых последовательностей
Естественный вектор (NV) и фактор усредненных свойств (APF) представляют собой два репрезентативных метода выделения последовательностей белков, которые представляют последовательности белков с разных сторон.
Метод естественных векторов.
Метод естественного вектора — это популярный метод извлечения признаков последовательности, который вычисляет состав и расположение последовательностей 20 типов аминокислот {A, R, N, D, C, E, Q, G, H, I, L, K, M, F, P, S, T, W, Y, V} в последовательности белка [4].Этот метод отображает каждую белковую последовательность в многомерный реальный вектор, который однозначно представляет последовательность. Белковая последовательность обычно состоит из 20 типов аминокислот {A, R, N, D, C, E, Q, G, H, I, L, K, M, F, P, S, T, W, Y , В}. Различные белковые последовательности различаются частотой и расположением этих 20 аминокислот. Природный вектор, в частности, использует преимущества этих природных параметров для интерпретации белковых последовательностей.
Природный вектор белковой последовательности состоит из трех основных частей.Во-первых, природный вектор содержит количества 20 аминокислот в белковой последовательности, которые обозначаются 20 целыми числами n A , n R , 9045 45 n
, …, н В . Во-вторых, натуральный вектор содержит средние арифметические значения суммарного расстояния для каждой из 20 аминокислот [4]:
(1)
он описывает среднее расстояние k типов аминокислот от начала координат, s [ k ][ i ] представляет собой расстояние от первой аминокислоты (рассматриваемой как происхождение) до i-й аминокислоты k в последовательности обозначает общее расстояние каждой из k аминокислот до начала координат [4].Третья часть состоит из нормированных центральных моментов, определенных по [4]:
(2)
где k представляет 20 типов аминокислот в {A, R, N, D, C, E, Q, G, H, I, L, K, M, F, P, S, T, W, Y, V }, n k , s [ k ][ i ] и определены выше.
Окончательный натуральный вектор представляет собой многомерный действительный вектор, записанный как [4]:
(3)
Если конкретной аминокислоты k не существует, то n K , μ K , и являются нулями.
Математически соответствие между последовательностью белка и его природным вектором является взаимно-однозначным [4]. Как было теоретически доказано в [4], все центральные моменты 1-го -го порядка равны нулю, поэтому нам не нужно вычислять их в натуральном векторе.
Размерность естественного вектора достаточно велика, что может быть неэффективным в вычислениях. Однако высшие центральные моменты очень быстро стремятся к нулю [4], так что высокие центральные моменты практически не вносят вклада.Поэтому мы можем использовать только несколько первых центральных моментов. На практике N = 2 уже позволяет получать устойчивые классифицированные результаты, включение центральных моментов более высокого порядка не меняет результатов [4]. Поэтому мы используем 60-мерный натуральный вектор с N = 2, представленный следующим образом [4]:
(4)
60-мерный естественный вектор однозначно характеризует каждую белковую последовательность, мы вычисляем 60-мерные натуральные векторы для всех белковых последовательностей в наборах данных.
Метод усредненного коэффициента свойства (APF).
С. Раковский изобретает метод извлечения признаков белковой последовательности, названный методом среднего фактора свойства (APF) [18]. Он использует 10 физических свойств аминокислот для представления белковых последовательностей. 10 свойств аминокислот: 1. предпочтение альфа-спирали/изгиба; 2. Размер боковой цепи; 3. Предпочтение расширенной структуры; 4. Гидрофобность; 5. Двойной изгиб; 6. Аминокислотный состав; 7. Плоский расширенный преферанс; 8.Наличие в регионе; 9. пк; 10. Окружающая гидрофобность. В этом методе аминокислота X представлена 10-вектором [18]
(5)
где X = A, R, N, D, C, E, Q, G, H, I, L, K, M, F, P, S, T, W, Y, V. В этом выражении значение m-го фактора свойства аминокислоты X, m = 1, 2, …, 10, X = A, R, N, D, C, E, Q, G, H, I, L, K, M , F, P, S, T, W, Y, V. Значения 10 факторов свойств для каждой из 20 аминокислот определены и рассчитаны Кидерой и его сотрудниками [29–30], которые суммированы в таблице S1. в разделе вспомогательной информации.
Для каждой последовательности S в базе данных усредненное по последовательности значение фактора m-го свойства определяется как [18]:
(6)
где N S — количество остатков в последовательности.
Вектор фактора усредненных свойств (APF) также можно вычислить для предопределенного набора Q. Например, у нас есть набор N Q белковых последовательностей в наборе Q, каждая последовательность соответствует 10-мерному усредненному вектор фактора свойства, поэтому получаем N Q таких векторов в множестве Q.Векторы усредненных факторов свойств можно усреднить по последовательностям N Q и получить один 10-мерный вектор APF:
(7)
как представление АПФ для множества последовательностей Q [18]. В этом выражении каждая компонента
(8)
– среднее значение m-го компонента (фактора свойства) по N Q последовательностей в наборе Q.
В нашем исследовании мы вычисляем 10-мерный усредненный вектор фактора свойства
(9)
для каждой белковой последовательности S в наборах данных.
Методы структурной идентификации
Сначала мы используем естественный вектор и фактор усредненного свойства для вычисления векторов признаков для каждой белковой последовательности, затем мы используем многоклассовые классификаторы MSE [19] и выпуклой оболочки [20] для определения гиперплоскостей и границ выпуклой оболочки. которые разделяют различные структурные классы. Чтобы количественно оценить качество разделения, мы определяем понятие скорости классификации для классификаторов.
Мультиклассовый MSE.
Векторы естественного вектора и усредненного коэффициента свойства являются 60- и 10-мерными действительными векторами в многомерных пространственных признаках.Простая идея состоит в том, чтобы использовать классификатор минимальной квадратичной ошибки (MSE) для вычисления многомерных гиперплоскостей, которые разделяют характерные точки разных классов на непересекающиеся области.
Первоначальный классификатор MSE представляет собой метод двойной классификации, который классифицирует реальное пространство на две непересекающиеся области [19]. Учитывая выборочные точки двух классов, задача классификации с минимальной квадратичной ошибкой (MSE) состоит в том, чтобы найти границу решения, т. е. гиперплоскость, которая разделяет точки из двух классов на разные области, где квадраты расстояний выборки указывают на границу решения. сведен к минимуму.Возьмите n-мерное реальное пространство в качестве примера, граница решения может быть выражена линейным уравнением
(10)
Где A = ( A 0 , A 1 , ⋯, A N ) T — это вес веса. Проблема в классификации MSE состоит в том, чтобы найти вектор весов a , который минимизирует квадраты ошибок. Это может быть решено с помощью градиента, а результаты могут быть выражены псевдообратным выражением [19]
(11)
где X — размерная матрица размером m × ( n + 1), строки которой представляют собой дополненные векторы, составленные из n-мерных точек выборки и одномерного знака классов.
На практике часто приходится классифицировать множество классов, поэтому в классификациях обычно требуется многоклассовый классификатор MSE.
Предположим, что необходимо классифицировать c классов, а векторные точки имеют d-размерность, задача классификации мультиклассовой MSE может быть описана как задача с c линейными дискриминантными функциями [19]:
(12)
где x — d-мерный вектор-столбец. Для (d-мерной) векторной точки x многоклассовый классификатор MSE классифицирует точку x по классу ω i if g i ( x 45 g 9084 ) 4 > j ( x ), для всех j ≠ i [19].
В вычислениях мультиклассовый метод MSE направлен на вычисление матрицы d × c взвешенных векторов для c гиперплоскостей, разделяющих векторные точки на c непересекающихся областей в d-мерном реальном пространстве [19].
Пусть X — матрица обучающей выборки размера n × d, которую можно записать в виде [19]
Каждая X i является выборочной матрицей i-го класса, строки которой состоят из выборочных векторов, т.е. натуральных векторов i-го класса.
Пусть B — матрица размера n × c, записанная в виде [19]
где i-й столбец каждого B i — единицы, а остальные столбцы — нули.
В этих обозначениях получаем решение многоклассовой задачи классификации СКО, т.е. матрицу взвешенных векторов A [19]:
(13)
которое является решением, которое минимизирует сумму диагональных элементов в квадрате матрицы ошибок ( XA − B ) T ( XA − B ).Вот, x + = ( x T ) -1 — x
Как только матрица A взвешенных векторов получена, мы относим каждую d-мерную векторную точку x к классу ω i , используя критерий: г j ( x ), для всех j ≠ i [19].
Для векторов признаков структурного класса i мы используем соотношение
(14)
для количественной оценки качества разделения, которое называется скоростью классификации для структурного класса. В этих обозначениях N i — количество белков (т. е. количество характерных точек) в структурном классе N i баллов), которые правильно отнесены к структурному классу i мультиклассовым классификатором MSE, i относится к индексу структурного класса, где i = {в основном − α , в основном − β, смешанные α и β} для CATH и i = {all − α, all − β, α + β, α/β} для SCOP [17].Здесь мы используем функции последовательности белков для разделения структур, где мы стремимся проверить, можно ли разделить различные структурные классы по функциям последовательности.
Классификация выпуклого корпуса.
Выпуклая оболочка — это вычислительная геометрическая концепция, которая часто используется для эволюционной классификации геномов [20]. Он использует границы выпуклых многоугольников для классификации векторных точек на выпуклые оболочки в реальном пространстве. Для данного набора точек X в (многомерном) реальном пространстве V выпуклая оболочка S является пересечением всех выпуклых множеств, которые окружают данное множество точек X.Выпуклая оболочка S множества X может быть построена с помощью выпуклой комбинации всех точек { X 1 , X 2 , …, X n 2 [0 } в множестве X ].
В вычислениях мы используем функцию набора инструментов Matlab для вычисления границ выпуклой оболочки для многомерных характерных точек и расчета количества точек в каждой выпуклой оболочке.
Для векторов признаков белков различных структурных классов мы сначала вычисляем границы выпуклой оболочки для каждого структурного класса, используя все характерные точки в этом классе.Затем мы подсчитываем количество точек, которые «исключительно» находятся внутри выпуклой оболочки каждого класса. Мы используем эти выпуклые оболочки, чтобы проверить, отделимы ли различные структурные классы с точки зрения характерных точек. Чтобы количественно оценить разделение характерных точек, мы подсчитываем количество характерных точек, которые находятся исключительно внутри выпуклой оболочки структурного класса и , и используем следующее соотношение
(15)
чтобы вычислить скорость классификации для структурного класса i , где N i по-прежнему обозначает количество белков (т.е. число характерных точек) в и -м конструктивном классе, а А и — число характерных точек (среди N и точек), которые исключительно заключены в выпуклые корпус и -го конструктивного класса. Здесь i = {в основном — α, в основном — β, смешанные α и β} для CATH и i = {все — α, все — β, α + β, α/β} для SCOP. В этом контексте «исключительность» относится к характерным точкам, которые находятся исключительно внутри или на границе и -й выпуклой оболочки и не появляются в других выпуклых оболочках, т.е.е. мы ищем разделение выпуклой оболочки для характерных точек различных структурных классов.
На практике расчет выпуклых оболочек имеет высокую вычислительную сложность, поэтому многомерные векторы признаков разбиваются на небольшие размерности, например. 10 размеров для классификации выпуклых оболочек. Результаты классификации перечислены с отдельными параметрами в разделе «Результаты». Мы используем эти результаты для изучения разделения характерных точек для различных структурных классов.
Results
CATH и SCOP — это две базы данных структурной классификации белков, которые классифицируют белки по различным структурным классам в соответствии с их вторичной структурой. База данных CATH имеет три основных структурных класса, а именно преимущественно α-структуры, преимущественно β-структуры и смешанные α- и β-структуры [17]. База данных SCOP классифицирует белки по четырем основным классам, а именно все-α-структуры, все-β-структуры, α+β-структуры, α/β-структуры [17].Другие структурные классы составляют меньшинство. Здесь мы сосредоточимся на основных классах CATH и SCOP и рассмотрим, как структурные классы разделены с точки зрения различных функций последовательности.
Мы используем три набора данных CATH и четыре набора данных SCOP, чтобы продемонстрировать анализ структурного разделения. Весь анализ извлечения признаков сравнивается с анализом PseAAC [21–23] и PSSM [24–25], а анализ классификации сравнивается с анализом SVM [26] и случайным лесом [27–28].
Анализ данных CATH
Для данных CATH мы используем три примера набора данных, чтобы продемонстрировать структурное разделение. Этими тремя примерами являются 30 групп CATH (CATH I), 40 групп CATH (CATH II) и все данные CATH со сходством последовательностей ниже 30% (CATH III). 30 групп CATH (CATH I) состоят из 458 белковых последовательностей из трех основных структурных классов CATH, каждый класс имеет 10 групп CATH. 40 групп CATH (CATH II) состоят из 536 белковых последовательностей из трех основных классов CATH, набор данных содержит 14, 11 и 15 групп CATH для преимущественно α, главным образом β и смешанных классов α и β соответственно.Два набора данных выбираются в базе данных случайным образом и не пересекаются друг с другом. Третий набор данных представляет собой набор всех репрезентативных белковых последовательностей в базе данных PDB с классификацией CATH и сходством последовательностей ниже 30%. Группы 30 и 40 CATH в первом и втором наборах данных являются естественными группами CATH, случайно выбранными из базы данных CATH. Чтобы получить достаточное количество образцов для каждого структурного класса, группы CATH выбираются случайным образом, но для гарантии того, что разные группы достигают одинакового уровня количества белков в каждом примере.Третий набор данных — это все данные в базе данных PDB с классификацией CATH и сходством последовательностей ниже 30%. Подробная информация о трех наборах данных показана в таблице 1.
CATH I: 30 групп CATH.
Мы вычисляем естественные векторы (NV) и факторы усредненных свойств (APF) для 458 белков 30 групп CATH. Идентификатор белка и векторы признаков представлены в наборах данных S1 и S2 со вспомогательной информацией. Результаты сравниваются с анализом признаков PseAAC и PSSM, а также анализом SVM и классификацией случайного леса.Чтобы проверить эффективность различных функций, мы также проверяем структурное разделение на пространствах расширенных функций, где точки функций представляют собой дополненные векторы, объединенные из векторов функций различных методов. Мы используем мультиклассовую MSE и выпуклые оболочки для вычисления гиперплоскостей и границ выпуклых оболочек, которые могут разделять функции последовательности. Результаты MSE и выпуклой оболочки показаны в таблицах 2 и 3 соответственно.
В таблице 2 средние показатели классификации MSE для трех структурных классов достигают 88.45%, 76,70% и 75,68% соответственно. Результаты показывают, что три структурных класса CATH могут быть разделены гиперплоскостями MSE в пространствах признаков, то есть характерные точки разных структурных классов разделены гиперплоскостями в разные области. Это означает, что аминокислотный состав и порядок последовательности, представленные природными векторами, и физические свойства аминокислот, характеризуемые факторами усредненных свойств, имеют большое значение для идентификации структур.В этой таблице вектор природы достигает самых высоких показателей классификации, чем другие методы признаков, а дополненные векторы признаков для комбинации различных признаков дают лучшие результаты классификации, чем отдельные признаки. Здесь комбинация различных признаков относится к расширенному вектору признаков, содержащему компоненты различных методов, например. «NV, APF» в таблице 2 относится к 70-мерным векторам расширенных признаков, первые 60 измерений которых являются 60-мерными естественными векторами, а последние 10 измерений являются 10-мерными векторами факторов усредненных свойств.Аналогично определяются другие комбинированные признаки.
Показатели классификации для метода выпуклых оболочек показаны в таблице 3. При анализе классификации выпуклых оболочек из-за высокой вычислительной сложности выпуклых оболочек векторы признаков высокой размерности делятся в классификации на 10 измерений. Мы можем видеть, что результаты выпуклой оболочки имеют сходные тенденции с результатами MSE в ранжировании скорости классификации, и три структурных класса CATH идентифицируются всеми методами признаков.Опять же, метод естественного вектора обеспечивает в целом более высокие скорости классификации, чем другие методы. Кроме того, α-структуры имеют более высокие скорости классификации, чем β-структуры.
Для сравнения с другими известными методами классификации мы сравниваем наш анализ с SVM и анализом классификации случайного леса. Результаты SVM и случайного леса показаны в таблицах 4 и 5. В таблице 4 характерные точки трех структурных классов хорошо разделены методом SVM.Средние показатели классификации (по различным методам признаков) для трех структурных классов составляют 93,91%, 75,88% и 77,13%. В классификации SVM метод естественного вектора обеспечивает в целом более высокие показатели классификации, чем другие методы.
Аналогичные результаты дает анализ классификации случайных лесов. В таблице 5 случайный лес представляет хорошие классификации для трех структурных классов. Средние показатели классификации достигают 91,59%, 86,47% и 91.13% для трех структурных классов, естественного вектора и методов PseAAC, а также комбинированных методов признаков достигают высоких показателей классификации.
Из этого анализа видно, что метод естественного вектора превосходит метод усредненного коэффициента свойства при структурном разделении. Первый представляет состав аминокислот (компоненты N природного вектора), а также положения и расположение этих аминокислот (компоненты μ и D природного вектора), а второй представляет собой среднее значение физических свойств аминокислоты.Мы можем предположить, что состав аминокислот и расположение их последовательностей могут оказывать большее влияние на структуру. Кроме того, все методы классификации представляют хорошие классификации для характерных точек, где метод выпуклой оболочки обеспечивает лучшую производительность, чем MSE с несколькими классами в этом классификационном анализе.
CATH II: 40 групп CATH.
Второй набор данных содержит 536 белков из 40 групп CATH, которые полностью отличаются от CATH I. Идентификаторы белков и их вектора признаков приведены в наборах данных S3 и S4 со вспомогательной информацией.Результаты MSE и выпуклой оболочки показаны в таблицах 6 и 7.
В Таблице 6 три структурных класса разделены естественными векторными признаками и дополненными векторами для комбинации различных признаков. Средние показатели классификации для трех структурных классов составляют 82,13%, 57,93%, 68,76%. В основном α-структуры достигают самых высоких показателей классификации, чем другие структурные классы. Метод естественного вектора обеспечивает более высокие скорости классификации, чем метод усредненных факторов свойств, а комбинированные признаки, как правило, демонстрируют более высокие скорости классификации, чем особенности каждого отдельного метода.
Результаты классификации выпуклой оболочки лучше, чем результаты мультиклассовой MSE. Средние показатели классификации выпуклых корпусов для трех конструктивных классов составляют 90,15%, 86,91%, 85,96%. Три класса отделимы выпуклыми оболочками с точки зрения векторов признаков (таблица 7). Метод естественного вектора обеспечивает в целом более высокие скорости классификации, чем метод усредненного коэффициента свойства при структурной идентификации.
Показатели классификации SVM показаны в таблице 8.В этой таблице три структурных класса хорошо разделены с помощью признаков последовательности. SVM достигает средних показателей классификации 94,89%, 71,50% и 79,96% для трех структурных классов. Опять же, метод естественного вектора обеспечивает более высокие скорости классификации, чем метод усредненного фактора свойства.
Коэффициенты классификации с использованием метода случайного леса показаны в Таблице 9. В Таблице 9 средние коэффициенты классификации для трех структурных классов составляют 97,84%, 79.96% и 95,06%, а также все методы признаков дают хорошие результаты классификации. В этом примере метод естественного вектора обеспечивает скорость классификации, аналогичную методу усредненного фактора свойства для преимущественно α- и смешанных структур, но явно более высокую скорость классификации для преимущественно β-структур.
Из анализа этого примера видно, что метод естественного вектора превосходит метод фактора усредненного свойства в этой структурной идентификации. Все методы классификации обеспечивают хорошее структурное разделение в пространствах признаков, где метод выпуклой оболочки имеет лучшую производительность, чем метод MSE с несколькими классами.
CATH III: данные CATH со сходством последовательностей ниже 30%.
В этом примере мы анализируем все данные CATH в базе данных PDB со сходством последовательностей ниже 30%. Мы загрузили данные PDB белков, полученных с помощью рентгеновских экспериментов, и сходство последовательностей ниже 30%. Информация о данных показана в таблице 1. Идентификатор белка и его вектора признаков можно найти в наборах данных S5 и S6 со вспомогательной информацией. Мы проводим анализ признаков естественного вектора и усредненного фактора свойства, а также многоклассовую классификацию MSE и выпуклой оболочки, результаты сравниваются с анализом признаков PseAAC и PSSM, а также анализом SVM и классификацией случайного леса.Показатели классификации показаны в таблицах 10–13.
В таблице 10 мультиклассовый метод MSE представляет средние результаты классификации 70,96%, 69,98%, 49,40% для трех структурных классов. Естественный векторный признак обеспечивает в целом более высокие показатели классификации, чем метод усредненного фактора свойства. В анализе классификации выпуклых корпусов (Таблица 11) средние показатели классификации для трех конструктивных классов составляют 79,94%, 75,63%, 65,61%, что в целом лучше, чем результаты, полученные с помощью многоклассового метода MSE (Таблица 10).Естественный векторный признак хорошо разделяет три структурных класса, в то время как метод усредненного фактора свойства не позволяет дифференцировать разные классы.
SVM и результаты классификации случайного леса показаны в таблицах 12 и 13. При анализе SVM из-за большого количества данных и больших размерностей функция набора инструментов SVM в Matlab не возвращает сходимости при использовании всего набора данных, поэтому мы используем единое окно с W = 1500 точек данных и генератор случайных чисел для случайного выбора 1500 точек выборки для каждого структурного класса из всего набора данных и выполняем SVM-классификации для случайно выбранных точек выборки.Мы повторяем этот процесс 10 раз, где 10-кратные повторы выполняются независимо, мы вычисляем средние показатели классификации для анализа SVM. SVM представляет средние показатели классификации 88,86%, 31,70% и 91,62%. Метод случайного леса используется для всего набора данных, он представляет средние показатели классификации 88,55%, 88,31%, 88,39% для трех структурных классов. Все структурные классы хорошо классифицируются методом случайного леса.
Анализ данных SCOP
В этом разделе мы используем четыре набора данных SCOP для демонстрации классификационного анализа.Данные SCOP выбираются случайным образом из четырех основных структурных классов SCOP (все α, все β, α + β, α/β). Первый набор данных представляет собой набор из 24 групп SCOP (обозначенных SCOP I), состоящий из 817 белков с 6 группами из каждого структурного класса. Второй набор данных представляет собой набор из 40 групп SCOP (обозначенных SCOP II), состоящих из 406 белков по 10 групп из каждого структурного класса. Третий набор данных представляет собой набор из 48 групп SCOP (обозначенных SCOP III), состоящий из 2509 белков с 12 группами из каждого структурного класса.Три набора данных выбираются в базе данных случайным образом и не пересекаются друг с другом. Четвертый набор данных представляет собой набор всех репрезентативных белковых последовательностей в базе данных PDB с классификацией SCOP и сходством последовательностей ниже 30%. Группы SCOP в первых трех примерах являются естественными группами SCOP, случайно выбранными из базы данных SCOP. Чтобы получить достаточное количество образцов для каждого структурного класса, группы SCOP выбираются случайным образом, но для гарантии того, что разные группы достигают одинакового уровня количества белков в каждом примере.Четвертый набор данных — это все данные в базе данных PDB с классификацией SCOP и сходством последовательностей ниже 30%. Подробная информация о данных SCOP представлена в таблице 14.
SCOP I: 24 группы SCOP.
Этот набор данных содержит 24 группы SCOP, мы используем мультиклассовый метод MSE и методы выпуклой оболочки для классификации характерных точек. Идентификатор белка и его вектора признаков для 24 групп SCOP приведены в наборах данных S7 и S8 со вспомогательной информацией. Результаты сравниваются с анализом признаков PseAAC и PSSM, а также методами SVM и классификации случайного леса.Показатели классификации показаны в таблицах 15–18. В таблице 15 четыре структурных класса SCOP (Все α, Все β, α + β, α/β) можно разделить гиперплоскостями MSE в естественном векторе и пространствах признаков PseAAC. Средние показатели классификации для четырех структурных классов методом мультиклассовой MSE составляют 77,98%, 84,77%, 69,58% и 70,55%. Мы видим, что естественный вектор обеспечивает в целом более высокие скорости классификации, чем другие методы, и почти все комбинированные признаки достигают более высоких скоростей классификации, чем их отдельные признаки.Результаты для объединенных признаков всех трех методов достигают самых высоких скоростей классификации для структурного разделения.
Среди всех структурных классов смешанные структуры, т. е. структуры α + β и α/β, менее идентифицируемы, чем чистые структуры (т. е. все α-структуры и все β-структуры).
В таблице 16 представлена классификация выпуклых корпусов по различным характеристикам. В таблице 16 результаты для выпуклой оболочки лучше, чем результаты MSE, четыре структурных класса идентифицируются по естественному вектору.Средние показатели классификации для четырех структурных классов составляют 92,25%, 76,46%, 86,78%, 89,41%. Среди трех методов признаков метод естественного вектора достигает более высоких скоростей классификации, чем метод усредненного фактора свойства. Это еще раз демонстрирует важность состава аминокислот и их последовательностей при идентификации структур.
В таблицах 17 и 18 показаны скорости классификации с использованием методов SVM и случайного леса. SVM достигает среднего уровня классификации 97.33%, 91,53%, 68,01%, 86,10% для четырех структурных классов. Метод случайного леса обеспечивает средние показатели классификации 94,37%, 85,95%, 89,44%, 91,31%. Метод естественного вектора обеспечивает более высокую скорость классификации, чем метод усредненного коэффициента свойства.
SCOP II: 40 групп SCOP.
Второй пример SCOP — это набор из 40 групп SCOP. Идентификатор белка и векторы признаков 40 групп SCOP приведены в наборах данных S9 и S10 со вспомогательной информацией. Результаты классификации этого примера показаны в таблицах 19–22.В Таблице 19 четыре структурных класса можно разделить с точки зрения свойств природного вектора и PseAAC. Средние показатели классификации для четырех структурных классов составляют 71,82%, 62,86%, 60,01%, 84,54%. Мы видим, что метод естественного вектора дает в целом более высокие результаты классификации, чем другие методы, и почти все комбинированные признаки дали лучшие результаты классификации, чем их методы по отдельности. Обратите внимание, что метод усредненного коэффициента свойства достигает самых низких показателей классификации во всех структурных классификациях, особенно для структур α + β.
Результаты классификации методом выпуклой оболочки показаны в Таблице 20. Скорость классификации выпуклой оболочки в целом достигает более высокой скорости классификации, чем мультиклассовый метод MSE, где естественный векторный признак достигает более высокой скорости классификации, чем другие методы. PseAAC также показывает хорошие результаты классификации, в то время как функция усредненного фактора свойства снова демонстрирует самые низкие показатели классификации. Средние показатели классификации выпуклых корпусов для четырех конструктивных классов составляют 95.43%, 82,05%, 86,87%, 97,81%. Эти результаты выпуклых оболочек предполагают, что четыре структурных класса можно разделить выпуклыми оболочками с точки зрения признаков последовательности, и метод выпуклой оболочки более эффективен в структурной идентификации, чем метод MSE с несколькими классами.
В таблицах 21 и 22 методы SVM и случайного леса также представляют хорошую классификацию четырех структурных классов в пространствах признаков. В таблице 21 SVM достигает среднего уровня классификации 98,68%, 79.79%, 78,72%, 86,40% для четырех структурных классов. В таблице 22 метод случайного леса достигает 95,43%, 82,05%, 86,87% и 97,81% для четырех структурных классов. В этом анализе различные структурные классы хорошо разделены с точки зрения различных методов признаков, где метод естественных векторов превосходит другие методы признаков в структурной классификации.
SCOP III: 48 групп SCOP.
Набор данных SCOP III состоит из 48 групп SCOP. Идентификатор белка и векторы признаков 48 групп SCOP приведены в наборах данных S11 и S12 со вспомогательной информацией.Результаты классификации MSE и выпуклой оболочки для 40 групп SCOP показаны в таблицах 23–26. В таблице 23 средние показатели классификации MSE составляют 66,765, 56,00%, 59,68%, 65,22%. Четыре структурных класса идентифицируются естественными векторами и PseAAC. Метод усредненного коэффициента свойства обеспечивает самые низкие показатели классификации для большинства структурных классов, которые не могут разделить четыре структурных класса. Однако при объединении различных типов признаков скорость классификации в целом повышается по сравнению с их отдельными признаками.
В Таблице 24 результаты классификации выпуклых оболочек предполагают, что четыре структурных класса можно разделить по N признакам естественных векторов и признакам PseAAC. Средние показатели классификации выпуклых корпусов для четырех конструктивных классов составляют 70,03%, 75,01%, 71,91% и 59,20%. Обратите внимание, что скорость классификации выпуклых оболочек в целом выше, чем результаты MSE, что означает, что структурные классы лучше разделены выпуклыми оболочками, чем гиперплоскостями MSE.Кроме того, признаки N природного вектора, то есть аминокислотный состав белковых последовательностей, дают более высокие результаты классификации, чем другие признаки, но признаки μ и D природных векторов демонстрируют более низкие скорости классификации, чем все другие признаки. Эти результаты демонстрируют важность аминокислотного состава в структурной идентификации.
В таблицах 25 и 26 показаны скорости классификации четырех структурных классов с использованием методов SVM и случайного леса.SVM (таблица 25) достигает средних показателей классификации 100%, 81,37%, 77,10%, 87,19% для четырех структурных классов. В анализе SVM естественный вектор демонстрирует несколько более высокие скорости классификации, чем признаки усредненного фактора свойства. Аналогичная ситуация возникает и при анализе классификации случайных лесов. В таблице 26 метод случайного леса обеспечивает средние показатели классификации 90,10%, 86,00%, 90,68%, 94,76% для четырех структурных классов.
SCOP IV: данные SCOP со сходством последовательностей ниже 30%.
В этом разделе мы анализируем все данные SCOP в базе данных PDB со сходством последовательностей ниже 30%. Мы загрузили данные PDB белков, полученных с помощью рентгеновских экспериментов, и сходство последовательностей ниже 30%. Идентификатор белка и векторы признаков данных SCOP с низким сходством последовательностей приведены в наборах данных S13 и S14 со вспомогательной информацией. Информация о данных показана в таблице 14. Мы проводим анализ свойств естественного вектора и усредненного фактора свойства, а также мультиклассовые исследования MSE и структурного разделения выпуклой оболочки на этом наборе данных и сравниваем анализ с анализом признаков PSSM и SVM и методы классификации случайных лесов.Результаты представлены в таблицах 27–30.
В таблице 27 мультиклассовый метод MSE обеспечивает средние показатели классификации 61,48%, 53,61%, 47,28% и 45,60% для четырех структурных классов. Из этой таблицы видно, что четыре структурных класса можно разделить в пространстве признаков естественного вектора, а признак естественного вектора в целом демонстрирует более высокие показатели классификации, чем метод усредненного фактора свойства. Расширенные функции, то есть комбинация различных функций, обеспечивают более высокие скорости классификации, чем метод отдельных функций.Функция PSSM представляет самые низкие показатели классификации в этом анализе.
В таблице 28 метод классификации выпуклых корпусов представляет хорошую классификацию для четырех конструктивных классов. Средние показатели классификации методом выпуклых оболочек составляют 68,16%, 60,36%, 56,69%, 46,92%. Коэффициенты классификации естественных векторных признаков выше, чем коэффициенты классификации признаков усредненных имущественных факторов. Классификация SVM (таблица 29) показывает более низкие скорости классификации, чем методы классификации с несколькими классами и методом выпуклой оболочки, средние скорости классификации для четырех структурных классов составляют 86.13%, 38,09%, 34,01%, 95,13%. SVM не работает хорошо в этом анализе. Случайный лес хорошо разделяет четыре структурных класса (таблица 30), средние показатели классификации для четырех структурных классов составляют 56,29%, 61,01%, 96,49% и 68,45%. Метод естественного вектора обеспечивает более высокие скорости классификации, чем метод усредненного коэффициента свойства.
Обсуждение
В этой статье мы используем особенности последовательности белков для изучения структурного разделения белков. Мы используем два типичных признака белковой последовательности, а именно метод естественного вектора и метод фактора усредненных свойств, для извлечения свойств белковой последовательности.Естественный вектор фокусируется на составе и расположении последовательностей аминокислот, в то время как фактор усредненных свойств фокусируется на физических свойствах аминокислот. Мы сравниваем два метода признаков с функциями PseAAC и PSSM. Эти методы признаков сопоставляют белковые последовательности в многомерных реальных векторах, где мы используем мультиклассовый метод MSE и методы выпуклой оболочки для классификации этих векторов признаков в отдельные области. Мы стремимся проверить, являются ли различные вторичные структурные классы разделимыми с точки зрения признаков последовательности, а также проверить, какие типы признаков последовательности лучше влияют на структуры.Классификационный анализ сравнивается с традиционными методами, такими как SVM и методы случайного леса.
Мы используем три набора данных CATH и четыре набора данных SCOP для демонстрации анализа. Мы обнаружили, что различные структурные классы CATH и SCOP разделяются гиперплоскостями и выпуклыми оболочками в пространствах признаков последовательности, метод естественных векторов превосходит другие методы признаков почти во всех структурных классификациях. По сравнению с другими методами классификации, многоклассовый MSE, метод выпуклой оболочки и метод случайного леса имеют хорошие характеристики в структурной классификации.SVM представляет хорошие классификации в большинстве случаев, но он может не иметь сходимости в вычислениях для некоторых больших наборов данных из-за больших размерностей векторов признаков, а скорость классификации SVM иногда ниже, чем результаты других методов. Метод выпуклой оболочки представляет лучшую классификацию структурных классов, чем другие методы.
В анализе признаков мы сравнили методы естественного вектора и усредненного фактора свойства с методами признаков PseAAC и PSSM.Утверждается, что природный вектор имеет прямое соответствие с последовательностью белка [4], он состоит из трех основных частей, представляющих составы, положения и расположение последовательностей 20 распространенных типов аминокислот. Метод усредненных факторов свойств [18] фокусируется на 10 физических свойствах аминокислот. Метод PseAAC [21–23] представляет аминокислотный состав белковых последовательностей, который часто используется методами классификации машинного обучения [31–33]. PSSM — это позиционно-специфический метод оценки, который оценивает профиль локального выравнивания белковых последовательностей [24–25].Мы используем эти четыре метода признаков для представления белковых последовательностей, метод естественного вектора и метод PseAAC часто демонстрируют лучшие результаты в структурной классификации, чем метод усредненного фактора свойства. В частности, при анализе данных с низким сходством метод естественного вектора демонстрирует очевидное превосходство, чем метод усредненного коэффициента свойства в классификации выпуклых оболочек. Это может означать, что аминокислотный состав и расположение их последовательностей, представленные природными векторами, могут лучше отражать структуру белка, чем усредненные физические свойства аминокислот.Обратите внимание, что PSSM отличается от естественного вектора извлечением признаков последовательности. Естественный вектор подсчитывает как состав, так и расположение аминокислот в белковых последовательностях, он вычисляет среднее расстояние и моменты каждого типа аминокислот до начала координат (т. е. до первой аминокислоты в последовательности). Аминокислотный состав, среднее расстояние и моменты вместе являются отличительной чертой каждой отдельной последовательности и не зависят от выравнивания других последовательностей.PSSM оценивает выравнивание последовательности, и эти оценки зависят от выравнивания последовательности с другими последовательностями. В большинстве случаев PSSM обеспечивает более высокие скорости классификации, чем метод усредненного фактора свойства, как это делает метод естественного вектора.
В большинстве случаев комбинация различных признаков дает лучшие результаты классификации, чем отдельные признаки. Обычно полная комбинация всех трех методов дает самые высокие результаты классификации, чем любые другие комбинации.Скорость классификации, по-видимому, улучшается при включении природных векторов и признаков PseAAC, что подразумевает, что аминокислотный состав и расположение их последовательностей могут иметь большое влияние на структуры.
В классификационном исследовании мы используем мультиклассовые методы MSE и методы выпуклой оболочки для изучения разделения пространств признаков, которые сравниваются с анализом SVM и методом случайного леса. Результаты показывают, что различные структурные классы CATH и SCOP можно разделить с помощью многоклассовой MSE и методов выпуклой оболочки с точки зрения естественных векторных признаков.Естественный вектор превосходит метод усредненного фактора свойства почти во всех классификациях.
Результаты классификации выпуклых оболочек сравнительно выше, чем результаты мультиклассовой MSE почти во всех исследованиях моделирования. Это означает, что выпуклые оболочки обеспечивают лучшее разделение характерных точек, чем гиперплоскости MSE. «Исключительно в оболочке» метода выпуклой оболочки имеет хорошие преимущества перед региональными «разрезами» гиперплоскостями MSE при структурном разделении пространственных признаков.Оба метода классификации являются популярными классификаторами, но они представляют классификацию по-разному. Классификатор MSE часто используется в классификациях машинного обучения, который разрезает реальные пространства на непересекающиеся области [19]. Метод выпуклой оболочки используется для таксономии или эволюционной классификации генов или белков [20], где характерные точки разных генетических семейств или таксонов заключены в разные выпуклые оболочки. Хотя метод выпуклой оболочки обеспечивает более высокие скорости классификации при структурном разделении, оба классификатора поддерживают одни и те же результаты, заключающиеся в том, что различные структурные классы отделимы в естественных векторных пространствах, что допускает лучшее разделение структурных классов, чем другие методы признаков.
Скорость классификации, определенная с помощью методов MSE и выпуклой оболочки, используется для количественной оценки качества разделения для различных структурных классов. Он измеряет «исключительность» характерных точек в области каждого структурного класса. Обратите внимание, что разные последовательности могут соответствовать одинаковым структурам, а похожие последовательности могут также соответствовать разным структурам. Поэтому структурное разделение в пространствах признаков не означает точной классификации структур, а является общим разделением пространств признаков.Из этого исследования мы видим, что характерные точки разных структурных классов занимают разные области пространств признаков, которые могут быть разделены гиперплоскостями и выпуклыми оболочками. Общие результаты касаются важных связей между белковыми последовательностями (аминокислотный состав и расположение последовательностей) и их структурами.
Заключение
В этом исследовании мы используем мультиклассовый метод MSE и метод выпуклой оболочки для разделения структурных классов белков в пространствах признаков последовательности белков.Мы обнаружили, что различные структурные классы CATH и SCOP отделимы гиперплоскостями и выпуклыми оболочками с точки зрения естественных векторных признаков. Метод естественного вектора превосходит метод усредненного коэффициента свойства в структурном разделении, а метод выпуклой оболочки превосходит метод мультиклассовой MSE в структурном разделении пространств признаков. Результаты могут означать, что аминокислотный состав и расположение их последовательностей, представленные природными векторами, могут лучше указывать на структуры, чем усредненные физические свойства аминокислот.
Дополнительная информация
S1 Таблица. 10 факторов свойств 20 аминокислот [29–30].
В этой таблице показаны 10 факторов свойств 20 типов аминокислот. Порядок 10 свойств аминокислот: 1. предпочтение альфа-спирали/изгиба; 2. Размер боковой цепи; 3. Предпочтение расширенной структуры; 4. Гидрофобность; 5. Двойной изгиб; 6. Аминокислотный состав; 7. Плоский расширенный преферанс; 8. Наличие в регионе; 9. пк; 10. Окружающая гидрофобность.
10.1371/journal.pone.0226768.s001
(DOCX)
Набор данных S6. Векторы признаков данных CATH со сходством последовательностей ниже 30% (CATH III).
Это файл данных для векторов признаков данных CATH со сходством последовательностей ниже 30% (CATH III).
10.1371/journal.pone.0226768.s007
(MAT)
Набор данных S14. Векторы признаков данных SCOP со сходством последовательностей ниже 30% (SCOP IV).
Это файл данных для векторов признаков данных SCOP со сходством последовательностей ниже 30% (SCOP IV).
10.1371/journal.pone.0226768.s015
(MAT)
Благодарности
Мы благодарим Колледж математики и физики при Пекинском химико-технологическом университете за предоставление рабочего места и оборудования для этого исследования.
Каталожные номера
- 1.
Левитт М. Природа белковой вселенной. Труды Национальной академии наук Соединенных Штатов Америки. 2009 г.; 106 (27): 11079–84. пмид:19541617 - 2.Яу СТ, Ю С, Он РЛ. Белковая карта и ее применение. ДНК и клеточная биология. 2008 г.; 27: 241250.
- 3.
Ю С, Ченг С.И., Он Р.Л., Яу С.Т. Белковая карта: метод сравнения последовательностей без выравнивания, основанный на различных свойствах аминокислот. Ген. 2011 г.; 486 (1–2): 110–118. пмид:21803133 - 4.
Yu C, Deng M, Cheng SY, Yau SC, He RL, Yau ST. Белковое пространство: естественный метод осознания природы белковой вселенной. Журнал теоретической биологии.2013; 318:197–204. пмид:23154188 - 5.
Чжао Б., Хэ Р.Л., Яу С.Т. Новый вектор распространения и его применение в кластеризации генома. Молекулярная филогенетика и эволюция. 2011 г.; 59: 438–443. пмид:21385621 - 6.
Чжао Х, Ван Х, Хе Р.Л., Яу С.Т. Новый метод изучения эволюционного происхождения морских бактерий клады SAR11. Молекулярная филогенетика и эволюция. 2016; 98: 271–279. пмид:26
6
Ю С, Хе Р.Л., Яу СТ. Сравнение белковых последовательностей на основе словаря K-цепочек.Ген. 2013; 529: 250–256. пмид:23939466
Ding CHQ, Dubchak I. Мультиклассовое распознавание белковых складок с использованием машин опорных векторов и нейронных сетей. Биоинформатика. 2001 г.; 17(4), 349–358. пмид:11301304
Эдлер Л., Грассманн Дж., Сухай С. Роль и результаты статистических методов в прогнозировании класса укладки белка. Математическое и компьютерное моделирование. 2001 г.; 33 (12–13): 1401–1417.
Хуан CD, Лин CT, Pal NR. Иерархическая архитектура обучения с автоматическим выбором признаков для многоклассовой классификации белковых складок.Транзакции IEEE в NanoBioscience. 2003 г.; 2(4): 221–232. пмид:15376912
Джо Т., Хоу Дж., Эйкхолт Дж., Ченг Дж. Улучшение распознавания белковых складок с помощью сетей глубокого обучения. Научные отчеты. 2015 г.; 5: 17573. pmid:26634993
Хан М.А., Шахзад В., Байг А.Р. Классификация белков с помощью классификатора на основе правил ассоциации, вдохновленного муравьями. Международный журнал биологических вычислений. 2016; 8(1): 51–65.
Марковец Ф., Эдлер Л., Вингрон М.Машины опорных векторов для предсказания класса укладки белка. Биометрический журнал: журнал математических методов в биологических науках. 2003 г.; 45(3): 377–389.
Tan AC, Gilbert D, Deville Y. Многоклассовая классификация белковых складок с использованием нового подхода к машинному обучению ансамбля. Геномная информатика. 2003 г.; 14: 206–217. пмид:15706535
Вей Л., Ляо М., Гао С., Цзоу К. Усовершенствованный метод прогнозирования складки белка с помощью новой техники извлечения признаков. Транзакции IEEE по нанобиологии.2015 г.; 14(6): 649–659. пмид:26335556
Wei L, Zou Q. Недавний прогресс в методах распознавания белковых складок на основе машинного обучения. Международный журнал молекулярных наук. 2016; 17(12): 2118.
Ван Дж., Ван З., Тиан С. Биоинформатика: основы и приложения. Издательство Университета Цинхуа. 2014.
Раковски С. Физические свойства последовательности кодируют глобальную организацию пространства белковой структуры. ПНАС. 2009 г.; 106 (34): 14345–14348.пмид:19706520
Дуда Р.О., Харт Ч.Е., Аист Д.Г. Классификация образов, второе издание. Китайский машинный пресс. 2001.
Тянь К., Чжао С., Яу С.Т. Анализ выпуклой оболочки эволюционных и филогенетических отношений между биологическими группами. Журнал теоретической биологии. 2018; 456: 34–40. пмид:30059661
Шэнь Х.Б., Чжоу К.С. PseAAC: Гибкий веб-сервер для создания различных белковых псевдоаминокислотных композиций.Аналитическая биохимия. 2008 г.; 373(2): 386–388. пмид:17976365
Liu B, Liu F, Wang X, Chen J, Fang L и Chou KC. Pse-in-One: веб-сервер для создания различных режимов псевдокомпонентов последовательностей ДНК, РНК и белков. Исследование нуклеиновых кислот. 2015 г.; 43 (В1): В65–В71. пмид:25958395
Сюй Ю, Дин Дж, У ЛЙ, Чжоу К.С. iSNO-PseAAC: предсказывает сайты S-нитрозилирования цистеина в белках путем включения позиционно-специфической склонности к аминокислотам в псевдоаминокислотный состав.ПЛОС ОДИН. 2013; 8(2): e55844. пмид:23409062
Грибсков М., Маклахлан А.Д., Айзенберг Д. Анализ профиля: обнаружение отдаленно родственных белков. Труды Национальной академии наук. 1987 год; 84 (13), 4355–4358.
Чон JC, Лин X, Чен XW. О позиционно-специфичной матрице оценок для предсказания функции белка. IEEE/ACM Transactions по вычислительной биологии и биоинформатике. 2011 г.; 8 (2), 308–315.
Хсу С, Чанг С, Лин С.Практическое руководство по классификации векторов. БЖУ Интернэшнл. 2008 г.; 101 (1): 1396–1400.
Брейман Л. Случайные леса. Машинное обучение. 2001 г.; 45 (1): 5–32.
Лим А., Брейман Л., Катлер А. Большие случайные леса: классификация и регрессионные леса для больших наборов данных. 2014.
Кидера А., Кониши Ю., Ока М., Оои Т., Шерага Х.А. Статистический анализ физических свойств 20 встречающихся в природе аминокислот.Журнал химии белков. 1985 год; 4(1): 23–55.
Кидера А., Кониши Ю., Оои Т., Шерага Х.А. Связь между сходством последовательностей и структурным сходством белков: роль важных свойств аминокислот. Журнал химии белков. 1985 год; 4(5):265–297.
Chang CC и Lin CJ. LibSVM: библиотека для машин опорных векторов. Транзакции ACM по интеллектуальным системам и технологиям. 2011 г.; 2(3): 27.
Линь С., Чен В., Цю С., Ву И., Кришнан С., Цзоу К.LibD3C: классификаторы ансамбля со стратегией кластеризации и динамического выбора. Нейрокомпьютинг. 2014; 123: 424–435.
Линь С., Цзоу И, Цинь Дж., Лю С, Цзян И, Ке С и др. Иерархическая классификация белковых складок с использованием нового ансамблевого классификатора. ПЛОС ОДИН. 2013; 8(2): e56499. пмид: 23437146
.

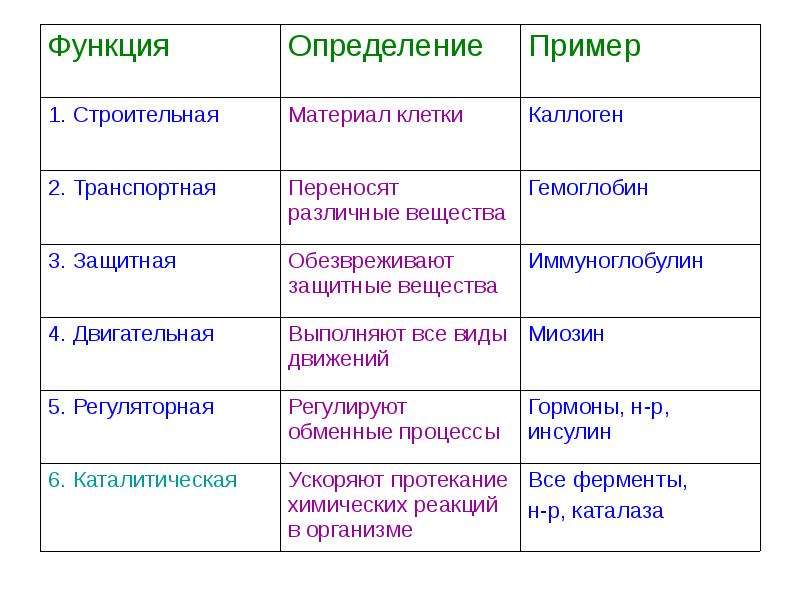
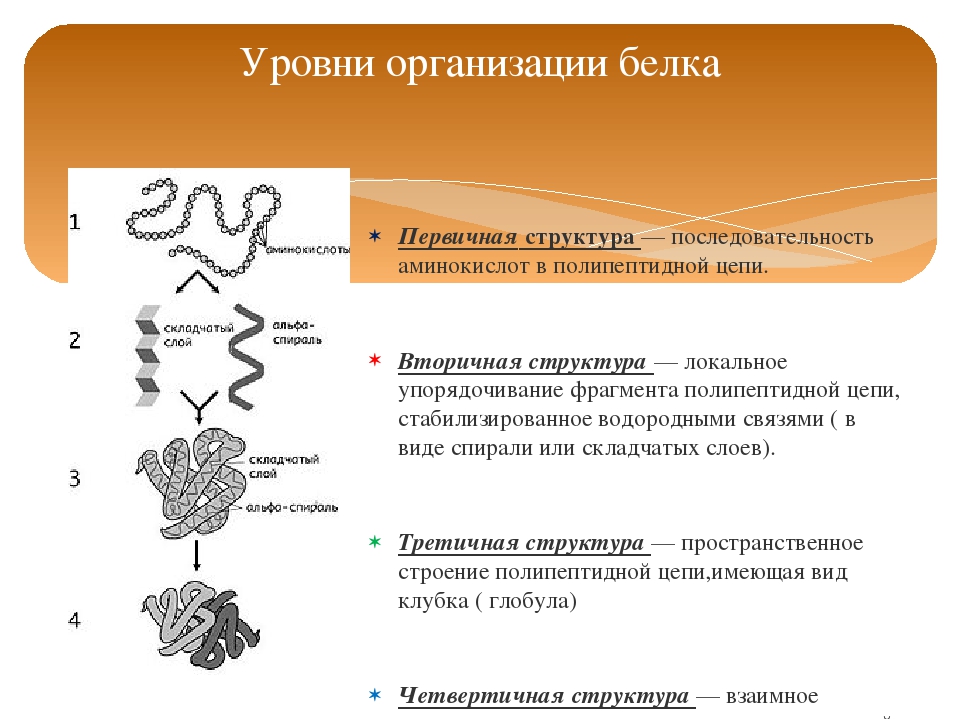
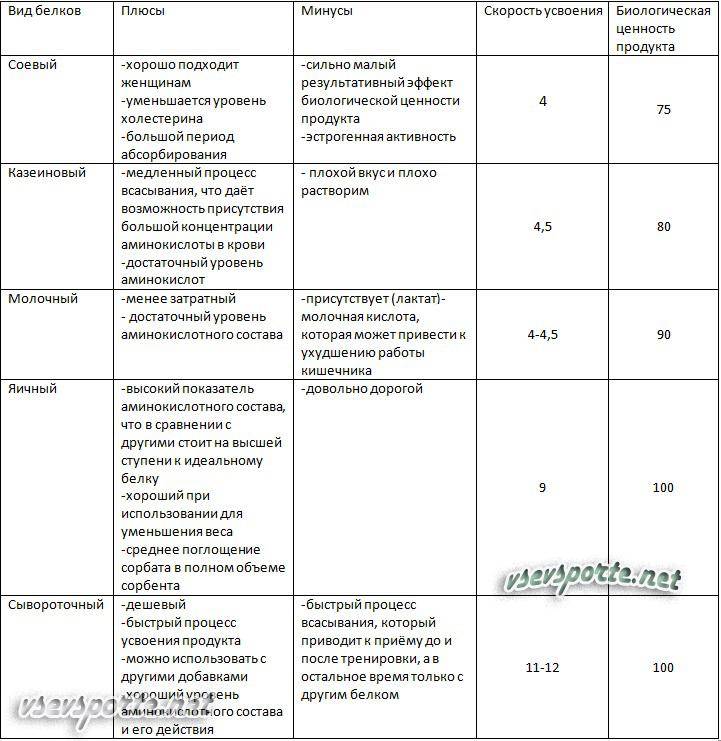 Как вы это можете объяснить?
Как вы это можете объяснить?
