Содержание
Переваривание и всасывание макронутриентов | Tervisliku toitumise informatsioon
Переваривание и всасывание белков
Белки – это состоящие из аминокислот макромолекулы. Во рту переваривания белков не происходит. Содержащаяся в желудке соляная кислота коагулирует пищевые белки. Это значит, что крупные молекулы пищевых белков разворачиваются и образующийся в желудке фермент пепсин может начинать частичное переваривание (гидролиз) белков.
Ферменты, необходимые для окончательного переваривания белков, выбрасываются поджелудочной железой в верхний отдел тонкой кишки – двенадцатиперстную кишку. Работающий в желудке пепсин вместе с работающими в двенадцатиперстной кишке трипсином и другими ферментами расщепляют большинство пищевых белков до аминокислот. Образуется также небольшое количество коротких пептидов, которые расщепляются до аминокислот под воздействием ферментов каемчатых энтероцитов тонкой кишки.
Во время нахождения перевариваемой пищевой массы в тощей кишке, среднем отделе тонкой кишки, происходит всасывание образовавшихся из белков или присутствовавших в пище свободных аминокислот. Получившиеся вещества всасываются непосредственно в кровоток или лимфатическую систему. Кровь доставляет питательные вещества в первую очередь в печень, где происходит задействование аминокислот.
Получившиеся вещества всасываются непосредственно в кровоток или лимфатическую систему. Кровь доставляет питательные вещества в первую очередь в печень, где происходит задействование аминокислот.
Переваривание и всасывание липидов
Жиры (триглицериды – состоят из трех жирных кислот и глицерола) составляют 95–98 % пищевых липидов. Основными присутствующими в пище липидами как раз и являются жиры. Существенного расщепления жиров во рту не происходит. Тем не менее, во рту присутствует образующийся под языком фермент липаза, который расщепляет небольшие количества жиров.
В желудке присутствует фермент желудочная липаза. Он обладает несильным действием, но поскольку он относительно стоек к воздействию кислоты, то в желудке происходит умеренное расщепление некоторого количества триглицеридов.
Триглицериды должны быть сначала преобразованы в верхнем отделе тонкой кишки – в двенадцатиперстной кишке – в тонкую эмульсию, и только затем соответствующие ферменты (липазы) смогут расщепить их на глицерол и жирные кислоты.
Чрезвычайно большую роль в образовании эмульсии играют желчные соки и их соли. Молочные белки (казеины) – тоже очень хорошие тонкие эмульгаторы пищи. Образованию тонкой эмульсии способствует также то, что выбрасываемые поджелудочной железой бикарбонаты реагируют с поступающей из желудка кислотной пищевой массой, в результате чего образуются необходимые для пищеварения газы, основательно перемешивающие эту пищевую массу. Перистальтика стенок кишечника также помогает перемешивать его содержимое.
Из поджелудочной железы в двенадцатиперстную кишку поступает главный фермент процесса переваривания жиров – панкреатическая липаза. Он вместе с другими ферментами расщепляет пищевые липиды на простые соединения (триглицериды, глицерол, свободные жирные кислоты), а фосфолипиды – на их первичные компоненты.
Во время нахождения перевариваемой пищевой массы в среднем отделе тонкой кишки происходит всасывание образовавшихся из пищевых жиров глицерола и жирных кислот. Получившиеся вещества всасываются непосредственно в кровоток или лимфатическую систему.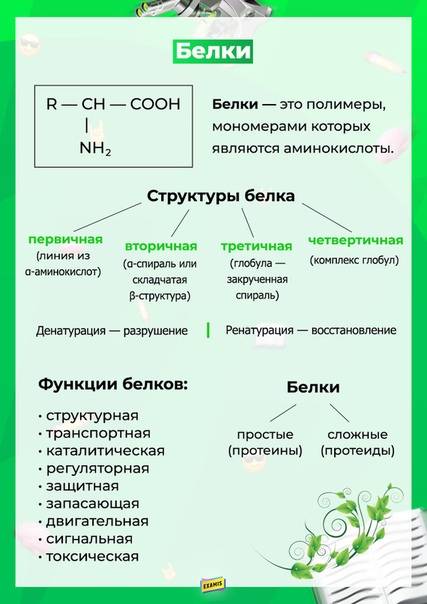
Переваривание и всасывание крахмала
С точки зрения переваривания сложных углеводов наиболее важным является расщепление именно крахмала.
Из всех пищевых углеводов только крахмал начинает перевариваться во рту. Это осуществляется за счет содержащегося в слюне фермента амилазы. Под его воздействием часть крахмала расщепляется на более мелкие составляющие. Если долго пережевывать богатую крахмалом пищу (а это очень полезно), то небольшая часть крахмала будет расщеплена до гликозина (так при долгом жевании хлеба он становится сладким). Прочие содержащиеся в пище углеводы (например, сахароза и лактоза) во рту не расщепляются.
Поскольку в желудке из-за соляной кислоты среда сильно кислотная, дальнейшего переваривания углеводов там практически не происходит. Соляная кислота нужна в первую очередь для превращения расщепляющего белки фермента пепсиногена в пепсин и высвобождения многих гормонов, обеспечивающих работу желудочного сока. Соляная кислота также истребляет бактерии.
Из поджелудочной железы в верхний отдел тонкой кишки, двенадцатиперстную кишку, выбрасывается панкреатическая амилаза. Это самый важный фермент для переваривания углеводов, который расщепляет основную часть крахмала. Панкреатическая амилаза вместе с собственными ферментами тонкой кишки доводит до конца процесс расщепления крахмала до глюкозы. Под воздействием ферментов каемчатых энтероцитов тонкой кишки (сахаразы, лактазы и других) происходит расщепление на компоненты также и сахарозы и лактозы.
Во время нахождения перевариваемой пищевой массы в тощей кишке, среднем отделе тонкой кишки, происходит всасывание образовавшихся из сложных углеводов или присутствовавших в пище свободных глюкозы и фруктозы, которые всасываются напрямую в кровоток или лимфатическую систему. Кровь доставляет питательные вещества в первую очередь в печень, где происходит их использование.
Микроорганизмы, обитающие в толстой кишке, расщепляют клетчатку, которую пищеварительные ферменты расщепить не в состоянии. В ходе этого процесса образуются короткие жирные кислоты, которые всасываются в кровь и которые организм может использовать для получения энергии, а также активизации перистальтики. Микрофлора толстой кишки помогает расщепить значительную часть целлюлозы, в результате чего также образуются короткие жирные кислоты. Значительная часть этих жирных кислот всасывается в клетки слизистой оболочки толстой кишки, в которых их расщепление покрывает часть энергетической потребности данных клеток.
В ходе этого процесса образуются короткие жирные кислоты, которые всасываются в кровь и которые организм может использовать для получения энергии, а также активизации перистальтики. Микрофлора толстой кишки помогает расщепить значительную часть целлюлозы, в результате чего также образуются короткие жирные кислоты. Значительная часть этих жирных кислот всасывается в клетки слизистой оболочки толстой кишки, в которых их расщепление покрывает часть энергетической потребности данных клеток.
Исследование белка S100 (S100 protein), правила подготовки к сдаче анализа, расшифровка результатов и показатели нормы.
Подтверждаю
Подробнее
- ИНВИТРО org/ListItem»>Библиотека
- Лабораторная…
- Белок S100 (S100…
Аллергия
Рак шейки матки
Рак матки
Ревматизм
Артрит
771
18 Ноября
ВАЖНО!
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Для корректной оценки результатов ваших анализов в динамике предпочтительно делать исследования в одной и той же лаборатории, так как в разных лабораториях для выполнения одноименных анализов могут применяться разные методы исследования и единицы измерения.
Напоминаем вам, что самостоятельная интерпретация результатов недопустима, приведенная ниже информация носит исключительно справочный характер.
Белок S100: показания к назначению, правила подготовки к сдаче анализа, расшифровка результатов и показатели нормы.
Показания для назначения исследования
Белок S100 представляет собой вещество (белок), которое присутствует во многих органах (в коже, печени, почках, сердце и др.). Его основная особенность заключается в способности связывать кальций и за счет этого влиять на многие процессы, происходящие в организме. Этот белок необходим для нормальной работы клеток органов и тканей, но самое большое содержание S100 выявлено в клетках головного мозга.
Этот белок необходим для нормальной работы клеток органов и тканей, но самое большое содержание S100 выявлено в клетках головного мозга.
Уровень белка S100 в крови позволяет оценить степень повреждения мозга при инсульте, черепно-мозговой травме и других состояниях, приводящих к неврологическим заболеваниям. Концентрация белка S100 повышается при онкологических заболеваниях. Огромное значение имеет исследование уровня белка S100 для оценки и контроля лечения рака кожи.
Подготовка к процедуре
- Предпочтительно выдержать 4 часа после последнего приема пищи.
- Рекомендуется сдавать кровь утром, в период с 8 до 11 часов, накануне избегать пищевых перегрузок.
- Исключить прием алкоголя накануне исследования.
- Не курить минимально в течение 1 часа до исследования.
- Исключить физические и эмоциональные перегрузки накануне исследования.
- При исследовании концентрации белка S100 в динамике рекомендуется проводить повторные исследования в одной и той же лаборатории.

Срок исполнения
1 рабочий день, исключая день взятия биоматериала.
Что может повлиять на результаты
Обычно результат оказывается корректным, если соблюдены все правила подготовки к исследованию. Важно помнить, что физиологическое повышение уровня белка S100 фиксируется после интенсивных занятий спортом.
Белок S100
Для исследования берется кровь из вены.
Сдать анализ на уровень белка S100 (S100 protein) можно в ближайшем медицинском офисе ИНВИТРО. Список офисов, где принимается биоматериал для лабораторного исследования, представлен в разделе «Адреса».
Референсные значения
В норме концентрация белка S100 в крови менее 0,105 мкг/л. Интерпретация результата проводится с целью комплексной оценки состояния при различных заболеваниях головного мозга, прогноза и контроля лечения при онкологии, а также при воспалительных процессах, например, при ревматоидном артрите.
Существуют несколько разных видов белка S100. Для указания вида белка S100 к названию прибавляют буквенно-цифровое обозначение, например, S100А1. Разные виды белка S100 характерны для различных органов. Определение конкретного вида белка S100 имеет значение в кардиологии, онкологии, при травмах и патологиях головного мозга.
В кардиологии повышенные концентрации таких видов как S100A1, S100A2 и S100A4 позволяют судить об остром повреждении клеток сердца (инфаркте миокарда) и инфекционном эндокардите (поражении сердца, особенно его клапанов, различными бактериями). Уровень S100 используют в дополнение к «классическим» биомаркерам: креатинкиназе (СК), креатинкиназе-МВ (СК-МВ) и тропонину-I.
Исследование группы белков S100 является ценным у пациентов с воспалительными заболеваниями и аллергией. При остром воспалении, как правило, повышаются уровни S100A8, S100A9 и / или S100A12. Эти белки считаются неспецифическими маркерами активации фагоцитов (клеток, уничтожающих бактерии и вирусы), поэтому определение значений S100A8 / A9 и S100A12 с другими маркерами того или иного заболевания повышает диагностическую точность. В таблице представлена связь белка S100 с некоторыми заболеваниями.
В таблице представлена связь белка S100 с некоторыми заболеваниями.
|
Показатель (белок S100) |
Болезни, при которых S100 играет роль дополнительного биомаркера воспаления и аллергии |
|
S100В |
Витилиго (нарушение пигментации кожи) |
|
S100А4 |
Связь между воспалением и прогрессированием опухоли Аллергия Сезонный аллергический ринит (аллергический насморк) |
|
S100А7 |
Псориаз (воспалительное заболевание кожи) |
|
S100А8 |
Ревматоидный артрит (хроническое воспаление суставов) Болезнь Крона (хроническое заболевание кишечника) Воспаление желудочно-кишечного тракта Воспалительные заболевания легких |
|
S100А12 |
Болезнь Кавасаки (повреждение мелких сосудов собственной иммунной системой) Воспаление сосудов и атеросклероз |
Представляемый Независимой лабораторией ИНВИТРО тест количественного определения S100 направлен на выявление таких видов белка как S100A1B и S100BB.
Белок S100 (S100 Protein)
Синонимы: Анализ крови на белок S100.
S100B Protein.
Краткая характеристика определяемого вещества Белок S100
S100 (известно по крайней мере 25 представителей: S100A…
До 1 рабочего дня
Доступно с выездом на дом
3 035 руб
В корзину
Эти разновидности белка S100 содержатся в клетках мозга. При заболеваниях (инсульте, болезни Альцгеймера, черепно-мозговых травмах и т.д.), когда клетки мозга разрушаются, S100 оказывается во внеклеточной жидкости, а затем в крови. Таким образом, исследование концентрации белка S100 в крови отражает тяжесть повреждения мозга.
Концентрация белка S100 может изменяться при многих онкологических заболеваниях. Разные виды белка S100 используют для прогноза течения и контроля лечения разных видов рака (рака молочной железы, желудка, поджелудочной железы, легкого и т.д.).
Важную роль уровень S100 играет в диагностике рака кожи (меланоме). Клетки этой опухоли активно вырабатывают белок S100B, что позволяет использовать уровень его концентрации в крови в качестве онкомаркера. Выявлена тесная связь между стадией меланомы и степенью повышения S100 в крови, поэтому важно исследовать содержание этого белка в динамике. По увеличению концентрации S100 в крови по сравнению с предыдущим значением можно судить об агрессивном течении болезни.
Причины повышения уровня S100 в крови
- Воспалительные заболевания и аллергия.
- Заболевания сердца.
- Онкологические заболевания.
- Заболевания головного мозга.
Источники:
- Клинические рекомендации «Меланома кои и слизистых оболочек» (дети).
 Разраб.: Ассоциация онкологов России, Ассоциация специалистов по проблемам меланомы, Российское общество клинической онкологии, Национальное общество детских гематологов, онкологов, Российское общество детских онкологов. – 2020.
Разраб.: Ассоциация онкологов России, Ассоциация специалистов по проблемам меланомы, Российское общество клинической онкологии, Национальное общество детских гематологов, онкологов, Российское общество детских онкологов. – 2020. - Клинические рекомендации «Меланома кои и слизистых оболочек» (взрослые). Разраб.: Ассоциация онкологов России, Ассоциация специалистов по проблемам меланомы, Российское общество клинической онкологии. – 2020.
- Клинические рекомендации «Стабильная ишемическая болезнь сердца». Разраб.: Российское кардиологическое общество, Национальное общество по изучению атеросклероза, Национальное общество по атеротромбозу, Ассоциация сердечно-сосудистых хирургов России. Российское кардиологическое общество, Ассоциация сердечно-сосудистых хирургов России – 2020.
ВАЖНО!
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Для корректной оценки результатов ваших анализов в динамике предпочтительно делать исследования в одной и той же лаборатории, так как в разных лабораториях для выполнения одноименных анализов могут применяться разные методы исследования и единицы измерения.
Рекомендации
Анализ на ПСА (простатический специфический антиген)
373
13 Мая
Вирус папилломы человека
3589
04 Мая
Щелочная фосфатаза
305
16 Апреля
Показать еще
Похожие статьи
Ветряная оспа
Краснуха
Корь
Подагра
Энцефалит
Гепатит
Ревматизм
С-реактивный белок (СРБ, CRP)
С-реактивный белок (СРБ, CRP): показания к назначению, правила подготовки к сдаче анализа, расшифровка результатов и показатели нормы.
Подробнее
Пиелонефрит
Сахарный диабет
Гепатит
Ревматизм
Мочевина в крови (Диамид угольной кислоты, карбамид, Urea nitrogen, Urea, Blood Urea Nitrogen (BUN), Urea, Plasma Urea)
Мочевина в крови: показания к назначению, правила подготовки к сдаче анализа, расшифровка результатов и показатели нормы.
Подробнее
Атеросклероз
Сахарный диабет
Артрит
Подагра
Холестерин
Холестерин: показания к назначению, правила подготовки к сдаче анализа, расшифровка результатов и показатели нормы.
Подробнее
Гепатит
Желтуха
Рак шейки матки
Сахарный диабет
Общий белок (в крови) (Protein total)
Общий белок (в крови) (Protein total): показания к назначению, правила подготовки к сдаче анализа, расшифровка результатов и показатели нормы.
Подробнее
Дисбактериоз
Аллергия
Анализ кала
Лямблии: вопросы и ответы
Добрый день! У моей дочери дисбактериоз (судя по аназизам).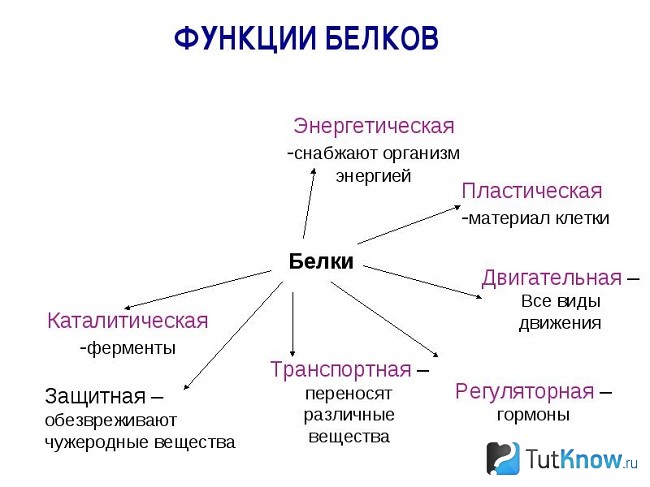 Врач назначила пить аципол, но толку что-то мало. У меня подозрения, может у дочери есть какие-то паразиты в организме. Скажите, на какие паразиты нужно сдать, чтобы хоть это исключить. ребенка переодически высыпает, от аципола толку чуть. Спасибо.
Врач назначила пить аципол, но толку что-то мало. У меня подозрения, может у дочери есть какие-то паразиты в организме. Скажите, на какие паразиты нужно сдать, чтобы хоть это исключить. ребенка переодически высыпает, от аципола толку чуть. Спасибо.
Подробнее
Подпишитесь на наши рассылки
Введите e-mail
Даю согласие на
обработку персональных данных
Подписаться
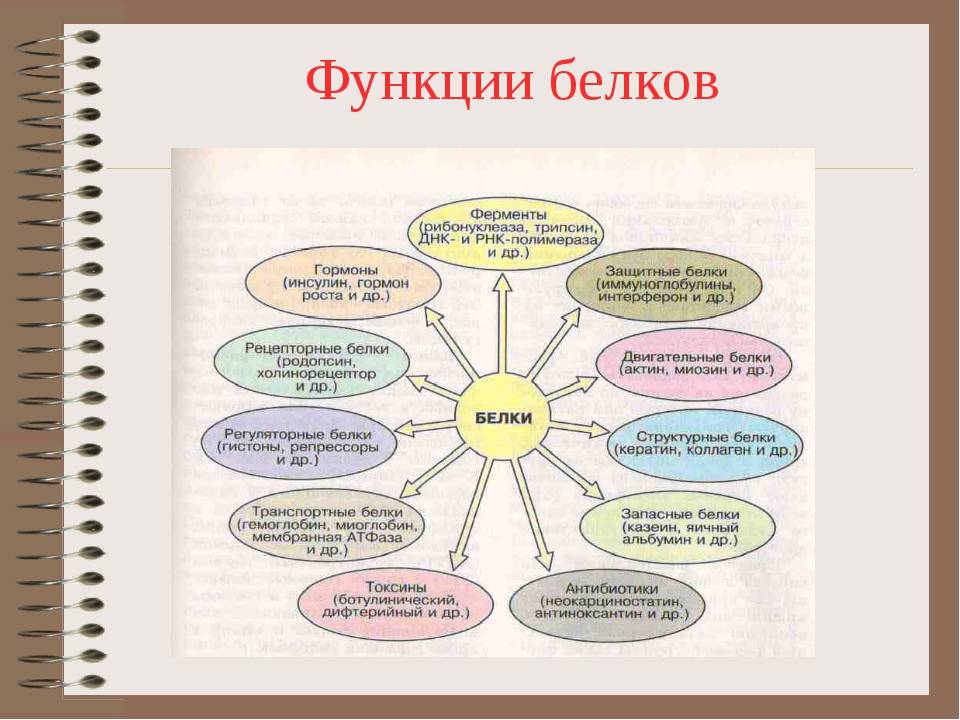
Функция белков | Биология для специальностей I
Результаты обучения
- Определение нескольких основных функций белков
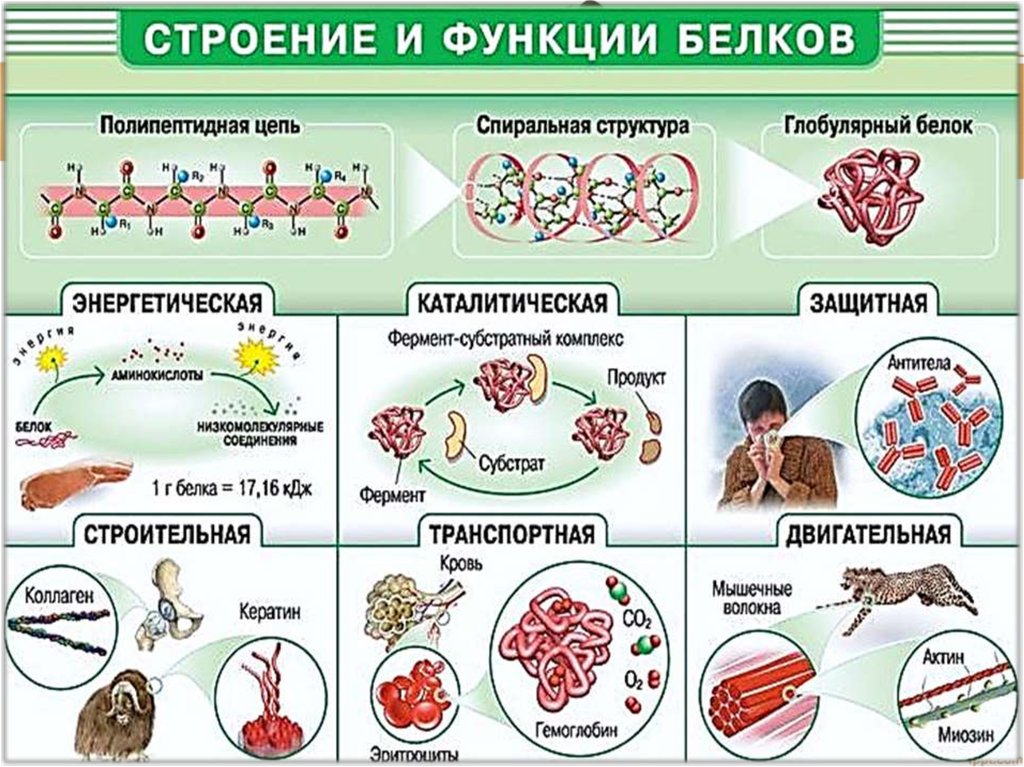
Основные типы и функции белков перечислены в таблице 1.
| Таблица 1. Типы и функции белков | ||
|---|---|---|
| Тип | Примеры | Функции |
| Пищеварительные ферменты | Амилаза, липаза, пепсин, трипсин | Помощь в переваривании пищи путем катаболизма питательных веществ в мономерные единицы |
| Транспорт | Гемоглобин, альбумин | Переносят вещества с кровью или лимфой по всему телу |
| Структурный | Актин, тубулин, кератин | Создание различных структур, таких как цитоскелет |
| Гормоны | Инсулин, тироксин | Координация деятельности различных систем организма |
| Защита | Иммуноглобулины | Защита организма от чужеродных патогенов |
| Сократительный | Актин, миозин | Эффект сокращения мышц |
| Хранение | Запасные белки бобовых, яичный белок (альбумин) | Обеспечивает питание на раннем этапе развития зародыша и проростка |
Двумя особыми и распространенными типами белков являются ферменты и гормоны. Ферменты , которые вырабатываются живыми клетками, являются катализаторами биохимических реакций (таких как пищеварение) и обычно представляют собой сложные или сопряженные белки. Каждый фермент специфичен для субстрата (реагента, который связывается с ферментом), на который он действует. Фермент может помочь в реакциях распада, перегруппировки или синтеза. Ферменты, которые расщепляют свои субстраты, называются катаболическими ферментами, ферменты, которые строят более сложные молекулы из своих субстратов, называются анаболическими ферментами, а ферменты, влияющие на скорость реакции, называются каталитическими ферментами. Следует отметить, что все ферменты увеличивают скорость реакции и поэтому считаются органическими катализаторами. Примером фермента является амилаза слюны, которая гидролизует свой субстрат амилозу, компонент крахмала.
Ферменты , которые вырабатываются живыми клетками, являются катализаторами биохимических реакций (таких как пищеварение) и обычно представляют собой сложные или сопряженные белки. Каждый фермент специфичен для субстрата (реагента, который связывается с ферментом), на который он действует. Фермент может помочь в реакциях распада, перегруппировки или синтеза. Ферменты, которые расщепляют свои субстраты, называются катаболическими ферментами, ферменты, которые строят более сложные молекулы из своих субстратов, называются анаболическими ферментами, а ферменты, влияющие на скорость реакции, называются каталитическими ферментами. Следует отметить, что все ферменты увеличивают скорость реакции и поэтому считаются органическими катализаторами. Примером фермента является амилаза слюны, которая гидролизует свой субстрат амилозу, компонент крахмала.
Гормоны представляют собой химические сигнальные молекулы, обычно небольшие белки или стероиды, секретируемые эндокринными клетками, которые контролируют или регулируют определенные физиологические процессы, включая рост, развитие, обмен веществ и размножение.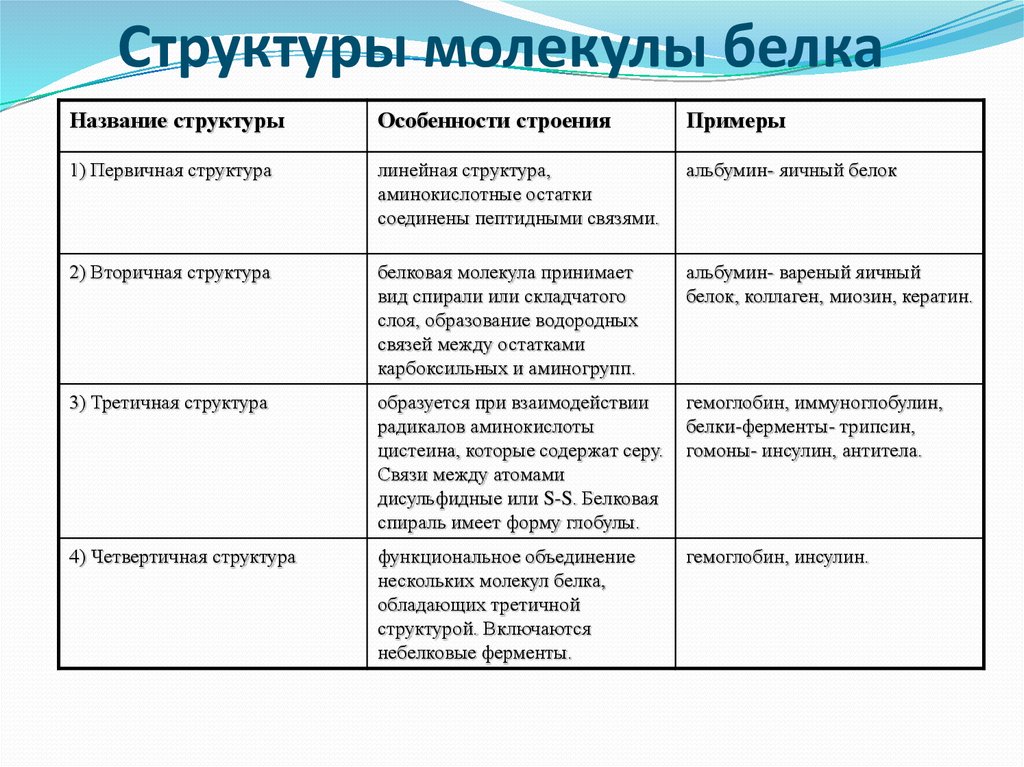 Например, инсулин — это белковый гормон, который помогает регулировать уровень глюкозы в крови.
Например, инсулин — это белковый гормон, который помогает регулировать уровень глюкозы в крови.
Белки имеют различную форму и молекулярную массу; некоторые белки имеют глобулярную форму, тогда как другие имеют волокнистую природу. Например, гемоглобин представляет собой глобулярный белок, а коллаген, обнаруженный в нашей коже, представляет собой волокнистый белок. Форма белка имеет решающее значение для его функции, и эта форма поддерживается множеством различных типов химических связей. Изменения температуры, рН и воздействие химических веществ могут привести к необратимым изменениям формы белка, что приведет к потере функции, известной как денатурация. Различное расположение одних и тех же 20 типов аминокислот составляют все белки. Недавно были обнаружены две новые редкие аминокислоты (селеноцистеин и пирролизин), и этот список может быть дополнен новыми открытиями.
Кратко: Функции белков
Белки представляют собой класс макромолекул, выполняющих разнообразные функции в клетке. Они помогают в обмене веществ, обеспечивая структурную поддержку и действуя как ферменты, переносчики или гормоны. Строительными блоками белков (мономеры) являются аминокислоты. Каждая аминокислота имеет центральный углерод, который связан с аминогруппой, карбоксильной группой, атомом водорода и группой R или боковой цепью. Существует 20 часто встречающихся аминокислот, каждая из которых отличается группой R. Каждая аминокислота связана со своими соседями пептидной связью. Длинная цепь аминокислот известна как полипептид.
Они помогают в обмене веществ, обеспечивая структурную поддержку и действуя как ферменты, переносчики или гормоны. Строительными блоками белков (мономеры) являются аминокислоты. Каждая аминокислота имеет центральный углерод, который связан с аминогруппой, карбоксильной группой, атомом водорода и группой R или боковой цепью. Существует 20 часто встречающихся аминокислот, каждая из которых отличается группой R. Каждая аминокислота связана со своими соседями пептидной связью. Длинная цепь аминокислот известна как полипептид.
Белки организованы на четырех уровнях: первичном, вторичном, третичном и (необязательно) четвертичном. Первичная структура представляет собой уникальную последовательность аминокислот. Локальная укладка полипептида с образованием таких структур, как спираль α и складчатый лист β , составляет вторичную структуру. Общая трехмерная структура является третичной структурой. Когда два или более полипептида объединяются, образуя полную структуру белка, такая конфигурация известна как четвертичная структура белка.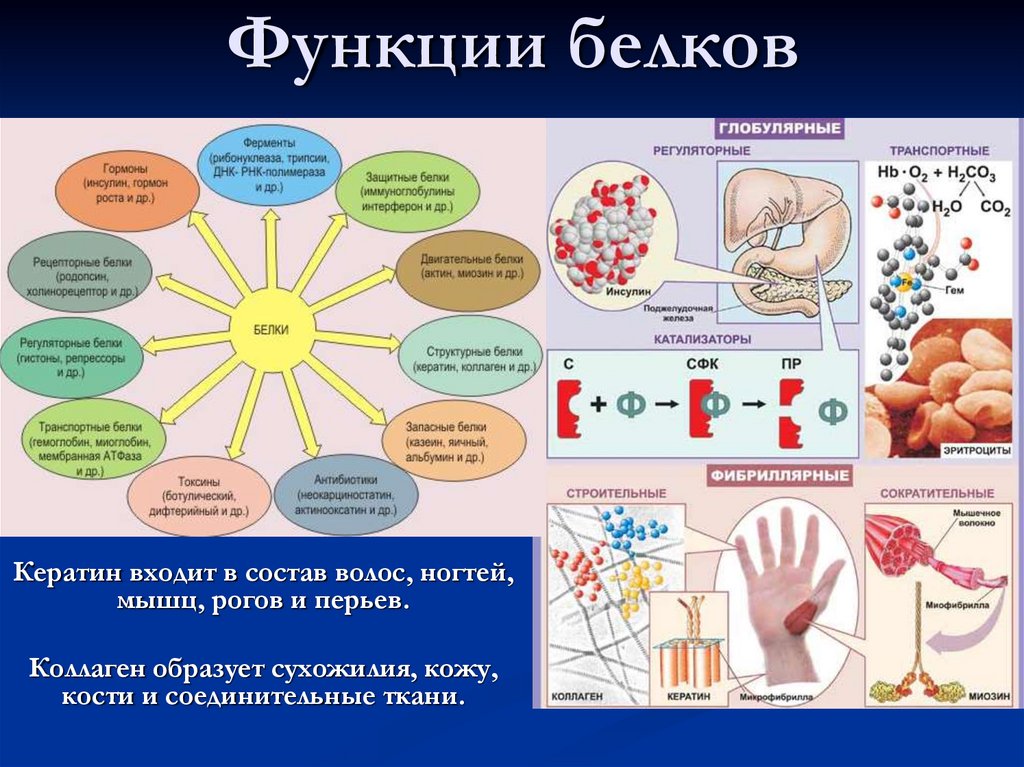 Форма и функция белка неразрывно связаны; любое изменение формы, вызванное изменением температуры или pH, может привести к денатурации белка и потере функции.
Форма и функция белка неразрывно связаны; любое изменение формы, вызванное изменением температуры или pH, может привести к денатурации белка и потере функции.
Попробуйте
У вас есть идеи по улучшению этого контента? Мы будем признательны за ваш вклад.
Улучшить эту страницуПодробнее
Незаменимые аминокислоты: таблица, сокращения и структура
Аминокислоты являются строительными блоками, из которых формируются полипептиды и, в конечном счете, белки. Следовательно, они являются основными компонентами нашего тела и жизненно важны для физиологических функций, таких как синтез белка, восстановление тканей и усвоение питательных веществ. Здесь мы более подробно рассмотрим свойства аминокислот, то, как они используются в организме и откуда берутся.
Таблица аминокислот
Белки состоят из 20 аминокислот, и все они имеют одинаковую базовую структуру, отличаясь только R-группой или боковой цепью.
Аминокислоты находятся в равновесии между двумя кислотами, при этом протон (H+) перемещается между аминогруппой и карбоксильной группой, как показано ниже.
В таком равновесии всегда преобладает более слабая кислота. Так как аммиак является более слабой кислотой, чем карбоновая кислота, равновесие будет лежать влево (в сторону «цвиттер-иона»). Хотя аминокислоты часто изображаются в учебниках как правосторонние, на самом деле они в основном существуют как левосторонние.
Простейшей и самой маленькой аминокислотой является глицин, у которого R-группа представляет собой водород (H). Их можно подразделить в соответствии с их свойствами, определяемыми функциональными группами, которыми они обладают. В широком смысле они делятся по заряду, гидрофобности и полярности. Эти свойства влияют на то, как они взаимодействуют с окружающими аминокислотами в полипептидах и белках, и, следовательно, влияют на трехмерную структуру и свойства белков.
На этой диаграмме показаны химические структуры 20 аминокислот, из которых состоят белки.
Сокращения аминокислот
В этой таблице показаны сокращения и однобуквенные коды, используемые для 20 аминокислот, содержащихся в белках. Кроме того, синим цветом отмечены пирролизин, используемый в биосинтезе белков у некоторых архей и бактерий, но не присутствующий у людей, и селеноцистеин, аналог цистеина, обнаруженный только в некоторых линиях. Наконец, аббревиатуры, используемые для аминокислотных остатков с более чем одной потенциальной идентичностью, и терминирующий кодон показаны красным, чтобы завершить алфавит однобуквенных аббревиатур.
Кроме того, синим цветом отмечены пирролизин, используемый в биосинтезе белков у некоторых архей и бактерий, но не присутствующий у людей, и селеноцистеин, аналог цистеина, обнаруженный только в некоторых линиях. Наконец, аббревиатуры, используемые для аминокислотных остатков с более чем одной потенциальной идентичностью, и терминирующий кодон показаны красным, чтобы завершить алфавит однобуквенных аббревиатур.
Amino acid | Abbreviation | Single letter abbreviation |
Alanine | Ala | А |
Аргинин | Arg | R |
Asparagine | Asn | N |
Кислота аспарагиновая | Аспид | D |
Cysteine | Cys | C |
Glutamine | Gln | Q |
Глутаминовая кислота | Glu | E |
Glycine | Gly | G |
Гистидин | Гис | H |
Isoleucine | Ile | I |
Leucine | Leu | Л |
Лизин | Lys | K |
Methionine | Met | M |
Phenylalanine | Фе | F |
Proline | Pro | P |
Serine | Ser | S |
Треонин | Thr | T |
Tryptophan | Trp | W |
Tyrosine | Тир | Д |
Valine | Val | V |
Pyrrolysine | Pyl | O |
Селенцистеин | Секунда | U |
Aspartic acid or Asparagine | Asx | B |
Glutamic acid or Glutamine | Glx | Z |
Любая аминокислота | Xaa | X |
Leucine or Isoleucine | Xle | J |
Termination codon | СРОК |
Аминокислота Ala
Обнаруженный в белке в 1875 году, аланин составляет 30% остатков в шелке.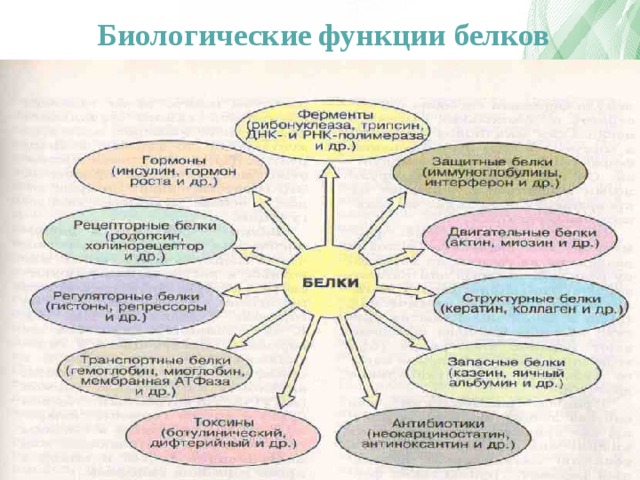 Его низкая реакционная способность способствует простой, удлиненной структуре шелка с небольшим количеством поперечных связей, что придает волокнам прочность, устойчивость к растяжению и гибкость. В биосинтезе белков участвует только l-стереоизомер.
Его низкая реакционная способность способствует простой, удлиненной структуре шелка с небольшим количеством поперечных связей, что придает волокнам прочность, устойчивость к растяжению и гибкость. В биосинтезе белков участвует только l-стереоизомер.
Аминокислота Arg
В организме человека аргинин вырабатывается при переваривании белков. Затем он может быть преобразован в оксид азота в организме человека, химическое вещество, которое, как известно, расслабляет кровеносные сосуды.
Из-за его сосудорасширяющего действия аргинин был предложен для лечения людей с хронической сердечной недостаточностью, высоким уровнем холестерина, нарушением кровообращения и высоким кровяным давлением, хотя исследования в этой области все еще продолжаются. Аргинин также может быть получен синтетическим путем, а соединения, родственные аргинину, могут использоваться для лечения людей с дисфункцией печени из-за его роли в стимулировании регенерации печени. Хотя аргинин необходим для роста, а не поддержания тела, исследования показали, что аргинин имеет решающее значение для процесса заживления ран, особенно у людей с плохим кровообращением.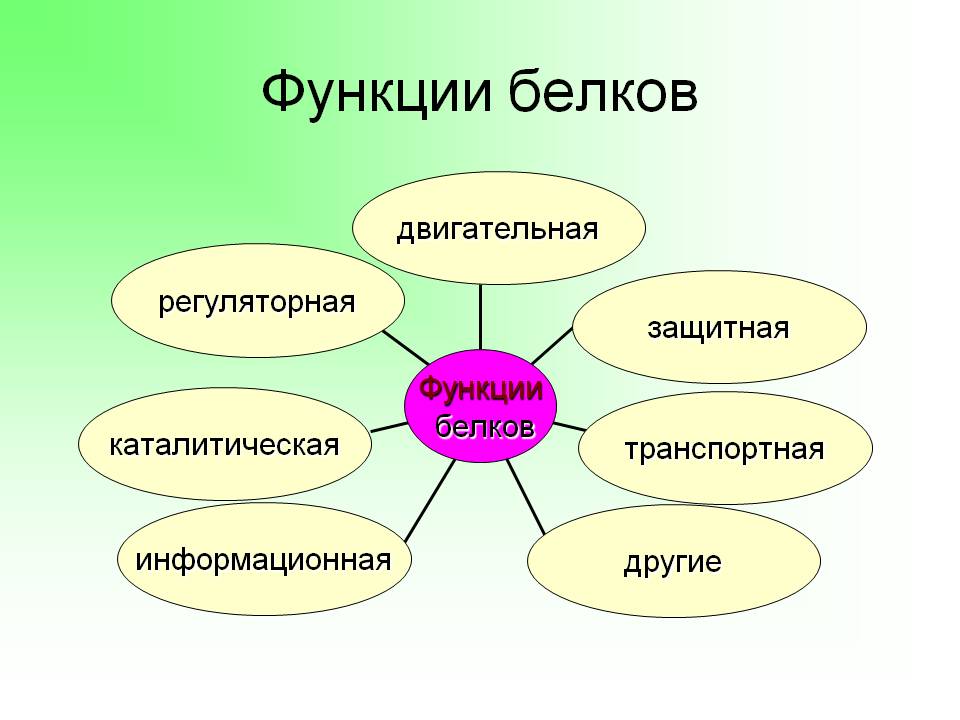
Аминокислота Asn
В 1806 году аспарагин был выделен из сока спаржи, что сделало его первой аминокислотой, выделенной из природного источника. Однако только в 1932 году ученым удалось доказать, что аспарагин присутствует в белках. В биосинтезе белков млекопитающих участвует только l-стереоизомер. Аспарагин играет важную роль в удалении токсичного аммиака из организма.
Аминокислота Asp
Обнаруженная в белках в 1868 году, аспарагиновая кислота обычно встречается в животных белках, однако в биосинтезе белков участвует только L-стереоизомер. Растворимость этой аминокислоты в воде способствует присутствию рядом с активными центрами ферментов, таких как пепсин.
Аминокислота Cys
Цистеин особенно богат белками волос, копыт и кератином кожи, поскольку он был выделен из мочевого конкремента в 1810 году и из рога в 1899 году. и структура решена в 1903–1904 гг.
Серосодержащая тиольная группа в боковой цепи цистеина играет ключевую роль в его свойствах, обеспечивая образование дисульфидных мостиков между двумя пептидными цепями (как в случае с инсулином) или образование петель внутри одной цепи, влияя на конечную структуру белка. Две молекулы цистеина, связанные вместе дисульфидной связью, составляют аминокислоту цистин, которая иногда указывается отдельно в общих списках аминокислот. Цистеин вырабатывается в организме из серина и метионина и присутствует только в L-стереоизомере белков млекопитающих.
Две молекулы цистеина, связанные вместе дисульфидной связью, составляют аминокислоту цистин, которая иногда указывается отдельно в общих списках аминокислот. Цистеин вырабатывается в организме из серина и метионина и присутствует только в L-стереоизомере белков млекопитающих.
Люди с генетическим заболеванием цистинурия неспособны эффективно реабсорбировать цистин в кровь. Следовательно, высокий уровень цистина накапливается в их моче, где он кристаллизуется и образует камни, блокирующие почки и мочевой пузырь.
Аминокислота Gln
Глютамин был впервые выделен из свекольного сока в 1883 г., выделен из белка в 1932 г., а в следующем году синтезирован химически. Глютамин является наиболее распространенной аминокислотой в нашем организме и выполняет несколько важных функций. В организме человека глютамин синтезируется из глютаминовой кислоты, и этот этап превращения жизненно важен для регулирования уровня токсичного аммиака в организме с образованием мочевины и пуринов.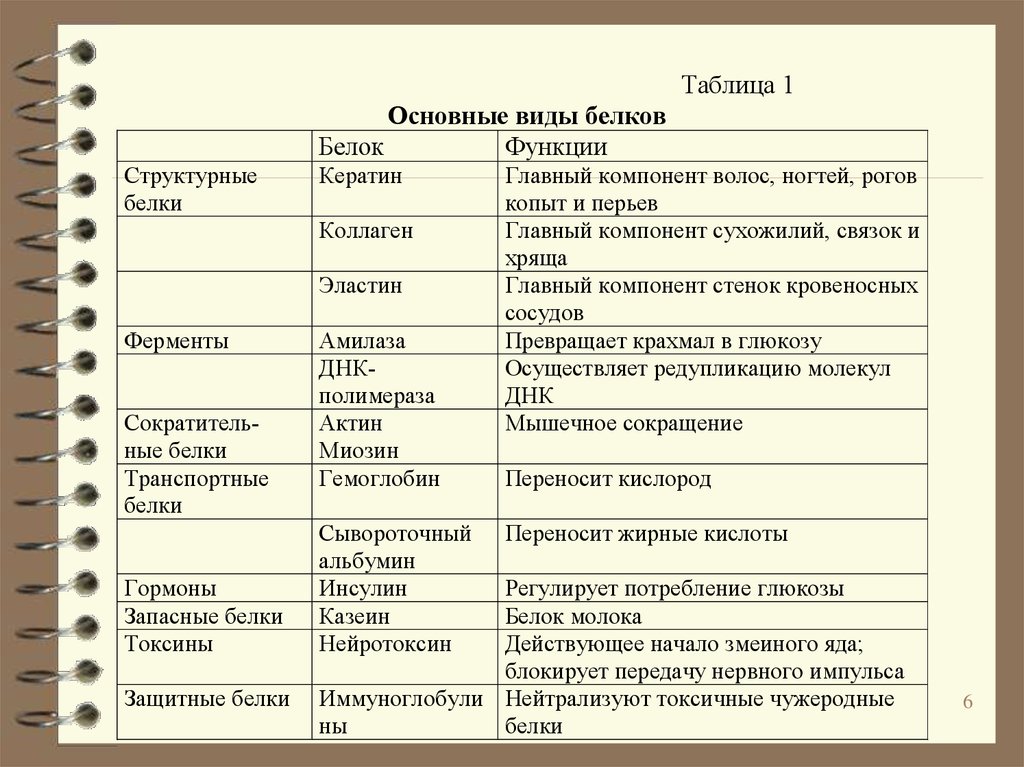
Аминокислота Glu
Глутаминовая кислота была выделена из глютена пшеницы в 1866 г. и химически синтезирована в 1890 г. Обычно встречается в животных белках, только L-стереоизомер встречается в белках млекопитающих, которые люди могут синтезировать из общего промежуточного соединения. α-кетоглутаровая кислота. Мононатриевая соль l-глутаминовой кислоты, глутамат натрия (MSG), обычно используется в качестве приправы и усилителя вкуса. Карбоксильная боковая цепь глутаминовой кислоты способна действовать как донор и акцептор аммиака, который токсичен для организма, обеспечивая безопасную транспортировку аммиака в печень, где он превращается в мочевину и выводится почками. Свободная глутаминовая кислота также может разлагаться до углекислого газа и воды или превращаться в сахара.
Аминокислота Gly
Глицин был первой аминокислотой, выделенной из белка, в данном случае желатина, и единственной, которая не является оптически активной (нет d- или l-стереоизомеров). ). Структурно самая простая из α-аминокислот, она практически не реагирует при включении в белки. Тем не менее, глицин играет важную роль в биосинтезе аминокислоты серина, кофермента глутатиона, пуринов и гема, жизненно важной части гемоглобина.
). Структурно самая простая из α-аминокислот, она практически не реагирует при включении в белки. Тем не менее, глицин играет важную роль в биосинтезе аминокислоты серина, кофермента глутатиона, пуринов и гема, жизненно важной части гемоглобина.
Его аминокислота
Гистидин был выделен в 1896 году, а его структура была подтверждена химическим синтезом в 1911 году. Гистидин является прямым предшественником гистамина, а также важным источником углерода в синтезе пуринов. При включении в белки боковая цепь гистидина может действовать как акцептор и донор протонов, передавая важные свойства при объединении с ферментами, такими как химотрипсин, и теми, которые участвуют в метаболизме углеводов, белков и нуклеиновых кислот.
Для младенцев гистидин считается незаменимой аминокислотой, взрослые могут в течение короткого времени обходиться без приема пищи, но все же считается незаменимой.
Ile аминокислота
Изолейцин был выделен из свекловичной патоки в 1904 году. Гидрофобная природа боковой цепи изолейцина важна для определения третичной структуры белков, в которые он входит.
Гидрофобная природа боковой цепи изолейцина важна для определения третичной структуры белков, в которые он входит.
Те, кто страдает от редкого наследственного заболевания, называемого болезнью мочи кленового сиропа, имеют неисправный фермент в пути деградации, общем для изолейцина, лейцина и валина. Без лечения метаболиты накапливаются в моче пациента, вызывая характерный запах, который и дал название этому заболеванию.
Leu аминокислота
Лейцин был выделен из сыра в 1819 году и из мышц и шерсти в кристаллическом состоянии в 1820 году. В 1891 году он был синтезирован в лаборатории.
В белке млекопитающих присутствует только L-стереоизомер, который может расщепляться ферментами организма до более простых соединений. Некоторые ДНК-связывающие белки содержат области, в которых лейцины расположены в конфигурациях, называемых лейциновыми застежками-молниями.
Lys аминокислота
Лизин был впервые выделен из казеина молочного белка в 1889 г. , а его структура была установлена в 1902 г. Лизин играет важную роль в связывании ферментов с коферментами и играет важную роль в образовании гистонов. функция.
, а его структура была установлена в 1902 г. Лизин играет важную роль в связывании ферментов с коферментами и играет важную роль в образовании гистонов. функция.
Многие зерновые культуры содержат очень мало лизина, что привело к дефициту лизина у некоторых групп населения, которые в значительной степени полагаются на него в пищу, а также у вегетарианцев и людей, придерживающихся диеты с низким содержанием жиров. Следовательно, были предприняты усилия по созданию штаммов кукурузы, богатых лизином.
Met аминокислота
Метионин был выделен из казеина молочного белка в 1922 году, а его структура была определена путем лабораторного синтеза в 1928 году. Метионин является важным источником серы для многих соединений в организме, включая цистеин и таурин. Благодаря содержанию серы метионин помогает предотвратить накопление жира в печени и способствует детоксикации метаболических отходов и токсинов.
Метионин является единственной незаменимой аминокислотой, которая не содержится в значительных количествах соевых бобов и поэтому производится в промышленных масштабах и добавляется во многие продукты из соевой муки.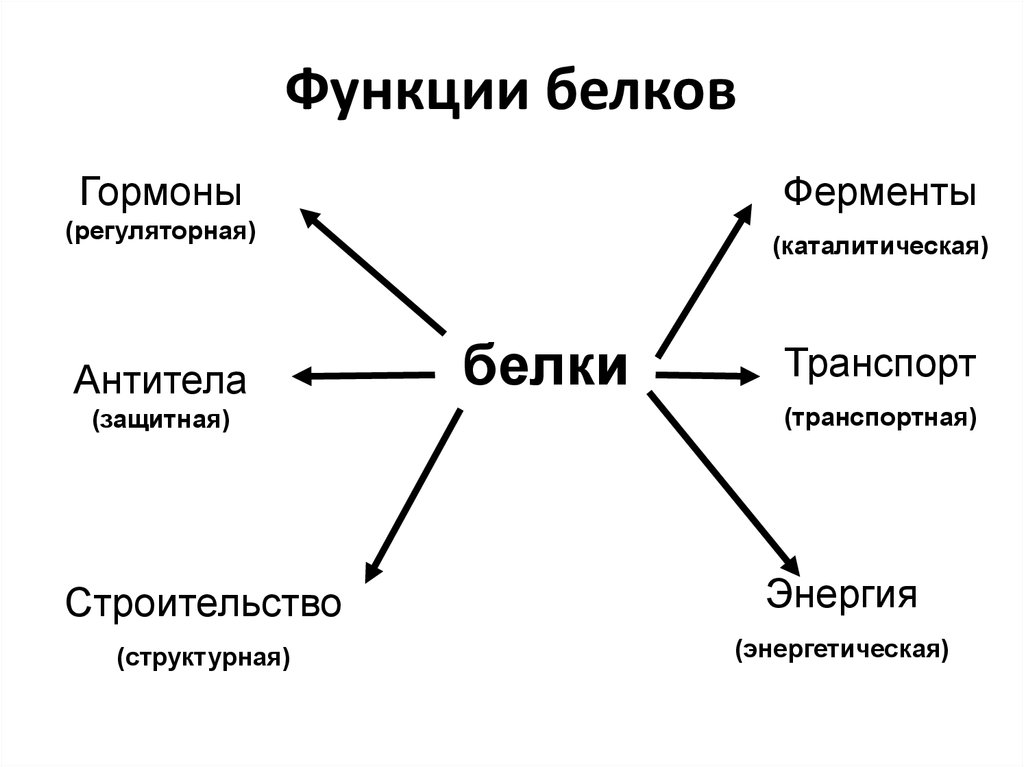
Phe аминокислота
Фенилаланин был впервые выделен из природного источника (ростки люпина) в 1879 году, а затем синтезирован химическим путем в 1882 году. у людей с наследственной фенилкетонурией (ФКУ) фермент, который выполняет это преобразование, неактивен. Если не лечить, фенилаланин накапливается в крови, вызывая задержку умственного развития у детей. На 10 000 детей, родившихся с этим заболеванием, переход на диету с низким содержанием фенилаланина в раннем возрасте может облегчить последствия.
Про аминокислота
В 1900 году был химически синтезирован пролин. В следующем году он был выделен из молочного белка казеина, и было показано, что его структура осталась прежней. Люди могут синтезировать пролин из глутаминовой кислоты, которая присутствует только в виде l-стереоизомера в белках млекопитающих. Когда пролин включается в белки, его особая структура приводит к резким изгибам или изгибам в пептидной цепи, что в значительной степени влияет на окончательную структуру белка.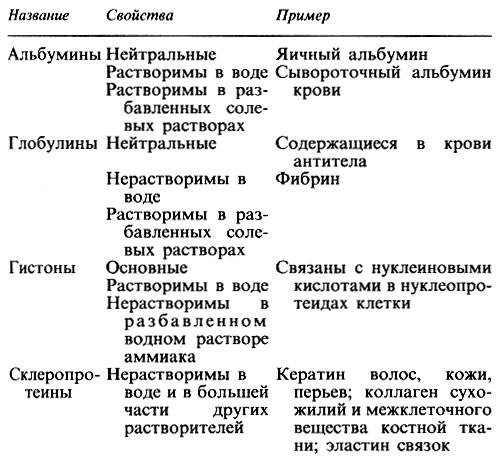 Пролин и его производное гидроксипролин составляют 21% аминокислотных остатков волокнистого белка коллагена, необходимого для соединительной ткани.
Пролин и его производное гидроксипролин составляют 21% аминокислотных остатков волокнистого белка коллагена, необходимого для соединительной ткани.
Ser аминокислота
Серин был впервые выделен из белка шелка в 1865 году, но его структура не была установлена до 1902 года. Люди могут синтезировать серин из других метаболитов, включая глицин, хотя только L-стереоизомер появляется в белках млекопитающих. Серин важен для биосинтеза многих метаболитов и часто важен для каталитической функции ферментов, в которые он включен, включая химотрипсин и трипсин.
Нервно-паралитические газы и некоторые инсектициды действуют путем соединения с остатком серина в активном центре ацетилхолинэстеразы, полностью ингибируя фермент. Активность эстеразы необходима для разрушения нейротрансмиттера ацетилхолина, в противном случае накапливается опасно высокий уровень, быстро приводящий к судорогам и смерти.
Thr аминокислота
Треонин был выделен из фибрина в 1935 году и синтезирован в том же году.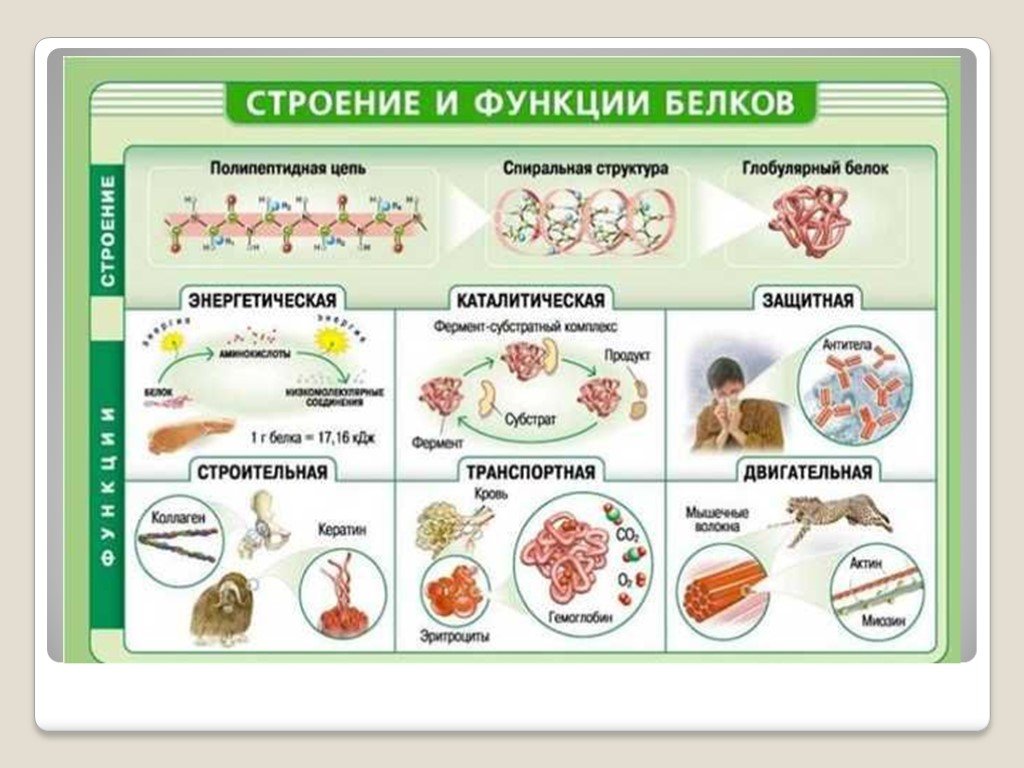 Только L-стереоизомер появляется в белках млекопитающих, где он относительно нереактивен. Хотя он важен во многих реакциях у бактерий, его метаболическая роль у высших животных, включая человека, остается неясной.
Только L-стереоизомер появляется в белках млекопитающих, где он относительно нереактивен. Хотя он важен во многих реакциях у бактерий, его метаболическая роль у высших животных, включая человека, остается неясной.
Trp аминокислота
Выделенный из казеина (молочный белок) в 1901 г., структура триптофана была установлена в 1907 г., но в белках млекопитающих присутствует только L-стереоизомер. В кишечнике человека бактерии расщепляют пищевой триптофан, высвобождая такие соединения, как скатол и индол, которые придают фекалиям неприятный запах. Триптофан превращается в витамин B3 (также называемый никотиновой кислотой или ниацином), но с недостаточной скоростью, чтобы поддерживать наше здоровье. Следовательно, мы также должны потреблять витамин B3, а невыполнение этого требования приводит к дефициту, называемому пеллагра.
Tyr аминокислота
В 1846 году тирозин был выделен в результате разложения казеина (белка из сыра), после чего он был синтезирован в лаборатории, а его структура определена в 1883 году. L-стереоизомера белков млекопитающих люди могут синтезировать тирозин из фенилаланина. Тирозин является важным предшественником гормонов надпочечников адреналина и норадреналина, гормонов щитовидной железы, включая тироксин, а также пигмента меланина для волос и кожи. В ферментах остатки тирозина часто связаны с активными центрами, изменение которых может изменить специфичность фермента или полностью уничтожить активность.
L-стереоизомера белков млекопитающих люди могут синтезировать тирозин из фенилаланина. Тирозин является важным предшественником гормонов надпочечников адреналина и норадреналина, гормонов щитовидной железы, включая тироксин, а также пигмента меланина для волос и кожи. В ферментах остатки тирозина часто связаны с активными центрами, изменение которых может изменить специфичность фермента или полностью уничтожить активность.
Страдающие серьезным генетическим заболеванием фенилкетонурия (ФКУ) неспособны преобразовывать фенилаланин в тирозин, в то время как у пациентов с алкаптонурией нарушен метаболизм тирозина, из-за чего выделяется моча, которая темнеет на воздухе.
Val аминокислота
Структура валина была установлена в 1906 году после того, как он впервые был выделен из альбумина в 1879 году. В белке млекопитающих присутствует только L-стереоизомер. Валин может расщепляться в организме на более простые соединения, но у людей с редким генетическим заболеванием, называемым болезнью мочи кленового сиропа, дефектный фермент прерывает этот процесс и может привести к летальному исходу, если его не лечить.
Свойства карбоксильной группы
- Все аминокислоты имеют карбоксильную группу и аминогруппу.
- При полимеризации аминокислот карбоксильная группа одной аминокислоты соединяется с аминогруппой следующей аминокислоты пептидной связью с потерей молекулы воды.
Свойства гидрофобных аминокислот
- Аминокислоты, подпадающие под классификацию гидрофобных, включают аланин, валин, изолейцин, лейцин, метионин, фенилаланин, триптофан и тирозин.
- Как следует из их классификации, боковые цепи имеют тенденцию отталкиваться от воды, поэтому это влияет на расположение этих аминокислот в третичной структуре белка.
Свойства полярных аминокислот
- Остатки полярных аминокислот обычно находятся снаружи белка после полимеризации из-за гидрофильных свойств боковой цепи.
- Четыре аминокислоты классифицируются как полярные, но не заряженные (аспарагин, глутамин, серин и треонин).

Свойства ароматических аминокислот
- Ароматические аминокислоты (фенилаланин, тирозин и триптофан), хотя и подпадают под другие классификации, имеют ароматические боковые цепи.
- Следовательно, все они в разной степени поглощают ультрафиолетовый свет, причем больше всего поглощает тирозин, а меньше всего фенилаланин.
Определение синтеза белка и код аминокислоты
Для образования белка аминокислоты полимеризуются с образованием пептидной связи, начиная с N-конца и заканчивая С-концом.
- Информационная РНК (мРНК), скопированная с ДНК, содержит инструкции о том, какую аминокислоту следует включить в какое положение для синтеза определенного белка.
- На рибосоме транспортная РНК (тРНК) присоединяется к одному концу мРНК, а к другому концу переносит необходимые аминокислоты.
- Дополнительные белковые факторы способствуют инициации, удлинению и прекращению синтеза белка.

- Генетическая информация, необходимая для определения того, какая аминокислота должна быть включена в какое положение, закодирована как серия из трех оснований или триплетов в мРНК, также называемая триплетным кодом. 64 возможных триплета и определяемые ими аминокислоты называются генетическим кодом или аминокислотным кодом.
- Многие аминокислоты кодируются более чем одним триплетным кодом, например аргинин, который добавляется, когда встречается CGU, CGC, CGA или CGG. У большинства организмов три (а иногда и два) триплета сигнализируют об окончании цепи.
Девять незаменимых аминокислот и аминокислотные добавки
Организм человека способен синтезировать 11 из 20 аминокислот, а остальные девять мы не можем. Вероятно, это происходит в результате потери или мутации генов с течением времени в ответ на меняющееся селективное давление, такое как обилие определенных продуктов, содержащих определенные аминокислоты. Поэтому они называются незаменимыми аминокислотами и должны поступать с пищей.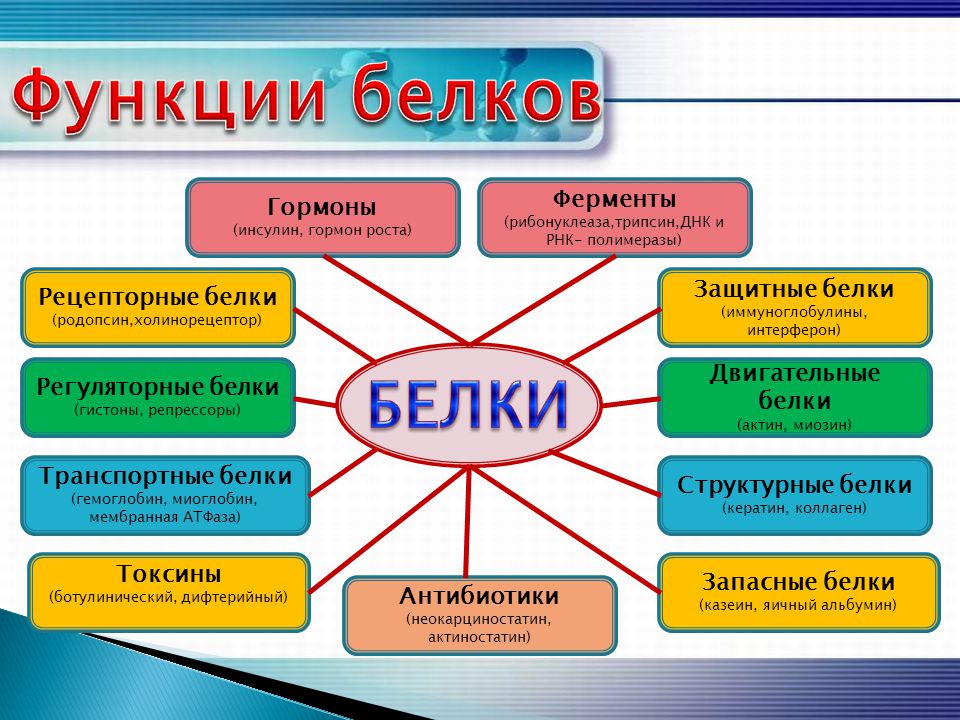
Отдельные виды животных способны синтезировать разные аминокислоты и, соответственно, их пищевые потребности различаются. Например, люди способны синтезировать аргинин, а собаки и кошки не могут — они должны получать его с пищей. В отличие от людей и собак, кошки не способны синтезировать таурин. Это одна из причин, по которой коммерческие корма для собак не подходят для кошек. Для человека девять аминокислот, которые должны быть получены с пищей, — это гистидин, изолейцин, лейцин, лизин, метионин, фенилаланин, треонин, триптофан и валин.
Продукты, содержащие все девять незаменимых аминокислот, называются «полноценными белками» и включают мясо, морепродукты, яйца, молочные продукты, сою, лебеду и гречку. Другие источники белка, такие как орехи, семена, злаки и бобы, содержат некоторые, но не все незаменимые аминокислоты, и поэтому их называют неполноценными.
В этой таблице указаны рекомендуемые в США суточные нормы девяти незаменимых аминокислот на 1 кг массы тела.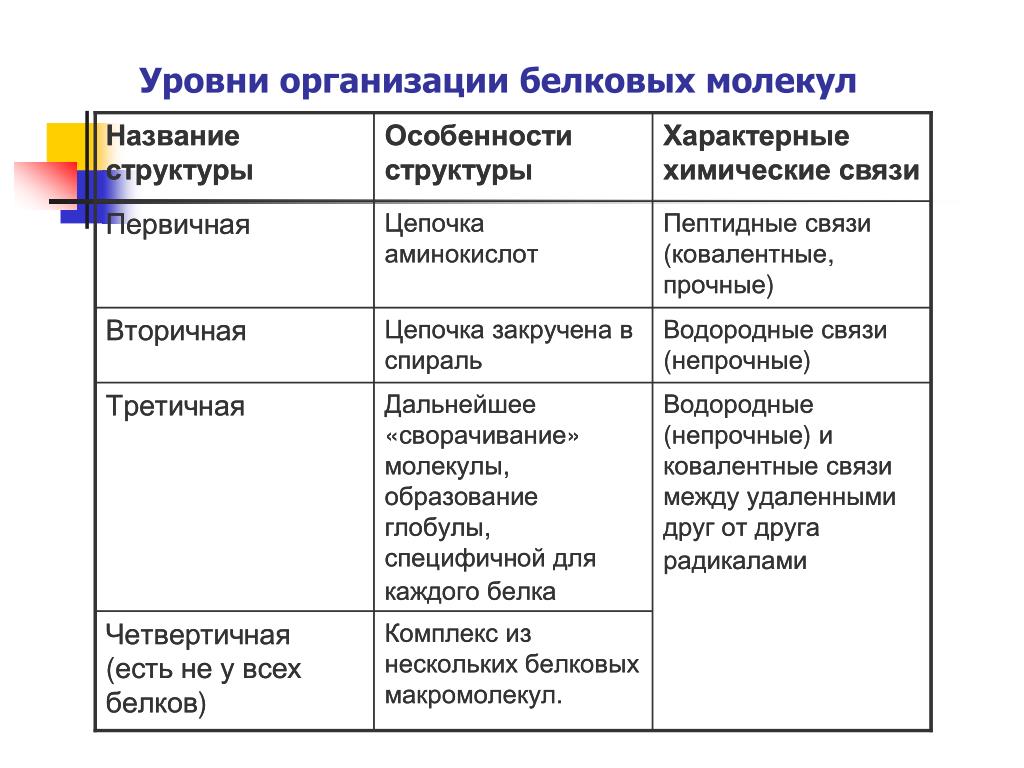
Amino acid | Recommended daily allowances (mg/kg body weight) |
Histidine | 14 |
Isoleucine | 19 |
Лейцин | 42 |
Lysine | 38 |
Methionine | 19 |
Phenylalanine | 33 |
Threonine | 20 |
Триптофан | 5 |
Valine | 24 |
Существуют также рекомендации для неоценимых аминоидов (19 мг/кг/кг).
Давайте поговорим о добавках. Все потребности организма в незаменимых аминокислотах могут быть удовлетворены за счет здоровой сбалансированной диеты. Тем не менее, есть некоторые сторонники приема добавок с высокой концентрацией для улучшения таких факторов, как настроение, сон, физическая работоспособность, потеря веса и предотвращение потери мышечной массы. Посмотрите на многие страницы о здоровье и благополучии, и вы увидите, что люди рекламируют преимущества добавок с аминокислотами, но есть ли веские доказательства, подтверждающие это?
Незаменимая аминокислота триптофан необходима для производства серотонина, нейротрансмиттера, играющего важную роль во сне, настроении и поведении. Следовательно, в ряде исследований изучалось влияние манипулирования уровнями триптофана на сон и настроение. Хотя есть доказательства того, что снижение уровня триптофана может негативно повлиять на сон и настроение, многие исследования страдают от небольших размеров выборки, отсутствия достаточного контроля или других недостатков.

 Разраб.: Ассоциация онкологов России, Ассоциация специалистов по проблемам меланомы, Российское общество клинической онкологии, Национальное общество детских гематологов, онкологов, Российское общество детских онкологов. – 2020.
Разраб.: Ассоциация онкологов России, Ассоциация специалистов по проблемам меланомы, Российское общество клинической онкологии, Национальное общество детских гематологов, онкологов, Российское общество детских онкологов. – 2020.