Содержание
Перекись водорода инструкция по применению: показания, противопоказания, побочное действие – описание Hydrogen peroxide р-р д/местн. и наружн. прим. 3%: фл. 40 мл или 100 мл 1, 50 или 80 шт.; фл. 500 мл 12 шт.; фл. 1000 мл 8 шт. (33316)
Раствор для местного и наружного применения прозрачный, бесцветный, без запаха.
| 100 мл | |
| водорода пероксид* | 3 г |
* в виде субстанции-раствора перекиси водорода 3%.
Вспомогательные вещества: натрия бензоат — 0.05 г, вода очищенная — до 100 мл.
40 мл — флаконы стеклянные (1) — пачки картонные.
40 мл — флаконы стеклянные (1) — пленка полиэтиленовая.
40 мл — флаконы-капельницы стеклянные (1) — пачки картонные.
40 мл — флаконы-капельницы стеклянные (1) — пленка полиэтиленовая.
40 мл — флаконы полиэтиленовые (1) — пачки картонные.
40 мл — флаконы полиэтиленовые (1) — пленка полиэтиленовая.
100 мл — флаконы стеклянные (1) — пачки картонные.
100 мл — флаконы стеклянные (1) — пленка полиэтиленовая.
100 мл — флаконы-капельницы стеклянные (1) — пачки картонные.
100 мл — флаконы-капельницы стеклянные (1) — пленка полиэтиленовая.
100 мл — флаконы полиэтиленовые (1) — пачки картонные.
100 мл — флаконы полиэтиленовые (1) — пленка полиэтиленовая.
40 мл — флаконы стеклянные (80) — коробки картонные (для стационаров).
40 мл — флаконы стеклянные (80) — пленка полиэтиленовая (для стационаров)
40 мл — флаконы-капельницы стеклянные (80) — коробки картонные (для стационаров).
40 мл — флаконы-капельницы стеклянные (80) — пленка полиэтиленовая (для стационаров).
40 мл — флаконы полиэтиленовые (80) — коробки картонные (для стационаров).
40 мл — флаконы полиэтиленовые (80) — пленка полиэтиленовая (для стационаров).
100 мл — флаконы стеклянные (50) — коробки картонные (для стационаров).
100 мл — флаконы стеклянные (50) — пленка полиэтиленовая (для стационаров).
100 мл — флаконы-капельницы стеклянные (50) — пачки картонные (для стационаров).
100 мл — флаконы-капельницы стеклянные (50) — пленка полиэтиленовая (для стационаров).
100 мл — флаконы полиэтиленовые (50) — коробки картонные (для стационаров).
100 мл — флаконы полиэтиленовые (50) — пленка полиэтиленовая (для стационаров).
500 мл — флаконы полиэтиленовые (12) — коробки картонные (для стационаров).
500 мл — флаконы полиэтиленовые (12) — пленка полиэтиленовая (для стационаров).
1000 мл — флаконы полиэтиленовые (8) — коробки картонные (для стационаров).
1000 мл — флаконы полиэтиленовые (8) — пленка полиэтиленовая (для стационаров).
Страница не найдена — Портал Продуктов Группы РСС
Сообщите нам свой адрес электронной почты, чтобы подписаться на рассылку новостного бюллетеня. Предоставление адреса электронной почты является добровольным, но, если Вы этого не сделаете, мы не сможем отправить Вам информационный бюллетень. Администратором Ваших персональных данных является Акционерное Общество PCC Rokita, находящееся в Бжег-Дольном (ул. Сенкевича 4, 56-120 Бжег-Дольный, Польша ). Вы можете связаться с нашим инспектором по защите личных данных по электронной почте: .
Сенкевича 4, 56-120 Бжег-Дольный, Польша ). Вы можете связаться с нашим инспектором по защите личных данных по электронной почте: .
Мы обрабатываем Ваши данные для того, чтобы отправить Вам информационный бюллетень — основанием для обработки является реализация нашей законодательно обоснованной заинтересованности или законодательно обоснованная заинтересованность третьей стороны – непосредственный маркетинг наших продуктов / продуктов группы PCC .
Как правило, Ваши данные мы будем обрабатывать до окончания нашего с Вами общения или же до момента, пока Вы не выразите свои возражения, либо если правовые нормы будут обязывать нас продолжать обработку этих данных, либо мы будем сохранять их дольше в случае потенциальных претензий, до истечения срока их хранения, регулируемого законом, в частности Гражданским кодексом.
В любое время Вы имеете право:
- выразить возражение против обработки Ваших данных;
- иметь доступ к Вашим данным и востребовать их копии;
- запросить исправление, ограничение обработки или удаление Ваших данных;
- передать Ваши персональные данные, например другому администратору, за исключением тех случаев, если их обработка регулируется законом и находится в интересах администратора;
- подать жалобу Президенту Управления по защите личных данных.

Получателями Ваших данных могут быть компании, которые поддерживают нас в общении с Вами и помогают нам в ведении веб-сайта, внешние консалтинговые компании (такие как юридические, маркетинговые и бухгалтерские) или внешние специалисты в области IT, включая компанию Группы PCC .
Больше о том, как мы обрабатываем Ваши данные Вы можете узнать из нашего Полиса конфиденциальности.
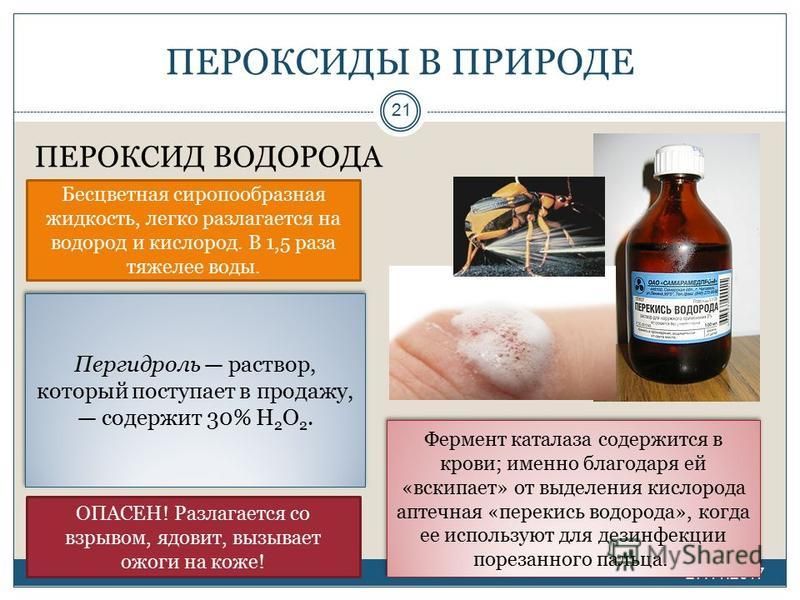
Перекись водорода
В связи с пандемией коронавируса по всему миру, все больше людей запасается дезинфицирующими средствами.
Однако в условиях их дефицита, люди ищут альтернативу традиционным чистящим средствам.
Одним из таких средств является перекись водорода, которая на протяжении многих поколений остается средством
первой помощи при ранах и порезах.
Дезинфекция с помощью перекиси водорода
По данным Центра по контролю и профилактике заболеваний перекись водорода убивает грибки, бактерии, вирусы и споры
плесени.
Оно является стабильным и эффективным антисептическим средством против вирусов при применении на твердых, непористых
поверхностях.
Перекись водорода (h3O2) — это мощное дезинфицирующее средство, которое убивает бактерии, такие как
стафилококки, и вирусы, включая h2N1, SARS и коронавирусы.
Это связано с тем, что перекись водорода в полностью концентрированной форме является слишком сильным средством для
домашнего применения и фактически используется в качестве ракетного топлива и отбеливающего и коррозионного агента
на производстве.
Перекись водорода (h3O2) является высоко реактивным веществом и действует на микробы путем окисления. Этот процесс
происходит, когда реактивные атомы кислорода взаимодействуют с электронами других клеток, что приводит к разрушению
стенок клеток, образующих бактерии.
Чтобы получить раствор 6% нужно, разбавить перекись с водой в пропорции 1/6. Чтобы получить 500 мл шестипроцентного
Чтобы получить 500 мл шестипроцентного
раствора нужно, обязательно надеть перчатки, взять тару 500мл, воронку. Берем 75мл 37% перекиси наливаем в тару и
добавляем воды 387 мл чтоб общий объём получился 462мл. (75мл перекиси умножаем на 5.17=387.75 мл воды)следовательно
387.75+75= 462,75мл шести процентного раствора. Далее переливаем его в пульверизатор и можем начинать проводить
дезинфекцию
Применение перекиси водорода для дезинфекции
Когда дело касается универсальных нетоксичных чистящих средств, мало что может сравниться с 3% раствором перекиси
водорода. Ее можно использовать для дезинфекции различных поверхностей.
Кухонная раковина
Намочите поверхность раковины. Затем очистите раковину пищевой содой с помощью губки. После того, как вы
протерли всю поверхность, нанесите на нее 3% раствор перекиси водорода и оставьте на 5 минут, а потом промойте
поверхность.
Столешница и разделочные доски
По мнению специалистов протирание столешницы или разделочных досок 3% раствором перекиси водорода помогает
убить кишечную палочку и сальмонеллу на твердой поверхности, если оставить ее на 10 минут при комнатной
температуре.
Мусорное ведро
Промыв мусорное ведро мылом с водой, распылите в контейнере раствор из перекиси водорода и воды в соотношении
1:1. Оставьте ведро высыхать на Солнце в течение нескольких часов. Перекись водорода помогает не только очистить
поверхность, но и убивает микробы в мусорном ведре.
Холодильник и посудомоечная машинка
Благодаря тому, что перекись водорода является нетоксичным средством, ее можно использовать для очистки мест,
где хранятся продукты и посуда. Распылите ее с внешней и внутренней стороны холодильника и посудомоечной машины,
оставьте раствор на несколько минут и затем протрите чистой тряпочкой.
Губки для мытья посуды
Замочите губки для мытья посуды на 10 минут в смеси из раствора перекиси водорода и воды в соотношении 1:1 в
пустой миске. Затем тщательно промойте губки.
Туалет
Перекись водорода эффективна в борьбе с микроорганизмами, включая бактерии, грибки, вирусы и плесень, благодаря
чему она может стать прекрасным средством для очищения туалета. Для очищения туалета добавьте 1/2 чашки 3%
раствора перекиси водорода в чашу унитаза, чтобы убить микробы и придать блеск поверхности унитаза.
Оставьте раствор на 20 минут для большей эффективности.
Зеркала и стеклянные поверхности
Распылите раствор из перекиси водорода и воды в соотношении 1:1 на стеклянную поверхность, а затем протрите ее
бумажными полотенцами, тряпочкой без ворса или газетой, чтобы избежать разводов.
Душевая кабинка
Плесень легко образуется во влажной среде душевой кабинки.
Чтобы ее убить, не вдыхая токсичные пары отбеливателя, распылите неразбавленный 3% раствор перекиси водорода и
оставьте на 30 минут. Ополосните поверхность.
Ручки дверей
Протрите или распылите 3% раствор перекиси водорода на ручки дверей и оставьте на 5 минут. Затем вытрите
поверхность.
Полы
Для очищения и дезинфекции полов, вам нужно сделать следующее:
Смешайте в равных частях воду и перекись водорода в ведре.
Протрите полы как обычно и дайте им высохнуть.
Стоит помнить об отбеливающих свойствах перекиси водорода, поэтому лучше предварительно проверить ее действие на
цветных и деревянных полах, прежде чем применять.
Дезинфицирующее замачивание
Кроме протирания твердых поверхностей, вы можете сделать средство для замачивания.
Просто наполните емкость перекисью водорода и используйте для замачивания дестких игрушек, зубных щеток, ретейнеров
для зубов на 10-20 минут.
Дайте им высохнуть и используйте как обычно
Хранение перекиси водорода
Для того, чтобы перекись водорода служила вам эффективным дезинфектантом, важно правильно ее хранить.
Перекись водорода разрушается под воздействием света, поэтому ее продают в темных пластиковых бутылках.
Храните бутылочку с перекисью водорода в прохладном, сухом месте, чтобы она оставалась стабильной в течение
длительного времени.
Меры предосторожности
Перекись водорода обладает множеством полезных чистящих и дезинфицирующих свойств сама по себе. Однако нужно быть
осторожным при смешивании ее с другими веществами.
Так, например, нельзя смешивать в одной емкости перекись водорода с отбеливателем, а также перекись водорода с белым
уксусом из-за того, что такие смеси могут вызвать нежелательные последствия.
Однако вы можете сначала протереть поверхность перекисью водорода, а затем уксусом (не смешивая!), в качестве
мощного средства для борьбы с бактериями и вирусами на твердых поверхностях.
Вернуться в каталог
Заказ продукции
Водорода пероксид по ОСТ 301-02-205-99, каталог ПАО Химпром
Синонимы: водорода пероксид, перекись водорода, гидропероксид, водорода диоксид, пергидроль.
Перекись водорода выпускается двух марок: Б-6 и В-6.
Эмпирическая формула: H2O2
Технические характеристики водорода пероксида:
Примечания: Допускается снижение массовой доли пероксида водорода на 2,5 % в течение гарантийного срока хранения.
Условия хранения: пероксид водорода хранят в складских помещениях, обеспечивающих защиту от воздействия прямых солнечных лучей, при температуре не выше 30 °С. При повышении температуры хранения продукта выше 30 °С, вследствие увеличения скорости разложения, допускается снижение содержания основного вещества в течение гарантийного срока хранения выше предусмотренного.
Разрешается хранить пероксид водорода на открытых площадках в стальной и алюминиевой таре вместимостью более 1 м3. При этом при температуре ниже минус 35 °С возможно замерзание раствора пероксида водорода марки Б. и должны быть предусмотрены разовые мероприятия по размораживанию продукта. Потребительские свойства пероксида водорода при размораживании сохраняются.
Гарантийный срок хранения: 6 месяцев со дня изготовления.
Сведения о сертификации: пероксид водорода (марка Б-6, марка В-6) имеет сертификат в системе ГОСТ Р (добровольная сертификация).
Упаковка: п/эт 30 канистры вместимостью 30 литров, п/эт емкости вместимостью до 1,6 м³ и контейнеры из коррозионно-стойкой стали вместимостью до 25 м³ и контейнеры из алюминия вместимостью 1,6м³.
Транспортирование: железнодорожным и автомобильным транспортом.
Номер чертежа знака опасности по ГОСТ 19433: 5, 8.
Классификационный шифр группы опасных грузов: по ГОСТ 19433 – 5152, при перевозке по железной дороге – 5162
Новости — Официальный сайт администрации Волгограда
12.08.2021
Перекись водорода – «друг» или «враг»
С наступлением жаркого времени года люди все чаще пользуются бассейнами, особенно в тех местах, где доступ к открытым водным объектам ограничен. Но использование бассейнов предполагает постоянный уход, в том числе дезинфекция воды.
Дезинфекция воды бассейна концентрированной (от 30 до 60%) перекисью водорода (пергидролью) приобретает все большую популярность. Особенно популярен этот метод среди владельцев бассейнов небольшого размера. Вместе с популярностью растет и количество несчастных случаев, связанных с опасными свойствами пергидроли.
Перекись водорода, как и любое другое химическое вещество, требует аккуратного и внимательного обращения. Работающий с перекисью водорода должен знать о возможных опасностях, а также знать правила по технике безопасности.
Работающий с перекисью водорода должен знать о возможных опасностях, а также знать правила по технике безопасности.
При работе с концентрированной перекисью водорода, следует обращать повышенное внимание на меры безопасности.
Перекись водорода сама по себе негорючая, но может поддерживать горение. При взаимодействии перекиси водорода с бумагой, тканью, деревом или подобными им материалами может произойти самовозгорание. Нагрев замкнутого сосуда может вызвать его взрыв.
Так, 15 июля текущего года в результате нарушения правил транспортировки и хранения емкости с 59,5% перекисью водорода огнем повреждены три автомашины, две из которых уничтожены полностью. Очаг пожара располагался в багажном отсеке одной из уничтоженной огнем автомашины.
Проверкой установлено, что приобретенная 20-литровая пластиковая емкость с сильно концентрированной перекисью водорода около часа находилась в закрытом багажном отсеке автомашины при температуре воздуха более +30°С, что привело к ее разгерметизации и при взаимодействии с другими материалами к химической реакции с последующим возникновением пожара.
Для обеспечения безопасности необходимо соблюдать регламентированные требования к её хранению и транспортировке. Пожаро- и взрывоопасность вещества обуславливают строгие требования к таре. Основные требования к ёмкостям для перекиси:
1. Защита от механических повреждений, отсутствие риска появления трещин и поломок, пожаробезопасность. Даже небольшая трещина в ёмкости, наполненной, например 50% перекисью, может привести к возгоранию. Чем выше концентрация, тем сильнее последствия непосредственного контакта со смесью, например химические ожоги на открытых участках тела и поражение слизистых оболочек дыхательных путей.
2. Герметичная конструкция. Перекись крайне чувствительна к загрязнениям, а потому при перевозке и хранении необходимо обеспечить её полную герметичность. Попадание примесей в ёмкость исключено, поскольку пыль, ржавчина, соли и другие вещества приводят к резкому повышению скорости разложения перекиси и её разогреву.
3. Предохранительные клапаны. При хранении перекиси в герметически закрытой ёмкости происходит повышение давление, которое может достичь опасного значения. Чтобы избежать этого конструкция должна быть оснащена предохранительными клапанами, которые будут срабатывать при возрастании давления выше допустимого значения внутри ёмкости и обеспечивать отток выделяемого газа.
Чтобы избежать этого конструкция должна быть оснащена предохранительными клапанами, которые будут срабатывать при возрастании давления выше допустимого значения внутри ёмкости и обеспечивать отток выделяемого газа.
4. Защищённость от солнечных лучей за счёт непрозрачного тёмного корпуса. Перекись разлагается под воздействием ультрафиолета.
5. Температурный режим не выше + 30°С. Нарушение рекомендуемых значений может привести к аварийным ситуациям.
6. Термопластиковый корпус. Нержавеющие стали или стекло хотя и устойчивы к перекиси, но приводят к её разложению и активно с ней взаимодействуют. Особенно при длительном контакте. Поэтому для концентрированных смесей рекомендуются ёмкости из поливинилхлорида, полиэтилена, тефлона, полистирола.
ПОМНИТЕ! При возникновении пожара надо немедленно вызвать пожарную охрану по телефону «01», сообщить адрес места пожара, что горит, свою фамилию и постараться потушить огонь с помощью подручных средств (воды, песка, плотной шерстяной ткани).
Телефон доверия ГУ МЧС России по Волгоградской области 78-99-99
Телефон доверия ЮРЦ МЧС России (8 8632) 40-66-10
Главный государственный инспектор
города Волгограда по пожарному надзору И.Л. Чеботарев
Перекись водорода
Состав:
действующее вещество: водорода пероксид;
100 мл раствора содержат водорода пероксида (30%) 10 г
вспомогательные вещества: натрия бензоат (Е 211), вода очищенная.
Врачебная форма. Раствор для наружного применения.
Основные физико-химические свойства: прозрачная бесцветная жидкость.
Фармакологическая группа. Антисептические и дезинфицирующие средства. Код АТХ D08А Х01.
Фармакологические свойства. Фармакологические. При контакте раствора перекиси водорода с поврежденной кожей и слизистыми оболочками высвобождается активный кислород, который способствует очищению раневой поверхности и инактивации органических веществ (протеин, кровь, гной). При применении препарата происходит лишь временное уменьшение количества микроорганизмов. Препарат обладает кровоостанавливающим эффектом.
При применении препарата происходит лишь временное уменьшение количества микроорганизмов. Препарат обладает кровоостанавливающим эффектом.
Фармакокинетика. Не изучалась.
Клинические характеристики.
Показания. Лекарственное средство применяют для остановки капиллярного кровотечения при поверхностном повреждении тканей, носовых кровотечениях, для обработки слизистой оболочки при стоматитах, пародонтитах, ангинах, гинекологических заболеваниях, а также при гнойных ранах.
Противопоказания. Повышенная чувствительность к препарату.
Взаимодействие с другими лекарственными средствами и другие виды взаимодействий. Взаимодействие пока неизвестно.
Особенности применения. Применение раствора на повязку обеспечивает безболезненное снятие ее с раны. Большое количество пены, образующейся способствует механическому очищению раны от гноя и тканевого детрита. Препарат следует с осторожностью применять для обработки глубоких ран и орошения полостей, учитывая возможность эмболии.
Препарат следует с осторожностью применять для обработки глубоких ран и орошения полостей, учитывая возможность эмболии.
Препарат нестабильный в щелочной среде, в присутствии металлов, сложных радикалов некоторых оксидантов, а также в освещенном и теплом месте. Следует избегать попадания раствора в глаза.
Не следует нарушать правила применения лекарственного средства — это может навредить здоровью.
Применение в период беременности или кормления грудью. Применяют.
Способность влиять на скорость реакции при управлении автотранспортом или другими механизмами. Не влияет.
Способ применения и дозы. Раствор перекиси водорода наносят на поврежденный участок кожи для дезинфекции ран per se (т.е. без разведения). Для полоскания растворяют 1 столовую ложку в 1 стакане воды; для аппликаций, обработки раневых поверхностей, остановки кровотечения (капиллярной) пораженные участки обрабатывают тампоном, пропитанным раствором перекиси водорода. Продолжительность лечения зависит от достигнутого эффекта.
Продолжительность лечения зависит от достигнутого эффекта.
Дети. Применяют.
Передозировки. Не наблюдались.
Побочные реакции. Возможно ощущение жжения в момент обработки раны. В некоторых случаях при индивидуальной чувствительности к компонентам препарата возможно возникновение местных аллергических реакций. При длительном применении для обработки слизистой оболочки рта возможна гипертрофия сосочков языка.
В случае появления любых нежелательных явлений необходимо обратиться к врачу.
Срок годности. 2 года. Препарат нельзя применять после окончания срока годности, указанного на упаковке.
Условия хранения. Хранить в оригинальной упаковке при температуре не выше 25 °С.
Хранить в недоступном для детей месте.
Упаковка. По 40 мл во флаконе без пачки или в пачке, или 100 мл во флаконе без пачки.
Категория отпуска. Без рецепта.
Без рецепта.
Производитель / заявитель. ООО «Тернофарм».
Местонахождение производителя и адрес места осуществления его деятельности / местонахождение заявителя. ООО «Тернофарм», Украина, 46010, г.. Тернополь, ул. Фабричная, 4
Дата последнего пересмотра. 30.01.19
Как использовать перекись водорода в домашнем хозяйстве?
Перекись водорода, известная как антисептик для обработки порезов и ссадин, промывания ран, на самом деле может использоваться и в других, не связанных с медициной, целях. Бесцветная жидкость, обладающая мощными окислительными свойствами, незаменима в ведении домашнего хозяйства — в уборке, чистке, дезинфекции. Что немаловажно, она значительно дешевле, чем средства бытовой химии. Есть лишь одно но: перекись водорода может повредить металлические поверхности.
Дезинфицируем:
Столешницы. Перекисью водорода можно обрабатывать столешницы на кухне, кафель в ванной и другие поверхности в доме, чтобы предотвратить распространение инфекций. Пищевые контейнеры. Со временем в пищевых контейнерах могут накапливаться остатки еды. Периодически проводите дезинфекцию. Распылите внутри емкости 3 %-ю перекись водорода, оставьте на несколько минут, затем сполосните и протрите.Сумку-холодильник. Она тоже склонна накапливать остатки пищи. Время от времени проводите ту же процедуру, что и с пищевыми контейнерами.Холодильник. Чтобы избавиться от неприятных запахов в холодильнике и дезинфицировать его, протрите полки перекисью водорода. Это поможет удалить микробы и пятна от еды. С остатками поможет справиться пищевая сода.Тряпки и губки. Они накапливают огромное количество микробов при использовании. Намочите губки и тряпки в перекиси водорода или распылите ее, положив их в раковину.Полиэтиленовые пакеты. Если вы в экологических целях много раз используете пакеты, вам нужно позаботиться и о своем здоровье тоже. Периодически выворачивайте пакеты наизнанку и опрыскивайте их раствором перекиси.
Пищевые контейнеры. Со временем в пищевых контейнерах могут накапливаться остатки еды. Периодически проводите дезинфекцию. Распылите внутри емкости 3 %-ю перекись водорода, оставьте на несколько минут, затем сполосните и протрите.Сумку-холодильник. Она тоже склонна накапливать остатки пищи. Время от времени проводите ту же процедуру, что и с пищевыми контейнерами.Холодильник. Чтобы избавиться от неприятных запахов в холодильнике и дезинфицировать его, протрите полки перекисью водорода. Это поможет удалить микробы и пятна от еды. С остатками поможет справиться пищевая сода.Тряпки и губки. Они накапливают огромное количество микробов при использовании. Намочите губки и тряпки в перекиси водорода или распылите ее, положив их в раковину.Полиэтиленовые пакеты. Если вы в экологических целях много раз используете пакеты, вам нужно позаботиться и о своем здоровье тоже. Периодически выворачивайте пакеты наизнанку и опрыскивайте их раствором перекиси. Это дезинфицирует пакет и избавит от запахов продуктов.Увлажнитель воздуха. В увлажнителях часто накапливается плесень, поэтому важно дезинфицировать их. Время от времени ненадолго включайте увлажнитель с раствором воды и перекиси водорода, чтобы убить плесень изнутри.
Это дезинфицирует пакет и избавит от запахов продуктов.Увлажнитель воздуха. В увлажнителях часто накапливается плесень, поэтому важно дезинфицировать их. Время от времени ненадолго включайте увлажнитель с раствором воды и перекиси водорода, чтобы убить плесень изнутри.
Чистим:Разделочную доску. Промойте доску после использования и распылите на нее 3 %-ю перекись водорода. Оставьте на 5 — 10 минут, сполосните и высушите. Так вы предотвратите попадание бактерий на другие продукты или инструменты.Посуду. Смешайте соду с перекисью водорода и нанесите эту пасту на места с нагаром. Оставьте на несколько минут, затем потрите губкой или щеткой и смойте теплой водой. Пищевая сода будет служить абразивным средством, а перекись помогает разбить частицы нагара.Унитаз. Обработайте внутреннюю поверхность перекисью водорода и оставьте на 20 минут. Затем почистите ершиком, как обычно, и смойте. Опустите ершик в перекись водорода, чтобы очистить и его. Керамическую плитку. Плитка очень быстро загрязняется, накапливая пятна и мыльную пену. Перекись водорода помогает убить плесень и освежить плитку. Смешайте перекись с мукой до образования пасты, смажьте ею плитку и накройте пленкой. Оставьте на ночь, а с утра промойте. Плитка вновь засверкает, как новая.Раковину. Перекись водорода используют для удаления известкового налета. Предварительно высушите поверхность. Распылите на нее перекись, оставьте на несколько часов (для большего эффекта можно еще несколько раз нанести средство), а затем потрите щеткой с мылом и смойте водой.Зеркало. Перекись водорода практически не оставляет разводов на зеркале. Распылите ее и вытрите бумажными полотенцами.Занавеску для душа. На ней зачастую скапливается мыльная пена, образуется плесень. Если занавеску можно постирать в стиральной машинке, сделайте это, добавив перекись водорода. Если же нет, почистите ее вручную.Игрушки. Маленькие дети часто берут игрушки в рот.
Керамическую плитку. Плитка очень быстро загрязняется, накапливая пятна и мыльную пену. Перекись водорода помогает убить плесень и освежить плитку. Смешайте перекись с мукой до образования пасты, смажьте ею плитку и накройте пленкой. Оставьте на ночь, а с утра промойте. Плитка вновь засверкает, как новая.Раковину. Перекись водорода используют для удаления известкового налета. Предварительно высушите поверхность. Распылите на нее перекись, оставьте на несколько часов (для большего эффекта можно еще несколько раз нанести средство), а затем потрите щеткой с мылом и смойте водой.Зеркало. Перекись водорода практически не оставляет разводов на зеркале. Распылите ее и вытрите бумажными полотенцами.Занавеску для душа. На ней зачастую скапливается мыльная пена, образуется плесень. Если занавеску можно постирать в стиральной машинке, сделайте это, добавив перекись водорода. Если же нет, почистите ее вручную.Игрушки. Маленькие дети часто берут игрушки в рот. Периодически протирайте перекисью водорода игрушки, коробки для игрушек и игровые зоны. Перекись безопаснее многих средств бытовой химии.
Периодически протирайте перекисью водорода игрушки, коробки для игрушек и игровые зоны. Перекись безопаснее многих средств бытовой химии.
Удаляем пятна:На одежде. От некоторых пятен очень сложно избавиться, особенно от пятен крови или пота. Перекись водорода прекрасно с этим справляется. Смешайте две части перекиси водорода с одной частью моющего средства и нанесите прямо на пятна. Однако помните, что лучше всего использовать этот метод на светлых и белых вещах, так как перекись имеет отбеливающий эффект.На коврах. Если на ковре появились трудновыводимые пятна от еды и грязи, распылите на них перекись водорода. Опять же такой метод подойдет только для светлых ковров. Можете протестировать этот способ на невидном месте (например, там, где ковер спрятан за мебель).На скатертях. Если у вас есть белые скатерти или занавески, которые пожелтели или покрылись пятнами, намочите пожелтевшие области перекисью водорода. После этого постирайте с остальным белым бельем.
После этого постирайте с остальным белым бельем.
Инна Анохина, газета «Голос Череповца»
Перекись водорода — структура, применение и свойства перекиси водорода
Перекись водорода — очень нестабильное химическое соединение. Две молекулы водорода соединяются с двумя молекулами кислорода с образованием перекиси водорода. Следовательно, его химическая формула H 2 O 2 . Перекись водорода — это бледно-голубая прозрачная жидкость, немного более вязкая, чем вода в чистом виде. Это простейший пероксид (поскольку это соединение с одинарной связью кислород-кислород). Перекись водорода обычно используется в качестве окислителя, отбеливающего агента и антисептика.Концентрированная перекись водорода, также известная как «перекись с высоким содержанием кислорода», представляет собой реактивную форму кислорода и использовалась в качестве топлива в ракетных двигателях. Поскольку это соединение нестабильно, оно медленно разлагается в присутствии света. Пероксид водорода обычно хранится со стабилизатором в слабокислом растворе, поскольку он нестабилен. Его можно найти в биологических системах, в том числе в организме человека. Пероксидазы — это ферменты, которые используют или разлагают перекись водорода.
Его можно найти в биологических системах, в том числе в организме человека. Пероксидазы — это ферменты, которые используют или разлагают перекись водорода.
ИСТОРИЯ ОТКРЫТИЙ
В 1799 году Александр фон Гумбольдт синтезировал пероксид бария, один из первых синтетических пероксидов, в качестве побочного продукта своих попыток разложить воздух.Спустя девятнадцать лет Луи Жак Тенар заявил, что это соединение можно использовать для приготовления ранее неизвестного соединения. Он описал это как eauoxygénée (по-французски: насыщенная кислородом вода), который стал известен как перекись водорода. В усовершенствованной версии метода Тенара использовалась соляная кислота с последующим добавлением серной кислоты для осаждения побочного продукта сульфата бария. Этому методу следовали с конца 19 века до середины 20 века. В 1811 году Тенар и Жозеф Луи Гей-Люссак синтезировали перекись натрия.Первоначально считалось, что чистая перекись водорода нестабильна, поскольку ранние эксперименты по ее отделению от воды, присутствующей во время синтеза, не увенчались успехом. Эта нестабильность присутствовала из-за следов примесей (солей переходных металлов). Эти примеси катализируют разложение перекиси водорода. Ричард Вольфенштейн впервые получил чистую перекись водорода в 1894 году. Он получил ее с помощью вакуумной перегонки.
Эта нестабильность присутствовала из-за следов примесей (солей переходных металлов). Эти примеси катализируют разложение перекиси водорода. Ричард Вольфенштейн впервые получил чистую перекись водорода в 1894 году. Он получил ее с помощью вакуумной перегонки.
СТРОЕНИЕ ПЕРОКСИДА ВОДОРОДА
Структура перекиси водорода неплоская, что означает ее трехмерность.Структура этого соединения также широко известна как структура открытой книги. Следующая диаграмма поясняет это утверждение.
Схема показывает, что в структуре две плоскости, и каждая плоскость имеет одну пару ОН, угол между обеими плоскостями составляет 90,2 °, длина связи OO составляет 145,8 пм, а длина связи ОН составляет 98,8 пм (что равно 9,88 × 10-13 м). Две пары несвязанных электронов будут присутствовать в обоих атомах кислорода. Это доказывает теорию отталкивания электронов валентных оболочек.Атомы водорода всегда будут отталкивать несвязанные электроны кислорода. Таким образом, образуется изогнутая молекулярная форма.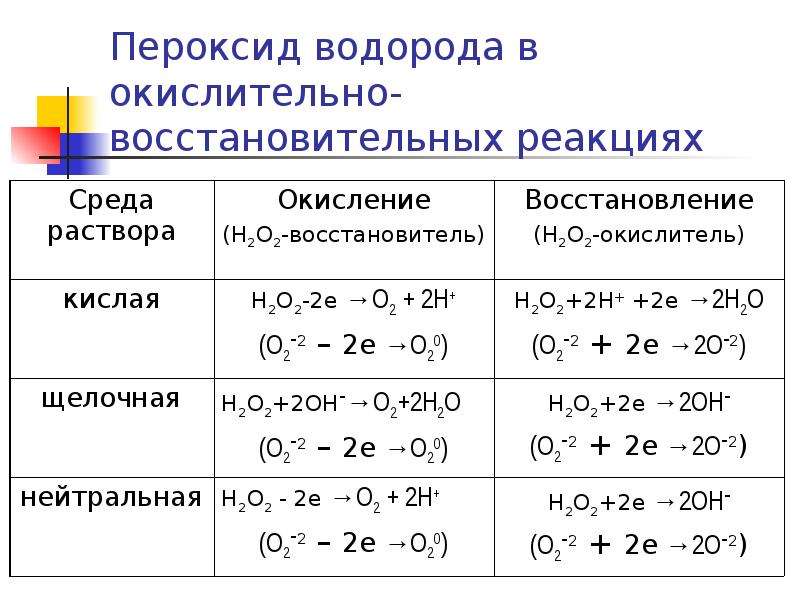
Для получения перекиси водорода используются различные методы:
СВОЙСТВА ПЕРОКСИДА ВОДОРОДА
Свойства пероксида водорода следующие:
•
Перекись водорода в чистом виде почти бесцветна (очень бледно-голубая).
Химические свойства перекиси водорода следующие:
Перекись водорода действует как окислитель, так и как восстановитель в кислой и основной среде. Следующие реакции изображают картину:
ХРАНЕНИЕ ПЕРОКСИДА ВОДОРОДА
При воздействии солнечного света перекись водорода разлагается. Этот процесс разложения катализируется следами щелочных металлов. Поэтому перекись водорода можно хранить в застекленных воском стеклянных или пластиковых емкостях в темноте. Его также необходимо хранить вдали от частиц пыли, поскольку пыль может вызвать взрывное разложение этого соединения.
Этот процесс разложения катализируется следами щелочных металлов. Поэтому перекись водорода можно хранить в застекленных воском стеклянных или пластиковых емкостях в темноте. Его также необходимо хранить вдали от частиц пыли, поскольку пыль может вызвать взрывное разложение этого соединения.
ИСПОЛЬЗОВАНИЕ ПЕРОКСИДА ВОДОРОДА
Пероксид водорода имеет ряд применений. Некоторые из них перечислены ниже:
 Перкарбонат натрия является активным ингредиентом таких продуктов, как стиральный порошок OxiClean и Tide.При растворении в воде выделяет перекись водорода и карбонат натрия.
Перкарбонат натрия является активным ингредиентом таких продуктов, как стиральный порошок OxiClean и Tide.При растворении в воде выделяет перекись водорода и карбонат натрия.

Следовательно, перекись водорода является одним из наиболее важных соединений.
Произошла ошибка при установке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie.
 Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie. - Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались.
Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файлы cookie. - Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г.,
браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере. - Вы установили приложение, которое отслеживает или блокирует установку файлов cookie.
Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу.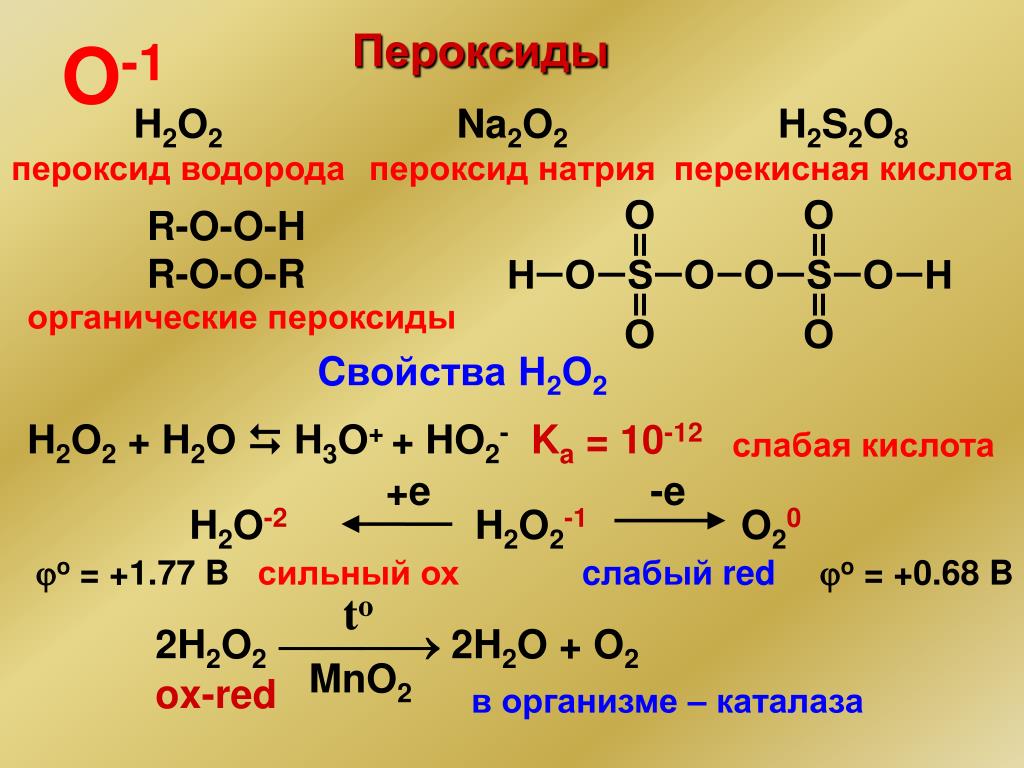 Чтобы предоставить доступ без файлов cookie
Чтобы предоставить доступ без файлов cookie
потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файле cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт
не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к
остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
Свойства пероксида кальция для выделения пероксида водорода и кислорода: исследование кинетики
https://doi.org/10.1016/j.cej.2016.05.123Получить права и содержание
Основные моменты
- •
CaO 2 может реагировать с водой с образованием O 2 непосредственно без промежуточного соединения H 2 O 2 .

- •
Кинетический паттерн высвобождения для H 2 O 2 был псевдонулевым порядком.
- •
Кинетический паттерн высвобождения для O 2 был псевдопервым порядком.
- •
Повышение температуры и снижение pH ускоряют скорость высвобождения как O 2 , так и H 2 O 2 .
- •
Повышение температуры и pH снижает выход H 2 O 2 и увеличивает выход O 2 .
Реферат
Пероксид кальция (CaO 2 ), как один из твердых пероксидов, все чаще используется при реабилитации загрязненных участков из-за его способности выделять кислород (O 2 ) и пероксид водорода (H ). 2 О 2 ).Биоразложение может быть усилено наличием O 2 . Перекись водорода может быть использована для химического окисления in situ посредством модифицированного Фентона. Предыдущие исследования показывают противоречивые результаты о высвобождении O 2 и H 2 O 2 при разложении CaO 2 . Кроме того, характеристики выпуска O 2 и H 2 O 2 подробно не оцениваются.
Предыдущие исследования показывают противоречивые результаты о высвобождении O 2 и H 2 O 2 при разложении CaO 2 . Кроме того, характеристики выпуска O 2 и H 2 O 2 подробно не оцениваются.
Была проведена серия серийных экспериментов для исследования свойств разложения CaO 2 и кинетики высвобождения O 2 и H 2 O 2 .O 2 и H 2 O 2 выделялись непосредственно при растворении CaO 2 , а H 2 O 2 не был важным промежуточным звеном в преобразовании CaO 2 в O 2 . Два пути высвобождения образуют параллельную реакционную систему с конкурентными отношениями между двумя путями. Высвобождение H 2 O 2 и O 2 следовало кинетике псевдонулевого порядка и кинетике псевдопервого порядка, соответственно.Повышение температуры и снижение pH могут ускорить скорость высвобождения как O 2 , так и H 2 O 2 . Однако повышение температуры могло снизить выход H 2 O 2 и увеличить выход O 2 , что было аналогично влиянию увеличения pH.
Однако повышение температуры могло снизить выход H 2 O 2 и увеличить выход O 2 , что было аналогично влиянию увеличения pH.
Ключевые слова
Пероксид кальция
Пероксид водорода и кислород
Пути выброса
Кинетика высвобождения
Конечное производство
Рекомендуемые статьи Цитирующие статьи (0)
Полный текст
© 2016 Elsevier B.V. Все права защищены.
Рекомендуемые статьи
Цитирование статей
Произошла ошибка при настройке вашего пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie.
 Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie. - Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались.
Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файлы cookie. - Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г.,
браузер автоматически забудет файл cookie.Чтобы исправить это, установите правильное время и дату на своем компьютере. - Вы установили приложение, которое отслеживает или блокирует установку файлов cookie.
Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie
Чтобы предоставить доступ без файлов cookie
потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файле cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт
не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к
остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
VII. КАЛОРИМЕТРИЧЕСКИЕ СВОЙСТВА СИСТЕМ h3O — h3O2 И D2O — D2O2
Если у вас установлено соответствующее программное обеспечение, вы можете загрузить данные цитирования статей в выбранный вами менеджер цитирования. Просто выберите программное обеспечение менеджера из списка ниже и нажмите «Загрузить».
Просто выберите программное обеспечение менеджера из списка ниже и нажмите «Загрузить».
Цитируется по
1. Оценка гидратообразования, емкости хранения и транспортных свойств метана и диоксида углерода через функционализированные мембраны из углеродных нанотрубок
2. Кинетика и энергетика разложения пероксида водорода
3. Каталитическое действие платины и серебра в керамическом микродвигателе на основе моновоздушного пероксида водорода
4. Разработка поточной испарительной установки для производства газовых смесей, содержащих водород пероксид — численное моделирование и экспериментальные результаты
5. Простая аддитивная потенциальная модель для моделирования пероксида водорода в химических и биологических системах
6. Биомасса водорослей и дизельные эмульсии: альтернативный подход к использованию энергии биомассы микроводорослей в дизельных двигателях
7. Каталитические свойства участков поверхности кластеров палладия для прямого H
2
О
2
Синтез из H
2
и O
2
: Исследование DFT
8. Оценка безопасности процесса эпоксидирования перекиси водорода, катализируемого вольфрамом, приводящего к неуправляемой лабораторной реакции
Оценка безопасности процесса эпоксидирования перекиси водорода, катализируемого вольфрамом, приводящего к неуправляемой лабораторной реакции
9. Микрожидкостные чипы с автономным питанием для мультиплексных анализов белка из цельной крови
11. Энергия диссоциации OH (X
2
Π
3/2
) и энтальпии образования OH (X
2
Π
3/2
), ClOH и BrOH из термохимических циклов
12. Энергетика внутри- и межмолекулярных связей в? -Алкандиолах
13. Дифференциальная сканирующая калориметрия перекиси водорода и лигноцеллюлозы, обработанной перекисью водорода. I. Условия атмосферного давления ☆
14. Теплоемкость H
2
O + H
2
О
2
, а H
2
O + N
2
ЧАС
4
, бинарные решения: Выделение сингулярной компоненты для
Cp
переохлажденной воды
15. Термохимия растворов модельных биохимических соединений 6. α, ω-дикарбоновые кислоты, -диамины и -диолы в водном растворе
Термохимия растворов модельных биохимических соединений 6. α, ω-дикарбоновые кислоты, -диамины и -диолы в водном растворе
17. Энтальпия разложения пероксида водорода каталазой при 25 ° C (с молярными коэффициентами экстинкции h3O2 в УФ)
18. Внутреннее вращение и термодинамические свойства пероксида водорода и его дейтерированных частиц
21. ВВЕДЕНИЕ И НЕКОТОРЫЕ ТЕРМОДИНАМИЧЕСКИЕ СООБРАЖЕНИЯ
22. ССЫЛКИ К ЧАСТИ III
24. Диаграмма энтальпии-концентрации для системы пероксид водорода-вода при общем давлении 50 мм рт.
Инъекционные гидрогели могут служить терапевтическими средствами и имплантатами для лечения различных заболеваний, а также для восстановления / регенерации тканей.В частности, система гидрогелирования, катализируемая пероксидазой хрена (HRP) и перекисью водорода (H 2 O 2 ), привлекла большое внимание благодаря простоте обращения и контролируемым свойствам геля. В этом исследовании мы вводим пероксид кальция (CaO 2 ) в качестве реагента, генерирующего H 2 O 2 , чтобы постепенно обеспечить источник радикалов для реакции сшивания, катализируемой HRP.Эта новая терапия может создавать жесткие гидрогели без ущерба для цитосовместимости гидрогелей благодаря использованию изначально высоких концентраций H 2 O 2 . Физико-химические свойства гидрогелей можно контролировать, варьируя концентрации HRP и CaO 2 . Кроме того, контролируемое и продолжительное высвобождение биоактивных молекул, в том числе ионов H 2 O 2 , O 2 и ионов Ca 2+ , из гидрогелей может стимулировать клеточную активность. поведение (прикрепление, миграция и дифференциация) мезенхимальных стволовых клеток человека.
В этом исследовании мы вводим пероксид кальция (CaO 2 ) в качестве реагента, генерирующего H 2 O 2 , чтобы постепенно обеспечить источник радикалов для реакции сшивания, катализируемой HRP.Эта новая терапия может создавать жесткие гидрогели без ущерба для цитосовместимости гидрогелей благодаря использованию изначально высоких концентраций H 2 O 2 . Физико-химические свойства гидрогелей можно контролировать, варьируя концентрации HRP и CaO 2 . Кроме того, контролируемое и продолжительное высвобождение биоактивных молекул, в том числе ионов H 2 O 2 , O 2 и ионов Ca 2+ , из гидрогелей может стимулировать клеточную активность. поведение (прикрепление, миграция и дифференциация) мезенхимальных стволовых клеток человека. Кроме того, гидрогели продемонстрировали эффективность уничтожения как грамотрицательных, так и грамположительных бактерий, в зависимости от количества высвобождаемых H 2 O 2 и Ca 2+ . Эти положительные результаты предполагают, что гидрогели, образованные HRP / CaO 2 , могут использоваться в качестве потенциальных матриц для широкого спектра биомедицинских приложений, таких как регенерация костей и лечение инфекций.
Кроме того, гидрогели продемонстрировали эффективность уничтожения как грамотрицательных, так и грамположительных бактерий, в зависимости от количества высвобождаемых H 2 O 2 и Ca 2+ . Эти положительные результаты предполагают, что гидрогели, образованные HRP / CaO 2 , могут использоваться в качестве потенциальных матриц для широкого спектра биомедицинских приложений, таких как регенерация костей и лечение инфекций.
У вас есть доступ к этой статье
Подождите, пока мы загрузим ваш контент. ..
..
Что-то пошло не так. Попробуй снова?
Перекись водорода: получение, свойства и структура — видео и стенограмма урока
Свойства перекиси водорода
Многие физические свойства перекиси водорода аналогичны воде.Температура плавления перекиси водорода составляет -0,4 градуса по Цельсию, а температура кипения составляет 150 градусов по Цельсию. Таким образом, температура плавления очень похожа на температуру плавления воды (которая составляет 0 градусов Цельсия), но точка кипения намного выше, чем точка кипения воды (которая составляет 100 градусов Цельсия). Хотя стоит заметить, что температура кипения перекиси водорода носит чисто теоретический характер. На самом деле нам никогда не удавалось кипятить перекись водорода, потому что, когда мы нагреваем перекись водорода, она взрывается и разлагается на воду и кислород.
Каждый кислород перекиси водорода связан с другим кислородом и с одним из атомов водорода. Эта структура находится не в плоской молекуле, а имеет витую симметрию. Угол связи между кислородом и водородом составляет 102 градуса.
Перекись водорода — сильный окислитель. Только в присутствии очень сильного окислителя, такого как оксид магния, он может действовать как восстанавливающий агент. Когда перекись водорода действует как окислитель, она отдает один из атомов кислорода, оставляя воду в качестве побочного продукта.
Получение перекиси водорода
Есть много различных способов получения перекиси водорода. Обычно его получают путем окисления гидрохинона. Окисление — это когда образуется больше углерод-кислородных связей. гидрохинон представляет собой ароматическое соединение, производное от бензола, которое действует как источник водорода в перекиси водорода.
Общее уравнение для получения перекиси водорода состоит в том, чтобы просто соединить водород с кислородом, и образуется перекись водорода. Гидрохиноновый метод, также называемый методом электролиза, использует гидрохинон в качестве источника водорода для получения перекиси водорода. Хорошая особенность этого метода заключается в том, что если водороды на металлическом катализаторе находятся в присутствии полученного продукта, антрахинона, их можно переработать и использовать в качестве еще одного гидрохинона для создания большего количества перекиси водорода.
Гидрохиноновый метод, также называемый методом электролиза, использует гидрохинон в качестве источника водорода для получения перекиси водорода. Хорошая особенность этого метода заключается в том, что если водороды на металлическом катализаторе находятся в присутствии полученного продукта, антрахинона, их можно переработать и использовать в качестве еще одного гидрохинона для создания большего количества перекиси водорода.
На этом изображении вы можете видеть, что сначала у нас есть гидрохинон. В присутствии кислорода этот гидрохинон окисляется до антрахинона.Поскольку связь углерод-кислород теперь является двойной, теперь имеется больше углеродно-кислородных связей, что приводит к ее окислению. Водород, который был в кислороде, теперь соединяется с кислородом с образованием перекиси водорода. Затем мы видим, что полученный антрахинон может подвергаться воздействию водорода для преобразования гидрохинона, и реакция возвращается к началу. На изображении его нет, но этот водород находится на металлическом катализаторе.
На изображении его нет, но этот водород находится на металлическом катализаторе.
Краткое содержание урока
Пероксид водорода используется в качестве экологически чистого противомикробного и отбеливающего агента, поскольку его побочными продуктами являются просто кислород и вода.Его структура похожа на воду, и его температура плавления также очень похожа на температуру воды (оба примерно 0 градусов Цельсия). Однако температура кипения намного выше, чем у воды, и составляет 150 градусов по Цельсию. Хотя это отличное дезинфицирующее средство для многих вещей, врачи больше не рекомендуют использовать его для лечения ран, потому что он замедляет процесс заживления.
Это неплоская молекула со скрученной симметрией, которая действует как сильный окислитель. Его готовят с использованием источника водорода и его соединения с кислородом.Наиболее распространенный метод использует окисление , когда образуется больше углерод-кислородных связей, для окисления гидрохинона , ароматического соединения, полученного из бензола, которое действует как источник водорода в перекиси водорода, которая действует как водород.


 Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
 Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.