Содержание
Анализы мочи во время беременности — что смотрят
- Зачем сдавать анализ мочи при беременности
- Как правильно сдавать мочу на анализ
- Что показывает анализ мочи и как проводится оценка
- Специальные анализы мочи
Во время беременности женщина сдает множество различных анализов. Самым частым, и в то же время самым простым исследованием является анализ мочи. Он сдается регулярно, перед каждым визитом к врачу женской консультации, то есть минимум 12 раз за беременность.
Зачем сдавать анализ мочи при беременности
Моча образуется в почках при фильтрации крови, с ней из организма выводятся продукты распада, образующиеся при обмене веществ, соли, витамины, гормоны. По данному анализу можно судить о работе почек и других органов. Основным компонентом мочи является вода (92-99 %). Ежедневно с мочой из организма удаляется примерно 50 – 70 сухих веществ, большую часть которых составляет мочевина и хлористый натрий. Состав мочи значительно изменяется даже у здоровых людей в зависимости от питания, режима питья и приема медикаментов. Во время беременности регулярное исследование общего анализа мочи позволяет вовремя заподозрить начальные патологические процессы в организме будущей мамы, к примеру, развитие инфекции мочевыводящих путей или токсикоза второй половины беременности. Для правильной оценки результатов анализа моча должна быть правильно собрана.
Состав мочи значительно изменяется даже у здоровых людей в зависимости от питания, режима питья и приема медикаментов. Во время беременности регулярное исследование общего анализа мочи позволяет вовремя заподозрить начальные патологические процессы в организме будущей мамы, к примеру, развитие инфекции мочевыводящих путей или токсикоза второй половины беременности. Для правильной оценки результатов анализа моча должна быть правильно собрана.
Как правильно сдавать мочу на анализ
Накануне сдачи анализа рекомендуется воздержаться от интенсивной физической нагрузки, не употреблять много мясных продуктов, соленых, кислых и острых блюд, а также красящих продуктов (свеклы, моркови и др.). Это может привести в искажению результата – появлению в моче белка и солей. Для общего анализа мочи предпочтительнее собрать утреннюю порцию мочи.
Предварительно проводится тщательный туалет наружных половых органов теплой водой с мылом. Влагалище лучше закрыть ватным тампоном, чтобы исключить попадание выделений в пробу мочи. Моча собирается в чистую сухую посуду. Для анализа используется средняя порция мочи, то есть первые несколько секунд нужно мочиться в унитаз, затем в баночку, и остатки снова в унитаз.
Моча собирается в чистую сухую посуду. Для анализа используется средняя порция мочи, то есть первые несколько секунд нужно мочиться в унитаз, затем в баночку, и остатки снова в унитаз.
Доставить мочу в лабораторию необходимо в течение двух часов с момента забора и желательно постараться не подвергать ее сильной тряске при транспортировке. Допускается хранение мочи в холодильнике при температуре +2-+4 градуса, но не более 1,5 часов. Желательно, чтобы количество собранного для исследования материала было не менее 70 мл.
Что показывает анализ мочи и как проводится оценка
При исследовании общего анализа мочи проводится оценка многих параметров.
Цвет
В норме моча имеет желтый цвет различных оттенков. Оттенок зависит от степени насыщения мочи особым пигментом – урохромом. Изменение цвета мочи может быть при приеме некоторых лекарственных препаратов (например, витамины могут давать ярко-желтое окрашивание, аспирин – розовое). Однако значительно чаще изменение цвета мочи говорит о наличии каких-либо патологических процессов в организме. При появлении в моче крови, что встречается при заболеваниях почек и мочевого пузыря, моча приобретает ярко красный цвет (при почечной колике, цистите) или так называемый «цвет мясных помоев» (при остром воспалительном поражении почек). При усиленном разрушении красных кровяных клеток (эритроцитов) моча приобретает красно-бурый оттенок. Желто-бурого (или цвета пива) моча бывает при заболеваниях печени.
При появлении в моче крови, что встречается при заболеваниях почек и мочевого пузыря, моча приобретает ярко красный цвет (при почечной колике, цистите) или так называемый «цвет мясных помоев» (при остром воспалительном поражении почек). При усиленном разрушении красных кровяных клеток (эритроцитов) моча приобретает красно-бурый оттенок. Желто-бурого (или цвета пива) моча бывает при заболеваниях печени.
Прозрачность
В норме прозрачность должна быть полной. Помутнение мочи может быть результатом наличия в моче эритроцитов, лейкоцитов, эпителия, бактерий, жировых капель, выпадения в осадок солей.
Относительная плотность (удельный вес)
Это показатель, характеризующий количество микроэлементов, солей, различных соединений. В норме удельный вес составляет 1003 — 1035 г/л. Этот показатель может уменьшаться при наличии глюкозы или белка в моче, при токсикозе первой половины беременности, обезвоживании. Увеличение удельного веса встречается при хронической почечной недостаточности, несахарном диабете, обильном питье.
Белок
Содержание белка в моче – один из самых важных показателей работы почек. В норме его быть не должно. Небольшое количество белка в моче (физиологическая протеинурия) может быть и у здоровых людей, при этом концентрация белка не превышает 0,033 г/л, в современных лабораториях с более чувствительным оборудованием – 0,14 г/л. Появление белка в моче отмечается при заболеваниях почек, воспалительных заболеваниях мочевого пузыря и мочевыводящих путей. Наличие белка в моче в сочетании с повышением артериального давления и отеками является признаком серьезного осложнения беременности – позднего гестоза, которое может привести к появлению судорог и даже гибели беременной женщины и плода.
Глюкоза
В норме глюкоза в общем анализе мочи отсутствует. Однако во второй половине беременности в норме может выявляться наличие глюкозы в моче (глюкозурия). Это связано с увеличением фильтрации глюкозы в почках. Поскольку появление глюкозы в моче может быть признаком серьезного заболевания – сахарного диабета, острого воспаления поджелудочной железы, всем пациенткам с глюкозурией необходимо дополнительное обследование – контроль глюкозы крови, иногда даже проведение глюкозотолерантного теста с сахарной нагрузкой – определение глюкозы крови натощак и через 2 часа после приема 75 грамм глюкозы.
Билирубин
Это пигмент крови, который образуется в результате обменных процессов в организме и выделяется с желчью в желудочно-кишечный тракт. При повышении в крови концентрации билирубина, он начинает выделяться почками и обнаруживаться в моче. Это происходит в основном при поражении печени или механическом затруднении оттока желчи.
Уробилиноген
Это продукт превращения билирубина. В норме он выделяется с желчью и в мочу практически не попадает. Появление уробилиногена в моче встречается при заболеваниях печени, отравлениях, усиленном распаде красных кровяных клеток – эритроцитов.
Кетоновые тела
Это продукты, образующиеся в процессе распада жирных кислот в организме. В норме в анализе мочи кетоновые тела отсутствуют. Определение их является очень важным в диагностике адекватности терапии сахарного диабета. Появление кетонов может встречаться в первом триместре беременности при раннем токсикозе и свидетельствовать об обезвоживании организма.
Нитриты
Это соли азотистой кислоты, в норме в моче они не встречаются. Их появление говорит о наличии инфекции мочевыводящей системы.
Лейкоциты
Это белые клетки крови. В норме в общем анализе мочи лейкоциты встречаются до 5 в поле зрения. Если количество лейкоцитов повышено, это говорит о наличии воспалительного процесса в почках, мочевом пузыре или мочеиспускательном канале, при этом, чем выше количество лейкоцитов, тем более выражено воспаление. Небольшое повышение количества лейкоцитов может наблюдаться в случае попадания в мочу выделений из влагалища при плохом туалете наружных половых органов.
Эритроциты
Красные клетки крови. В норме в общем анализе мочи должно быть не более 2 эритроцитов в поле зрения. Увеличение их количества встречается при наличии камней в почках или мочевыводящих путях, воспалениях почек, травмах.
Цилиндры
Элементы осадка мочи цилиндрической формы, состоящие из белка или клеток, могут также содержать различные включения.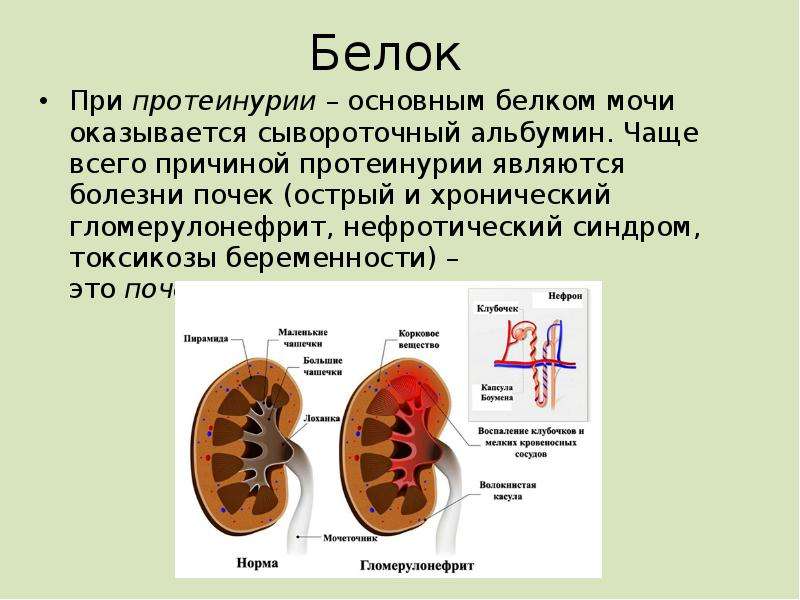 В норме отсутствуют. Встречаются в основном при заболеваниях почек.
В норме отсутствуют. Встречаются в основном при заболеваниях почек.
Соли
Это неорганические вещества, которые при стоянии мочи могут выпадать в осадок. В норме соли в моче отсутствуют. Появление в моче уратов встречается при заболеваниях почек, а также в первом триместре беременности при рвоте беременных.
Аморфные фосфаты
Также встречаются при рвоте беременных, при воспалении мочевого пузыря, а могут встречаться в норме при преобладании в рационе растительной и молочной пищи.
Оксалаты
Встречаются при воспалении почек, сахарном диабете, а также при преобладании в рационе продуктов, богатых щавелевой кислотой (шпинат, щавель, томаты, спаржа).
Бактерии
Выделение бактерий с мочой имеет существенное диагностическое значение при беременности. Появление бактерий в моче свидетельствует о наличии воспалительного процесса в почках, мочевом пузыре или уретре и требует обязательного лечения, даже если будущую маму ничего не беспокоит. Бактерии могут также попадать в мочу из влагалища при плохом туалете наружных половых органов. Для определения количества бактерий, их вида и чувствительности к антибактериальной терапии обязательно проводится дополнительно посев мочи на флору. Для получения правильного результата этого анализа необходимо после тщательного туалета наружных половых органов закрыть влагалище ватным тампоном, собрать среднюю порцию мочи в стерильный контейнер, плотно закрутить крышку и доставить в лабораторию в течение полутора-двух часов. Посев мочи готовится в среднем от 7 до 10 дней и позволяет врачу решить нужно ли проводить антибактериальное лечение, и какими препаратами.
Бактерии могут также попадать в мочу из влагалища при плохом туалете наружных половых органов. Для определения количества бактерий, их вида и чувствительности к антибактериальной терапии обязательно проводится дополнительно посев мочи на флору. Для получения правильного результата этого анализа необходимо после тщательного туалета наружных половых органов закрыть влагалище ватным тампоном, собрать среднюю порцию мочи в стерильный контейнер, плотно закрутить крышку и доставить в лабораторию в течение полутора-двух часов. Посев мочи готовится в среднем от 7 до 10 дней и позволяет врачу решить нужно ли проводить антибактериальное лечение, и какими препаратами.
Специальные анализы мочи
Посев мочи
Проводится обязательно в том случае, если в общем анализе мочи были выявлены бактерии.
Цель исследования. Выполняется для определения количества бактерий, их вида и чувствительности к антибактериальным препаратам.
Записаться на прием
Правила сбора мочи для анализа. Для получения правильного результата этого анализа мочу необходимо собирать после тщательного туалета наружных половых органов, закрыв влагалище ватным тампоном. Собрать необходимо среднюю порцию мочи в стерильный контейнер, плотно закрутить крышку и доставить в лабораторию в течение полутора-двух часов.
Для получения правильного результата этого анализа мочу необходимо собирать после тщательного туалета наружных половых органов, закрыв влагалище ватным тампоном. Собрать необходимо среднюю порцию мочи в стерильный контейнер, плотно закрутить крышку и доставить в лабораторию в течение полутора-двух часов.
Посев мочи готовится в среднем от 7 до 10 дней и позволяет врачу решить нужно ли проводить антибактериальное лечение и какими препаратами. При наличии клинической картины воспаления до получения результатов посева проводится антибактериальное лечение антибиотиком широкого спектра действия (действует на большой круг бактерий), а при бессимптомном течении заболевания или неярко выраженном воспалении лечение не проводят до получения результатов анализа.
Анализ мочи по Нечипоренко
Это специальный анализ мочи, который показывает содержание эритроцитов, лейкоцитов и цилиндров в 1 мл мочи.
Цель исследования. Этот анализ назначается при подозрении на наличие воспалительного процесса в органах мочевыделительной системы у беременной женщины, в том случае если есть изменения в общем анализе мочи.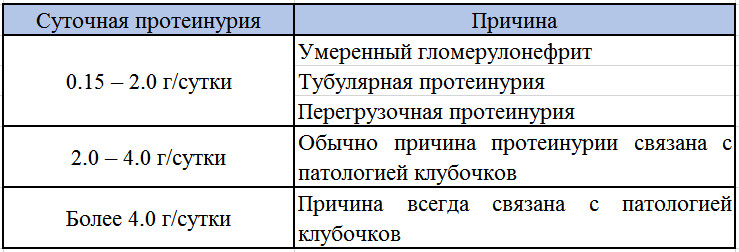 Он дает более точные результаты, чем общий анализ мочи, а также позволяет контролировать в динамике проводимое лечение.
Он дает более точные результаты, чем общий анализ мочи, а также позволяет контролировать в динамике проводимое лечение.
Правила сбора мочи. Моча для анализа по Нечипоренко собирается так же, как для общего анализа мочи.
Исследуемые параметры
- Количество лейкоцитов – в норме их должно быть менее 2 тысяч в 1 мл. Повышение количества лейкоцитов говорит о наличии пиелонефрита (воспалительного заболевания лоханок и чашек почек).
- Количество эритроцитов – в норме их менее 1 тысячи в 1 мл. Повышение количества эритроцитов свидетельствует о развитии гломерулонефрита (воспаление почечных клубочков).
- Количество цилиндров – в норме их менее 20 в 1 мл. Обнаружение повышенного содержания цилиндров говорит об артериальной гипертонии, заболеваниях сердечно-сосудистой системы, может встречаться при раннем токсикозе беременных.
Записаться на прием
Анализ мочи по Зимницкому
Цель исследования. Этот анализ назначается для уточнения способности почек концентрировать и разбавлять мочу, выявления скрытых отеков. Исследование может понадобиться при подозрении на развитие гестоза, почечной недостаточности, при инфекциях мочевыделительной системы, а также при сахарном диабете.
Этот анализ назначается для уточнения способности почек концентрировать и разбавлять мочу, выявления скрытых отеков. Исследование может понадобиться при подозрении на развитие гестоза, почечной недостаточности, при инфекциях мочевыделительной системы, а также при сахарном диабете.
Правила сбора мочи. Для анализа мочи по Зимницкому моча собирается в течение суток (24 часов) в 8 контейнеров (банок), при этом обязательно учитывается количество выпитой жидкости (беременная записывает, сколько выпивает жидкости в течение суток, с учетом супов, фруктов и овощей). В 6 утра женщина мочится в унитаз, затем вся последующая моча собирается в банки.
Всего 8 порций:
- 1 порция — с 6-00 до 9-00 часов,
- 2 порция — с 9-00 до 12-00 часов,
- 3 порция — с 12-00 до 15-00 часов,
- 4 порция — с 15-00 до 18-00 часов,
- 5 порция — с 18-00 до 21-00 часа,
- 6 порция — с 21-00 до 24-00 часов,
- 7 порция — с 24-00 до 3-00 часов,
- 8 порция — с 3-00 до 6-00 часов.

Банки подписываются и доставляются в лабораторию.
Исследуемые параметры. Оценивается количество и удельный вес мочи в каждой порции. Для нормальной функции почек характерно:
- объем суточной мочи около 1,5 литров;
- преобладание дневного мочеотделения над ночным;
- выделение с мочой примерно 70—80% выпитой за сутки жидкости;
- удельный вес мочи хотя бы в одной из порций не ниже 1,020—1,022;
- значительные колебания в течение суток количества мочи в отдельных порциях (от 50 до 400 мл) и удельного веса мочи (от 1,003 до 1,028).
Отклонения от данных нормативов свидетельствуют о нарушении в работе почек.
Записаться на прием
Проба Реберга
Цель исследования. Этот анализ назначается для определения способности почек фильтровать мочу. Его обязательно проводят всем беременным с гестозом, при инфекциях мочевыводящих путей, при заболеваниях почек, при сахарном диабете.
Правила сбора мочи. Перед проведением пробы исключаются интенсивные физические нагрузки, крепкий чай и кофе. Моча собирается в течение суток в одну емкость, которая хранится в холодильнике в течение всего времени сбора. После завершения сбора мочи содержимое емкости измерить, обязательно перемешать и сразу же отлить 70—100 мл в специальный контейнер или в банку и доставить в лабораторию, сообщив при этом общий объем собранной за сутки мочи.
В момент доставки мочи в лабораторию сдается кровь на креатинин из вены.
Записаться на прием
Исследуемые параметры. Метод основан на оценке клубочковой фильтрации по скорости очищения плазмы крови от креатинина – особого продукта расщепления белков. Этот показатель можно определить, если знать концентрацию креатинина в крови, в моче и суточный объем мочи. Рассчитывается данный показатель по специальной формуле и называется клиренсом креатинина. В норме значение этого показателя колеблется в пределах от 75 до134 мл/мин/1,7 м2.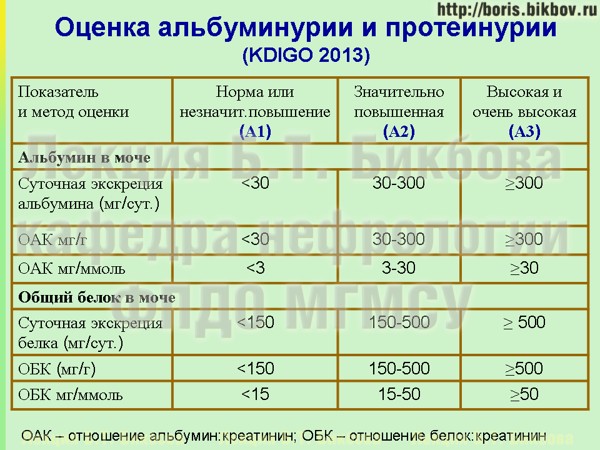 Снижение уровня почечной фильтрации свидетельствует о поражении почек и встречается при тяжелых осложнениях беременности – гестозе, заболеваниях почек (пиелонефрите, гломерулонефрите), сахарном диабете, артериальной гипертонии, мочекаменной болезни.
Снижение уровня почечной фильтрации свидетельствует о поражении почек и встречается при тяжелых осложнениях беременности – гестозе, заболеваниях почек (пиелонефрите, гломерулонефрите), сахарном диабете, артериальной гипертонии, мочекаменной болезни.
Записаться на прием
Моча на 17-КС
Этот анализ ранее широко назначался беременным женщинам для определения гормонов, вырабатываемых корой эндокринных желез — надпочечников. Для анализа моча собиралась в течение суток, перемешивалась, отливалась небольшая ее часть, которая доставлялась в лабораторию с указанием общего количества собранной мочи. Повышение концентрации 17- кетостероидов в моче свидетельствовало об избыточной продукции гормонов в организме беременной женщины, на основании чего врач назначал гормональные препараты. Однако в настоящее время определение данных веществ в моче считается неинформативным и не используется во время беременности.
Анализы мочи являются очень простыми в выполнении и очень информативными для врача, они позволяют своевременно выявить малейшие изменения в организме будущей мамы и своевременно начать лечение, что помогает предотвратить серьезные осложнения со стороны беременной женщины и будущего малыша.
Записаться на прием
Альбумин в моче (микроальбуминурия)
Исследование для определения наличия в моче основных белков плазмы крови — альбуминов. Белки именно этой группы в первую очередь начинают попадать в мочу при заболеваниях почек. Их появление в моче – один из самых ранних лабораторных показателей нефропатии.
Синонимы русские
Микроальбумин в моче, микроальбуминурия (МАУ).
Синонимы английские
Мicroalbumin.
Метод исследования
Иммунотурбидиметрия.
Единицы измерения
Мг/сут. (миллиграмм в сутки).
Какой биоматериал можно использовать для исследования?
Суточную мочу.
Как правильно подготовиться к исследованию?
- Исключить из рациона алкоголь за 24 часа до исследования.
- Исключить прием мочегонных препаратов за 48 часов до сдачи мочи (по согласованию с врачом).
Общая информация об исследовании
Альбумины – это растворимые в воде белки. Они синтезируется в печени и составляют большую часть белков сыворотки крови. В организме здорового человека в норме с мочой выводится лишь небольшое количество альбуминов, имеющих самый маленький размер, – микроальбуминов, так как почечные клубочки непораженной почки для более крупных по размеру молекул альбумина непроницаемы. При начальных стадиях поражения клеточных мембран почечного клубочка с мочой выводится все больше микроальбуминов, по мере прогрессирования поражения начинают выделяться и более крупные альбумины. Этот процесс поделен на стадии по количеству экскретируемых белков (от 30 до 300 мг/сут., или от 20 до 200 мг/мл в утренней порции мочи, принято считать микроальбуминурией (МАУ), а более 300 мг/сут. – протеинурией). МАУ всегда предшествует протеинурии. Однако, как правило, при выявлении у пациента протеинурии изменения в почках уже необратимы и лечение может быть направлено лишь на стабилизацию процесса. На стадии МАУ изменения в почечных клубочках еще можно остановить при помощи правильно подобранной терапии.
Они синтезируется в печени и составляют большую часть белков сыворотки крови. В организме здорового человека в норме с мочой выводится лишь небольшое количество альбуминов, имеющих самый маленький размер, – микроальбуминов, так как почечные клубочки непораженной почки для более крупных по размеру молекул альбумина непроницаемы. При начальных стадиях поражения клеточных мембран почечного клубочка с мочой выводится все больше микроальбуминов, по мере прогрессирования поражения начинают выделяться и более крупные альбумины. Этот процесс поделен на стадии по количеству экскретируемых белков (от 30 до 300 мг/сут., или от 20 до 200 мг/мл в утренней порции мочи, принято считать микроальбуминурией (МАУ), а более 300 мг/сут. – протеинурией). МАУ всегда предшествует протеинурии. Однако, как правило, при выявлении у пациента протеинурии изменения в почках уже необратимы и лечение может быть направлено лишь на стабилизацию процесса. На стадии МАУ изменения в почечных клубочках еще можно остановить при помощи правильно подобранной терапии. Таким образом, под микроальбуминурией понимают выделение альбумина с мочой в таком количестве, которое превышает физиологический уровень его экскреции, но предшествует протеинурии.
Таким образом, под микроальбуминурией понимают выделение альбумина с мочой в таком количестве, которое превышает физиологический уровень его экскреции, но предшествует протеинурии.
В развитии нефропатии (как диабетической, так и вызванной гипертонией, гломерулонефритом) выделяют два периода. Первый – доклинический, в течение которого практически невозможно выявить какие-либо изменения в почках, используя традиционные клинические и лабораторные методы исследования. Второй – клинически выраженной нефропатии – далеко зашедшая нефропатия с протеинурией и хронической почечной недостаточностью. В этом периоде нарушения функций почек уже можно диагностировать. Получается, только с помощью определения микроальбумина в моче можно выявить начальную стадию нефропатии. При некоторых заболеваниях почек МАУ очень быстро переходит в протенурию, однако это не касается дизметаболических нефропатий (ДН). МАУ может в течение нескольких лет предшествовать проявлению ДН.
Поскольку ДН и развивающаяся вследствие нее хроническая почечная недостаточность (ХПН) занимают сегодня первое место по распространенности среди заболеваний почек (в России, Европе, США), определение МАУ у пациентов с сахарным диабетом (СД) I и II типа наиболее значимо.
Раннее выявление ДН чрезвычайно важно, поскольку доказана возможность замедления развития ДН и почечной недостаточности. Единственным лабораторным критерием, позволяющим с высокой степенью достоверности выявить доклиническую стадию ДН, является МАУ.
Целесообразно назначать анализ на микроальбумин мочи при начальных признаках нефропатии у беременных, но при отсутствии протеинурии (для дифференциальной диагностики).
Для чего используется исследование?
- Для ранней диагностики диабетической нефропатии.
- Для диагностики нефропатии при системных заболеваниях (вторичной нефропатии), возникающей при длительной гипертонии, застойной сердечной недостаточности.
- Для мониторинга функции почек при лечении различных видов вторичной нефропатии (в первую очередь ДН).
- Для диагностики нефропатии при беременности.
- Для выявления ранних стадий нефропатии, возникшей из-за гломерулонефрита, воспалительных и кистозных заболеваний почек (первичной нефропатии).

- Чтобы выявить нарушения функции почек при аутоиммунных заболеваниях, таких как системная красная волчанка, амилоидоз.
Когда назначается исследование?
- При впервые выявленном сахарном диабете II типа (и далее каждые 6 месяцев).
- При сахарном диабете I типа длительностью более 5 лет (1 раз в 6 месяцев – обязательно).
- При сахарном диабете у детей в раннем возрасте, с лабильным течением сахарного диабета (частые декомпенсации: кетозы, диабетические кетоацидозы, гипогликемии), через 1 год с начала заболевания.
- При длительной, в особенности некомпенсированной артериальной гипертензии, застойной сердечной недостаточности, сопровождающихся специфическими отеками.
- Во время беременности при симптомах нефропатии (если общий анализ мочи показал отсутствие протеинурии).
- При дифференциальной диагностике ранних стадий гломерулонефрита.
- При системной красной волчанке, амилоидозе для ранней диагностики специфического поражения почек, сопровождающего данные заболевания.

Что означают результаты?
Референсные значения: 0 — 30 мг/сут.
Причины повышения уровня микроальбумина:
- дизметаболическая нефропатия,
- нефропатия, вызванная гипертензией, сердечной недостаточностью,
- рефлюксная нефропатия,
- лучевая нефропатия,
- ранняя стадия гломерулонефрита,
- пиелонефрит,
- переохлаждение,
- тромбоз почечных вен,
- поликистоз почек,
- нефропатия беременных,
- системная красная волчанка (волчаночный нефрит),
- амилоидоз почек,
- множественная миелома.
Понижение уровня микроальбумина не является диагностически значимым.
Что может влиять на результат?
Выделение альбумина с мочой увеличивают:
- дегидратация,
- тяжелая физическая нагрузка,
- диета с высоким содержанием белка,
- заболевания, протекающие с повышением температуры тела,
- воспалительные заболевания мочевыводящих путей (циститы, уретриты).

Выделение альбумина с мочой уменьшают:
- избыточная гидратация,
- диета с низким содержанием белка,
- прием ингибиторов ангиотензин-превращающего фермента (каптоприла, эналаприла и др.),
- прием нестероидных противовоспалительных препаратов.
Страница не найдена |
Страница не найдена |
404. Страница не найдена
Архив за месяц
ПнВтСрЧтПтСбВс
2728293031
12
12
1
3031
12
15161718192021
25262728293031
123
45678910
12
17181920212223
31
2728293031
1
1234
567891011
12
891011121314
11121314151617
28293031
1234
12
12345
6789101112
567891011
12131415161718
19202122232425
3456789
17181920212223
24252627282930
12345
13141516171819
20212223242526
2728293031
15161718192021
22232425262728
2930
Архивы
Метки
Настройки
для слабовидящих
Лабораторная диагностика мочи в СЗДЦМ
Одно из рутинных медицинских исследований — лабораторный анализ мочи. Эта методика широко применяется в виду легкости забора биоматериала и информативности. Исследование мочи позволяет подтвердить или исключить целый ряд состояний и заболеваний. Благодаря изучению анализа можно не только оценить работу почек но и деятельность всего организма, так как моча является продуктом жизнедеятельности и носит отпечаток большинства процессов в организме.
Эта методика широко применяется в виду легкости забора биоматериала и информативности. Исследование мочи позволяет подтвердить или исключить целый ряд состояний и заболеваний. Благодаря изучению анализа можно не только оценить работу почек но и деятельность всего организма, так как моча является продуктом жизнедеятельности и носит отпечаток большинства процессов в организме.
Все вещества, уровень которых в организме повышен, выводятся вместе с мочой, на чем и построена лабораторная диагностика. Общий анализ мочи назначается практически каждому пациенту и входит в число обязательных исследований. Есть другие методы исследования биоматериала, которые назначаются, чаще всего, при патологии почек и выделительной системы. Особенность анализа мочи заключается в том, что методика чувствительна к изменениям в организме, когда симптомов еще нет, что важно для постановки диагноза на ранних этапах.
Виды лабораторной диагностики мочи
Различают такие виды анализа мочи:
Перейти к анализам
В зависимости от патологии назначается тот или иной вид исследования. Общий анализ мочи показан при любом заболевании, так как это общий клинический метод исследования, который является рутинным. Анализы мочи необходимо оценивать комплексно, исходя из данных анализа крови, инструментальных методов исследования, общего состояния пациента. При необходимости, анализ назначают в динамике. особенно это актуально для пациентов урологического, нефрологического профиля. Большое значение анализ мочи имеет для тех, кто перенес оперативное вмешательство, проходит дезинтоксикацию. Регулярная проверка данных анализа мочи актуальна при оценке лечения, для его коррекции, при необходимости.
Общий анализ мочи показан при любом заболевании, так как это общий клинический метод исследования, который является рутинным. Анализы мочи необходимо оценивать комплексно, исходя из данных анализа крови, инструментальных методов исследования, общего состояния пациента. При необходимости, анализ назначают в динамике. особенно это актуально для пациентов урологического, нефрологического профиля. Большое значение анализ мочи имеет для тех, кто перенес оперативное вмешательство, проходит дезинтоксикацию. Регулярная проверка данных анализа мочи актуальна при оценке лечения, для его коррекции, при необходимости.
Рассмотрим каждую методику более подробно.
Общий анализ мочи
Один из основных методов исследования, который применяется в медицинской практике. Основан на том факте, что моча — сложный раствор минералов, солей и органических веществ. В воде, которая составляет большую часть мочи, растворены тысячи веществ. В большей степени с мочой выделяется мочевина и хлорид натрия. В остальном, даже у здоровых людей состав мочи постоянно меняется. В общий анализ входит оценка прозрачности, кислотности, плотности. Изучается количество базовых элементов осадка — уровень белка, глюкозы, кетоновых тел, форменных элементов крови, пигментов.
В большей степени с мочой выделяется мочевина и хлорид натрия. В остальном, даже у здоровых людей состав мочи постоянно меняется. В общий анализ входит оценка прозрачности, кислотности, плотности. Изучается количество базовых элементов осадка — уровень белка, глюкозы, кетоновых тел, форменных элементов крови, пигментов.
Общий анализ мочи позволяет контролировать и корректировать лечение, дает исчерпывающую информацию о том, какие процессы происходят в организме. Он быстрый в выполнении и не требует сложной аппаратуры, потому распространен и часто применяется.
Общий анализ мочи не требует особой подготовки. В ургентных случаях проводится сбор, независимо от подготовки пациента.
Анализ мочи по Нечипоренко
Методика предложена специалистом урологом, Нечипоренко А.З. Особенность методики — подсчет исследуемых параметров проводится не в поле зрения, как при общем анализе, а в единице мочи. Методика имеет высокую информативность, не требует значительных затрат и времени, возможна при небольшом количестве мочи и не требует особой подготовки.
Методика имеет высокую информативность, не требует значительных затрат и времени, возможна при небольшом количестве мочи и не требует особой подготовки.
Применяется, как уточнение общего анализа, если он показал отклонения. Некоторые показатели общий анализ не освещает досконально и требуется более детальное исследование. Он не заменяет общий анализ, а дополняет его. Широко применяется в урологии, терапии, хирургии и нефрологии.
Анализ мочи по Нечипоренко назначается, если в общем анализе найдены следы крови, лейкоциты, следы белка. Методика информативна при диагностике и лечении различных заболеваний почек и мочевыводящей системы. С помощью анализа изменяется количество эритроцитов, лейкоцитов, цилиндров. Оценивается состав цилиндров, их строение.
Измерение уровня белка в моче
Белок, который выводится из организма в составе мочи — это только следы всего количества белка, который ежедневно фильтруется и реабсорбируется обратно в структурах почки. Иногда, белок повышается на основе функциональных изменений, даже у здоровых людей. Это наблюдается при изменениях показателей кровообращения, острых заболеваниях, изменениях температуры. Функциональная протеинурия проходит одновременно с причиной, которая её вызвала.
Иногда, белок повышается на основе функциональных изменений, даже у здоровых людей. Это наблюдается при изменениях показателей кровообращения, острых заболеваниях, изменениях температуры. Функциональная протеинурия проходит одновременно с причиной, которая её вызвала.
Протеинурия — содержание белка в моче, говорит о снижении нормальной функции почек задерживать белок в организме. Это может быть повышенная фильтрация или сниженная реабсорбция. Также, белок может быть изначально повышен в организме, а с мочой выводится его излишек.
Микроскопический анализ мочи
Данный метод позволяет изучить организованный и неорганизованный осадок мочи, оценить количество и качество цилиндров. Речь идет о более чем десяти показателях. Во внимание берутся эпителиальные клетки и цилиндры, форменные элементы крови. Из неорганизованного осадка, измеряется уровень солей, ионов, минералов. Чаще всего, изучается уровень уратов, фосфатов и оксалатов. Повышение данных показателей может говорить о серьезных обменных нарушениях и заболеваниях.
Повышение данных показателей может говорить о серьезных обменных нарушениях и заболеваниях.
Под цилиндрами имеются в виду слепки мочевыводящих путей, которые формируются из различных веществ — гиалина, эритроцитов, эпителия. Они формируются в почечных канальцах и говорят о нарушениях работы почек, а также об общих изменениях в организме.
Оценка уровня глюкозы в моче
В норме, моча содержит низкую концентрацию глюкозы. Она не выявляется при стандартной методике исследования, потому нормы показателей соответствуют отсутствию глюкозы в моче. Если глюкозу определяют в моче, это называется глюкозурией. Чаще всего, это сопряжено с повышением глюкозы в организме (гипергликемией). Не страшно, если глюкоза повышается при высоком употреблении углеводов, приеме некоторых медикаментов. Бывает, что глюкоза в крови находится на нормальном уровне, но в моче её концентрация повышена — это происходит при некоторых патологиях, во время вынашивания плода. Обязательно учитывается потребление углеводов и объем мочи, который вывелся из организма за сутки, это делает анализ более объективным.
Обязательно учитывается потребление углеводов и объем мочи, который вывелся из организма за сутки, это делает анализ более объективным.
Основные свойства мочи и патологии, при которых они меняются
К основным показателям мочи относятся:
Рассмотрим эти показатели подробнее.
Объем
В норме, объем порции мочи составляет 100-300 мл. Низкое количество объема мочи говорит о недостаточности почек, обезвоживании. Полиурия — увеличение объема мочи, которое может говорить о наличии диабета, пиелонефрита и других состояниях. Различают олигурию — суточное количество мочи до 500 мл. Она возникает при патологиях сердца, почек. Есть также анурия — суточное количество мочи до 200 мл. Это серьезное состояние, которое встречается при онкологических заболеваниях, менингите, острой недостаточности почек.
Кроме объема мочи оценивается характер мочеиспускания. Это может быть преобладание ночного диуреза над дневным, хотя в норме должно быть наоборот. К отклонениям относят небольшие и частые порции мочи, болезненное мочеиспускание, непроизвольные акты и ложные позывы. Необходимо оценивать эти показатели комплексно, ведь они формируют полноценную клиническую картину.
Это может быть преобладание ночного диуреза над дневным, хотя в норме должно быть наоборот. К отклонениям относят небольшие и частые порции мочи, болезненное мочеиспускание, непроизвольные акты и ложные позывы. Необходимо оценивать эти показатели комплексно, ведь они формируют полноценную клиническую картину.
Цвет
Нормальная моча имеет соломенно-желтый цвет. По изменению цвета можно сказать многое. К примеру, оранжевый оттенок придают желчные пигменты, которые повышаются в моче при гепатитах, циррозе, нарушениях оттока желчи. Красный цвет наблюдается при повышении эритроцитов в моче. Это сопровождает пиелонефрит, прохождение почечных камней, рак, туберкулез. Зеленовато-белый цвет наблюдается при вкраплениях гноя. Черный цвет мочи бывает при отравлениях. интоксикациях. Моча может быть коричневой, её еще сравнивают с цветом пива — это происходит при нарушениях обмена желчных пигментов, обезвоживании, употреблении некоторых продуктов и химических веществ.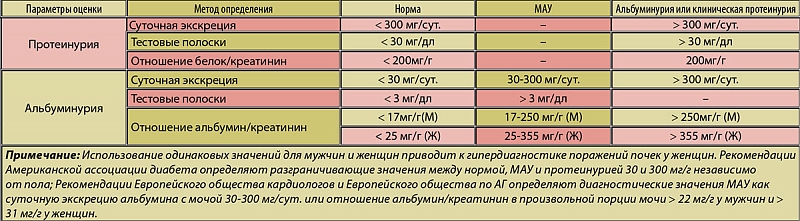
Цвет мочи может меняться в зависимости от продуктов питания, медикаментов. Нормальный цвет не исключает изменений и патологии, но нарушение этого показателя отчетливо говорит о проблеме.
Запах
При некоторых состояниях моча меняет свой запах. К примеру, при воспалении она пахнет аммиаком. У пациентов с диабетом наблюдается легкий запах ацетона. Нормальный запах мочи — специфический, но не резкий, без дополнительных оттенков. Этот показатель не специфический и не используется широко. Это, скорее, показатель, который может насторожить пациента и послужить поводом обращения к врачу.
Наличие пены
Пены в моче быть не должно. Она может появляться при желтухах, повышенном количестве белка, диабете и других нарушениях обмена веществ.
Прозрачность
В норме, моча должна быть прозрачной. Она становится мутной, если имеет примеси гноя, солей, большое количество слизи или форменных элементов. Это наблюдается при инфекционных заболеваниях. В лабораторных условиях используют различные реагенты и изучают, какой из них сделает мочу прозрачной. Для этого применяются кислоты, спирт, нагревание. Эффективность определенного метода говорит о том, что послужило причиной помутнения мочи.
Это наблюдается при инфекционных заболеваниях. В лабораторных условиях используют различные реагенты и изучают, какой из них сделает мочу прозрачной. Для этого применяются кислоты, спирт, нагревание. Эффективность определенного метода говорит о том, что послужило причиной помутнения мочи.
Плотность
Повышение показателя говорит о снижении воды в организме, а снижение — о патологии почек. Норма — 1018-1025 единиц. На уровень плотности влияет количество белка, глюкозы, осадка, наличие бактерий. Низкая плотность наблюдается при диабете, почечной недостаточности, гипертонии, использовании диуретиков. Высокая плотность наблюдается при различных интоксикациях, отеках.
Кислотность мочи
Норма рН мочи 5-7, то есть слабокислая или нейтральная. Более кислая среда наблюдается при туберкулезе, нефрите, подагре, ацидотических изменениях в организме. Также, кислая моча наблюдается при повышенном употреблении белков животного происхождения, некоторых медикаментов.
Щелочная реакция сопровождает высокое количество овощей в рационе, употребление щелочных минеральных вод, гиперкалиемию, алкалоз, воспалительные заболевания.
Нормы и расшифровка результатов исследования
Белок
Норма — до 0,033 г/л
Причины повышения: диабет, патология сердечнососудистой системы, амилоидоз, обменные нарушения.
Глюкоза
Норма — отсутствует
Повышена при диабете, нарушении мочевыводящих путей, воспалительных процессах в почках.
Билирубин
В норме — отсутствует
Повышен при патологии печени, желчевыводящих путей.
Кетоновые тела
В норме — отсутствуют. Появляются при диабете.
Эритроциты
Норма — не больше 2 в поле зрения
Появляются при мочекаменной болезни, пиелонефрите, инфекционных заболеваниях, системных патологиях и отравлениях.
Лейкоциты
В норме, в поле зрения может присутствовать 3-5 клеток.
Повышение показателя происходит при цистите, простатите, уретрите и других воспалительных процессах.
Гиалиновые цилиндры
В норме не должны быть обнаружены.
Появляются при почечной патологии, сердечнососудистых заболеваниях, гипертермии.
Зернистые цилиндры
В норме отсутствуют.
Появляются при пиелонефрите, гломерулонефрите, нефропатии при диабете, некоторых инфекциях и отравлениях.
Соли
В норме, их быть не должно.
Появляются при изменениях рациона, выраженных физических нагрузках, подагре, недостаточности почек.
Как подготовиться к диагностике
Для исследования используется утренняя порция мочи. Необходимо провести тщательный туалет наружных половых органов, так как это делает диагностику более точной. Не проводится сбор мочи во время менструаций. Накануне необходимо ограничить употребление овощей, фруктов, которые имеют яркий цвет. С вечера нельзя есть острые маринады, соусы, копчености, мед. Также, стоит ограничить употребление некоторых медикаментов. Заранее посоветуйтесь об этом с лечащим врачом. Перед сбором мочи желательно избегать сильных физических нагрузок. Ограничьте потребление алкоголя, крепкого чая, кофе.
Не проводится сбор мочи во время менструаций. Накануне необходимо ограничить употребление овощей, фруктов, которые имеют яркий цвет. С вечера нельзя есть острые маринады, соусы, копчености, мед. Также, стоит ограничить употребление некоторых медикаментов. Заранее посоветуйтесь об этом с лечащим врачом. Перед сбором мочи желательно избегать сильных физических нагрузок. Ограничьте потребление алкоголя, крепкого чая, кофе.
Как правильно собрать материал для исследования?
После соответствующей подготовки мочу собирают в сухую стерильную посуду. Для этого нужно использовать специальный контейнер, предназначенный для одноразового использования. Лучше не собирать первую порцию мочи, так как в ней могут содержаться следы смыва с наружных половых органов. Лучше начать сбор с чистой, второй порции мочи. Контейнер не должен касаться тела во время забора материала. Сбор лучше прекратить до конца акта мочеиспускания. После сбора необходимой порции контейнер плотно закрывают крышкой.
Обратите внимание, что сбор мочи необходимо проводить незадолго до исследования. Не храните контейнер дольше, чем 2 часа и следите за тем, чтобы он находился в прохладном месте.
Сбор суточной мочи
Если вам назначили сбор суточной мочи, следуйте своему обычному образу жизни и привычному питьевому режиму. Первая утренняя порция выливается, а собирается вся остальная моча в течении дня. Необходимо проводить сбор в посуду с широким горлом и достаточным объемом. Все время в течении дня посуда должна стоять в прохладном месте, однако нельзя допускать её перемерзания. Время начала сбора и его конца должно совпадать.
Анализ по Нечипоренко
Для анализа необходимо собрать среднюю порцию первой утренней мочи. Мужчина во время мочеиспускания должен оттянуть кожную складку над половым членом и освободить отверстие мочеиспускательного канала. Женщинам необходимо раздвинуть половые губы.
Начало мочеиспускания происходит в первый канал, следующая порция собирается во второй, а последняя — в третий. Вторая порция должна преобладать по объему.
Анализ для бактериологического исследования
Сбор проводится утром, после тщательного туалета половых органов. Собирается вторая, средняя порция.
Общие правила для любого анализа — чистая сухая посуда, надлежащие условия хранения и быстрая доставка в лабораторию.
Сроки готовности результатов
Результаты анализов мочи могут быть готовы уже на следующий день. Может понадобиться время на действие химических реагентов, но, в целом, анализ мочи не требует значительных затрат времени.
Желательно сдавать анализы в одной и той же лаборатории, особенно, если есть хроническая патология и необходимо отслеживать состояние.
Анализ на общий белок в суточный моче
Метод определения
Бензетониум хлорид, фотометрия.
Исследуемый материал
Суточная моча
Доступен выезд на дом
Онлайн-регистрация
Показатель, использующийся для оценки функционального состояния почек.
Белки, выводимые с мочой, представляют собой малую часть фильтруемых в почечных клубочках белков. Основная их часть (98%) всасывается обратно (реабсорбируется) в проксимальных канальцах почек. Как прохождение через почечный фильтр, так и реабсорбция, зависят от индивидуальных свойств белков — заряда, размера, строения. Нормальное выделение общего белка у взрослого человека за сутки не превышает 150 мг. Основное выведение белка обычно приходится на дневное время (ходьба и вертикальное положение тела повышают действие гемодинамических сил на клубочковую фильтрацию).
Нарушение способности гломерулярного фильтра селективно задерживать отрицательно заряженные белки (которое провоцируется или активируетсяся инфекциями, аллергическими реакциями, иммунизацией) приводит к селективной протеинурии — потере низкомолекулярных заряженных белков (альбумина и др.). Потеря барьерных свойств по отношению к размеру фильтрующихся частиц с развитием неселективной протеинурии наблюдается при накапливании в стенке почечного фильтра определенных белков или активации в стенке клубочковых капилляров клеток воспаления, вызывающих повреждение фильтра (заболевания с иммунными комплексами, сахарный диабет, хронические инфекции, опухоли).
Потеря больших количеств белка с мочой (> 3 г/сутки) почти всегда связана с нарушением функции гломерулярного фильтра в отношении заряда или размера белков, что ведет к нефротическому синдрому. При некоторых патологических состояниях наблюдается потеря белка, связанная с нарушением реабсорбции белков в проксимальном канальце (определённые почечные заболевания, побочное действие некоторых лекарств и токсических веществ, иммунные процессы, инфекции, системные заболевания).
Выделение белка в этих случаях никогда не превышает 3 г/сутки. Ещё один вид протеинурии (перегрузочная) связан с появлением в плазме крови аномально большого количества определённых белков, превышающего способность канальцев к их реабсорбции (лёгкие цепи иммуноглобулинов при миеломной болезни, гемоглобин при гемолизе, миоглобин при распаде мышечной ткани).
В моче содержатся и другие белки, помимо тех, что фильтруются в клубочке. Они образуются в мочевом тракте и составляют примерно 50% всех белков мочи. Основной из них (белок Тамма-Хорсфалля) секретируется клетками толстой восходящей петли Генле, он входит в состав гиалиновых цилиндров, которые находят в моче. Часть белков мочи может поступить из мочеполового тракта (мочеточник, мочевой пузырь, мочеиспускательный канал) — содержание этих в моче резко повышается при инфекциях, воспалении или опухолях мочеполового тракта.
Функциональная протеинурия (состояние повышенной потери белка с мочой у больного со здоровыми почками) может наблюдаться при гемодинамическом стрессе, вызванном высокой температурой, застойной сердечной недостаточностью, охлаждением или какими-либо острыми заболеваниями внутренних органов.![]() Эта протеинурия исчезает после устранения вызвавшей её причины.
Эта протеинурия исчезает после устранения вызвавшей её причины.
Суточный анализ мочи — когда назначается, как собирать. Суточный диурез
Автор
Андрюхин Михаил Иванович
Врач
Доктор медицинских наук, профессор
Уролог
Суточный анализ мочи – это метод лабораторной диагностики, при котором объектом исследования является сразу весь суточный диурез (моча, выделенная пациентом за сутки).
Когда назначается суточный анализ мочи
Суточный анализ мочи назначается, прежде всего, для проверки функционирования почек, а также в целях контроля веществ, выводимых из организма с мочой в течение суток.
Показаниями к назначению суточного анализа мочи являются:
- подозрения на некоторые заболевания почек;
-
сахарный диабет. Анализ используется для контроля суточного уровня глюкозы в моче; -
беременность. Анализ используется для оценки, насколько хорошо почки будущей матери справляются с повышенной нагрузкой.
Подготовка к суточному анализу мочи
Специальной подготовки к суточному анализу мочи не требуется. В день сбора мочи должен быть исключен прием мочегонных препаратов. Также необходимо в этот день соблюдать обычный питьевой режим (количество потребленной жидкости должно быть таким, как обычно).
Как собрать суточную мочу на анализ
Суточный анализ мочиСбор мочи осуществляется в большую стерильную емкость. Предпочтительно использовать емкость, имеющие мерные деления (потом надо будет установить весь объем собранной мочи).
Предпочтительно использовать емкость, имеющие мерные деления (потом надо будет установить весь объем собранной мочи).
Утренняя порция мочи выпускается в унитаз. При следующем мочеиспускании моча собирается в ёмкость. Необходимо будет заметить, во сколько это произошло. Далее, вся моча в течение суток (до того же времени следующего дня) должна собираться в эту же ёмкость.
Крайне важно, чтобы была собрана вся суточная моча, поэтому на день сбора материала анализа не следует планировать дальних поездок.
Ёмкость с мочой необходимо держать в холодильнике.
По окончании сбора материала надо будет самостоятельно оценить общий объём собранной мочи. После чего моча перемешивается и часть её (до 200 мл) отливается в специальный контейнер. Именно этот контейнер доставляется в лабораторию (весь объём мочи доставлять не надо).
При сдаче мочи в лабораторию необходимо указать с какого по какое время собиралась моча; каков получился общий объем мочи. В некоторых случаях потребуется указать свой точный рост и вес.
В некоторых случаях потребуется указать свой точный рост и вес.
Показатели суточного анализа мочи
Основными показателями, которые оцениваются при суточном анализе мочи, являются:
- общий объем мочи (суточный диурез). В норме суточный диурез должен составлять: у женщин – 1000-1600 мл, у мужчин – 1000-2000 мл;
- креатинин. Норма для этого показателя составляет 5,3-16 ммоль/сут для женщин и 7-18 ммоль/сут для мужчин. Повышенные значения могут указывать на сахарный диабет, острые инфекции, гипотериоз (заболевание щитовидной железы) и некоторые другие патологии. Значения ниже нормы могут наблюдаться при заболеваниях почках, анемии и других патологиях;
- мочевина. Норма – 250-570 ммоль/сут. Повышенные значения характерны для гиперфункции щитовидной железы или злокачественной анемии; они также могут наблюдаться при значительных физических нагрузках или приеме в пищу продуктов с большим содержанием белка;
- белок.
 Суточный анализ мочи на белок назначается, как правило, после того, как повышенный белок был обнаружен при общеклиническом анализе. Нормальные значения для суточного анализа: выделение белка 0,08-0,24 г/сут, концентрация – 0,0 – 0,14 г/л;
Суточный анализ мочи на белок назначается, как правило, после того, как повышенный белок был обнаружен при общеклиническом анализе. Нормальные значения для суточного анализа: выделение белка 0,08-0,24 г/сут, концентрация – 0,0 – 0,14 г/л; - глюкоза. Суточный анализ мочи на глюкозу назначается при сахарном диабете. С его помощью контролируют состояние больного и эффективность проводимой терапии. Нормальное значение этого показателя – не более 1,6 ммоль/сут.
- оксалаты. Норма: 228-626 мкмоль/сут или 20-54 мг/сут (для женщин) и 228-683 мкмоль/сут или 20-60 мг/сут (для мужчин).
Не занимайтесь самолечением. Обратитесь к нашим специалистам, которые правильно поставят диагноз и назначат лечение.
Интермедикал | Суточная протеинурия
Протеинурия (белок в суточной моче) — показатель выведения белков с мочой за сутки, отражающий функциональное состояние почек.
Основные показания к назначению: профилактические осмотры, патология почек, сахарный диабет, сердечно-сосудистые заболевания, инфекции и многие другие заболевания.![]()
Небольшое количество белка в моче обнаруживается и у вполне здоровых лиц. Однако эти концентрации белка не определяются в разовых порциях мочи при его определении широко используемыми обычными методами (на тест-полосках). Большинство исследователей указывают, что содержание в разовой моче в норме составляет до 140 мг/л (до 0,140 г/л.Чтобы точнее выявить потери белка с мочой желательно проводить исследование концентрации белка в суточной моче.
В нормальной моче обнаруживаются следы белка, включая альбумин и глобулины, а также гликопротеины и мукопротеины со слизистых оболочек мочеполовых путей. При реально возникающей протеинурии основными компонентами общего белка мочи является альбумин сыворотки (и частично глобулины). Поэтому целесообразно провести определение в моче именно альбумина.
Основной причиной повышенного содержания белка в моче является повышение проницаемости мембраны клубочков. Заболевания увеличивающие проницаемость мембраны способствуют развитию нефротического синдрома, характеризующегося существенными потерями белка с мочой. К таким заболеваниям относят: острый гломерулонефрит, хронический гломерулонефрит, связанный с первичным поражением клубочков и последующим повышением проницаемости мембраны, амилоидоз, когда в стенках кровеносных сосудов откладывается патологический белок, приводящий к повреждению мембраны клубочков, токсикоз беременных.
К таким заболеваниям относят: острый гломерулонефрит, хронический гломерулонефрит, связанный с первичным поражением клубочков и последующим повышением проницаемости мембраны, амилоидоз, когда в стенках кровеносных сосудов откладывается патологический белок, приводящий к повреждению мембраны клубочков, токсикоз беременных.
Целесообразно различать вариабельность протеинурии: при суточной потере белка до 1 г – умеренную, от 1 до 3 г – среднюю и более 3 г – выраженную.
Различают физиологическую протеинурию, связанную с большим употреблением белка с пищей, физическими нагрузками и патологическую. Патологическая, чаще связана с почечными заболеваниями: гломерулонефрит, пиелонефрит. Протеинурия развивается вследствие поражения мембраны почечных клубочков и нарушения канальцевой реабсорбции. Внепочечные заболевания: цистит, уретрит, простатит.
В норме через мембрану почечных клубочков фильтруются только белки с низкой молекулярной массой. Затем большая их часть реабсорбируется в канальцах почек. Таким образом, с мочой экскретируется столь малое количество белка, что при проведении скринингового исследования (например на полосках) белок в моче не определяется.
Таким образом, с мочой экскретируется столь малое количество белка, что при проведении скринингового исследования (например на полосках) белок в моче не определяется.
Как правило, сначала проводят качественный анализ, позволяющий выявить сам факт протеинурии. При положительном результате анализа применяют количественные методы исследования. Для проведения количественного анализа необходимо собрать суточную мочу. При необъяснимой протеинурии и продолжающейся протеинурии желательно провести электрофорез мочи. Электрофорез органического осадка мочи позволяет выделить в нем следующие фракции: белок Бенс-Джонса, гемоглобин, миоглобин и альбумин.
- Следует объяснить пациенту, что анализ позволяет выявить белок в моче.
- Каких-либо ограничений в диете и режиме питания не требуется.
- Пациенту сообщают, что для выполнения теста необходимо исследование суточной мочи или произвольной ее порции.
- Необходимо знать, принимает ли пациент препараты, которые могут повлиять на результат анализа (в некоторых случаях от их применения необходимо воздержаться).

ПРОЦЕДУРЫ
- Мочу собирают в специальный контейнер объемом на 3 литра в течение 24 ч, при этом первую (утреннюю в начальный момент сбора) порцию мочи сливают. Далее мочу собирают ровно за сутки.
- Отмечают общий объем мочи, выделенный за сутки.
- Часть мочи отливают в контейнер на 100 мл и отправляют в лабораторию.
- После сбора мочи пациент может возобновить прием препаратов.
- В норме экскреция белка с мочой в покое за сутки в среднем составляет 50-80 мг/сутки, не более 150 мг/сутки. При физической нагрузке не должна превышать 250 мг/сутки.
Протеинурия при беременности: определение, патофизиология, методология и клиническое значение
Качественное и количественное измерение экскреции белка с мочой — один из наиболее распространенных тестов, выполняемых во время беременности. Более 100 лет протеинурия была необходима для диагностики преэклампсии, но недавние руководства рекомендуют, чтобы протеинурия была достаточной, но не обязательной для диагностики. Тем не менее, в клинической практике у большинства пациентов с гестационной гипертензией диагностируется преэклампсия на основании протеинурии.Хотя эталонным стандартом для измерения экскреции белка с мочой является 24-часовой сбор мочи, точечное соотношение белок / креатинин в моче является разумным тестом для исключения протеинурии. Скрининг мочи на протеинурию не дает клинической пользы и не должен использоваться для диагностики протеинурии. Классическим пороговым значением для определения протеинурии во время беременности является значение> 300 мг / 24 часа или отношение протеина к креатинину в моче не менее 0,3. Используя это пороговое значение, частота изолированной протеинурии при беременности может достигать 8%, тогда как преэклампсия встречается от 3% до 8% беременностей.Хотя этот порог широко признан, его происхождение основано не на данных о неблагоприятных исходах беременности, а на мнении экспертов и результатах небольших исследований. После анализа доступных данных, наиболее важным фактором, влияющим на исходы у матери и новорожденного, является тяжесть артериального давления и наличие повреждения органов-мишеней, а не избыточная экскреция белка.
Тем не менее, в клинической практике у большинства пациентов с гестационной гипертензией диагностируется преэклампсия на основании протеинурии.Хотя эталонным стандартом для измерения экскреции белка с мочой является 24-часовой сбор мочи, точечное соотношение белок / креатинин в моче является разумным тестом для исключения протеинурии. Скрининг мочи на протеинурию не дает клинической пользы и не должен использоваться для диагностики протеинурии. Классическим пороговым значением для определения протеинурии во время беременности является значение> 300 мг / 24 часа или отношение протеина к креатинину в моче не менее 0,3. Используя это пороговое значение, частота изолированной протеинурии при беременности может достигать 8%, тогда как преэклампсия встречается от 3% до 8% беременностей.Хотя этот порог широко признан, его происхождение основано не на данных о неблагоприятных исходах беременности, а на мнении экспертов и результатах небольших исследований. После анализа доступных данных, наиболее важным фактором, влияющим на исходы у матери и новорожденного, является тяжесть артериального давления и наличие повреждения органов-мишеней, а не избыточная экскреция белка. Поскольку ведение гестационной гипертензии и преэклампсии без тяжелых симптомов практически идентично по частоте наблюдения и времени родов, разделение на 2 расстройства не требуется.Если тактика ведения женщин с гестационной гипертензией с положительной оценкой протеинурии не изменится, мы полагаем, что оценка мочи на протеинурию не нужна женщинам, у которых впервые появляется артериальное давление на или после 20 недель беременности. Кроме того, мы не рекомендуем повторное измерение протеинурии у женщин с преэклампсией, количество протеинурии, по-видимому, не связано с плохими исходами для матери и новорожденного, а мониторинг протеинурии может привести к невыявленным преждевременным родам и связанным с ними неонатальным осложнениям.Наш текущий диагноз преэклампсии у женщин с хроническим заболеванием почек может быть основан на изменении экскреции белка, исходная оценка экскреции белка имеет решающее значение при определенных состояниях, таких как хроническая гипертензия, диабет, аутоиммунные или другие почечные заболевания.
Поскольку ведение гестационной гипертензии и преэклампсии без тяжелых симптомов практически идентично по частоте наблюдения и времени родов, разделение на 2 расстройства не требуется.Если тактика ведения женщин с гестационной гипертензией с положительной оценкой протеинурии не изменится, мы полагаем, что оценка мочи на протеинурию не нужна женщинам, у которых впервые появляется артериальное давление на или после 20 недель беременности. Кроме того, мы не рекомендуем повторное измерение протеинурии у женщин с преэклампсией, количество протеинурии, по-видимому, не связано с плохими исходами для матери и новорожденного, а мониторинг протеинурии может привести к невыявленным преждевременным родам и связанным с ними неонатальным осложнениям.Наш текущий диагноз преэклампсии у женщин с хроническим заболеванием почек может быть основан на изменении экскреции белка, исходная оценка экскреции белка имеет решающее значение при определенных состояниях, таких как хроническая гипертензия, диабет, аутоиммунные или другие почечные заболевания. Текущее определение наложенной преэклампсии сталкивается с диагностической дилеммой, и неясно, отражает ли изменение исходной протеинурии другое системное заболевание, такое как преэклампсия, или женщины с хроническим заболеванием, таким как хроническая гипертензия или диабет, будут испытывать другой «нормальный» образец выведение белков при беременности.Наконец, имеются ограниченные данные об ангиогенных и других биомаркерах у женщин с хроническим заболеванием почек, которые могут помочь отличить исходное ухудшение хронической болезни почек и хронической гипертензии от наложенной преэклампсии.
Текущее определение наложенной преэклампсии сталкивается с диагностической дилеммой, и неясно, отражает ли изменение исходной протеинурии другое системное заболевание, такое как преэклампсия, или женщины с хроническим заболеванием, таким как хроническая гипертензия или диабет, будут испытывать другой «нормальный» образец выведение белков при беременности.Наконец, имеются ограниченные данные об ангиогенных и других биомаркерах у женщин с хроническим заболеванием почек, которые могут помочь отличить исходное ухудшение хронической болезни почек и хронической гипертензии от наложенной преэклампсии.
Ключевые слова:
24-часовой сбор мочи; биомаркер; хроническая гипертония; диагностика; гестационная гипертензия; гипертоническое расстройство беременности; подоциты; преэклампсия; беременность; исход беременности; прогноз; протеинурия; почечная недостаточность; наложенная преэклампсия; соотношение белка к креатинину в моче.
Клиническое значение протеинурии при беременности
Выведение белка с мочой считается ненормальным у беременных женщин, если оно превышает 300 мг / 24 часа в любое время во время беременности, уровень, который обычно коррелирует с 1+ на индикаторной полоске мочи. Протеинурия, задокументированная до беременности или до 20 недель беременности, предполагает наличие ранее существовавшего заболевания почек. Рабочая группа Национальной образовательной программы по высокому кровяному давлению рекомендовала, чтобы диагноз протеинурии основывался на 24-часовом сборе мочи.Преэклампсия — ведущий диагноз, который следует исключать у всех женщин с протеинурией, впервые выявленной после 20 недель беременности. Учитывая вазоспастический характер этого состояния, когда оно присутствует, степень протеинурии может сильно колебаться от часа к часу. Гипертония или протеинурия могут отсутствовать у 10-15% пациентов с HELLP-синдромом и у 38% пациентов с эклампсией. Острое начало протеинурии и ухудшение артериальной гипертензии у женщин с хронической артериальной гипертензией указывает на наложенную преэклампсию, которая увеличивает неблагоприятные исходы.Однако, поскольку протеинурия не является независимым предиктором неблагоприятного исхода, исключительный критерий протеинурии в качестве показания для преждевременных родов при преэклампсии не рекомендуется.
Острое начало протеинурии и ухудшение артериальной гипертензии у женщин с хронической артериальной гипертензией указывает на наложенную преэклампсию, которая увеличивает неблагоприятные исходы.Однако, поскольку протеинурия не является независимым предиктором неблагоприятного исхода, исключительный критерий протеинурии в качестве показания для преждевременных родов при преэклампсии не рекомендуется.
Целевая аудитория:
Акушеры и гинекологи, семейные врачи.
Цели обучения:
После завершения этой статьи читатель должен иметь возможность заявить, что измерение уровня белка в моче простыми методами не является чувствительным или специфическим, вспомнить, что как гипертензия, так и протеинурия могут отсутствовать у пациентов с преэклампсией, и объяснить, что протеинурия не является прогностическим фактором. неблагоприятные исходы, и это родоразрешение не должно основываться только на экскреции белка.
неблагоприятные исходы, и это родоразрешение не должно основываться только на экскреции белка.
Протеинурия при беременности — Обзор
Протеинурия — кардинальный признак поражения почек и фактор риска прогрессирования заболевания почек. Выведение белка с мочой увеличивается при нормальной беременности. В последних рекомендациях протеинурия больше не является обязательным диагностическим признаком преэклампсии. Поскольку большинство опубликованных данных основаны на протеинурии, являющейся требованием для диагностики преэклампсии, устранение протеинурии дает существенный объем доказательств, нуждающихся в пересмотре.Мы провели тщательный поиск в литературе, используя соответствующие термины Mesh. Большинство опубликованных данных указывают на благоприятный исход протеинурии во время беременности. Однако, за исключением некоторых отчетов о ретроспективных исследованиях, не существует убедительных доказательств того, что это применимо к отдаленным исходам почек. Поскольку известно, что артериальное давление падает в первом триместре беременности, повышение артериального давления от надира до текущего порогового значения 140/90 мм рт. Ст. Может рассматриваться как «нераспознанный продромальный период». Необходима дополнительная исследовательская работа для поиска более чувствительных инструментов для скрининга групп риска в геномной, протеомной, клинической и эпидемиологической областях.
Поскольку известно, что артериальное давление падает в первом триместре беременности, повышение артериального давления от надира до текущего порогового значения 140/90 мм рт. Ст. Может рассматриваться как «нераспознанный продромальный период». Необходима дополнительная исследовательская работа для поиска более чувствительных инструментов для скрининга групп риска в геномной, протеомной, клинической и эпидемиологической областях.
Протеинурия, беременность, преэклампсия, артериальная гипертензия
Протеинурия является признаком поражения почек и указывает на лиц, находящихся в группе риска обострения заболевания почек. Экскреция белка с мочой увеличивается при нормальной беременности с менее 150 мг / день у небеременных лиц до 300 мг / день во время беременности. Таким образом, порог аномальной экскреции белка для диагностики преэклампсии составляет более 300 мг / 24 часа или более 2+ при тестировании полосками в соответствии с рекомендациями Американского колледжа акушерства и гинекологии [1,2].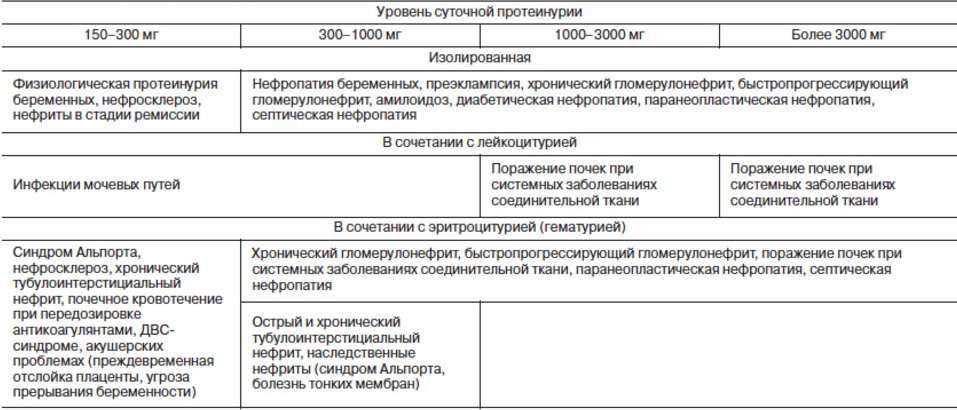 В предыдущих версиях рекомендаций протеинурия требовалась для диагностики преэклампсии. Согласно действующим руководствам, преэклампсия может быть диагностирована при отсутствии протеинурии, если присутствует гипертензия в сочетании с другим тяжелым признаком. Это изменение было вызвано двумя важными наблюдениями. Во-первых, тяжесть протеинурии не сильно связана с неблагоприятными исходами для матери и новорожденного. Во-вторых, преэклампсия иногда может возникать при отсутствии протеинурии: до 10% женщин с преэклампсией и 20% женщин с эклампсией не имеют протеинурии при первичном обращении [3,4].
В предыдущих версиях рекомендаций протеинурия требовалась для диагностики преэклампсии. Согласно действующим руководствам, преэклампсия может быть диагностирована при отсутствии протеинурии, если присутствует гипертензия в сочетании с другим тяжелым признаком. Это изменение было вызвано двумя важными наблюдениями. Во-первых, тяжесть протеинурии не сильно связана с неблагоприятными исходами для матери и новорожденного. Во-вторых, преэклампсия иногда может возникать при отсутствии протеинурии: до 10% женщин с преэклампсией и 20% женщин с эклампсией не имеют протеинурии при первичном обращении [3,4].
Американский колледж акушерства и гинекологии (ACOG) Целевая группа по гипертензии при беременности определяет протеинурию во время беременности как новое появление белка в моче в количествах, равных или превышающих 300 мг белка при 24-часовом сборе, соотношение белок / креатинин равно до или более 0,3 мг / мг, или +2 или более по результатам анализа мочи с помощью индикаторной полоски [1,2]
Протеинурия для диагностики преэклампсии
Традиционно для диагностики преэклампсии у женщины без ранее существовавшей гипертонии или протеинурии требовалось новое начало гипертонии и протеинурии после 20 недель беременности. В 2013 г. рабочая группа Американского колледжа акушеров и гинекологов по гипертонии во время беременности представила новые диагностические критерии преэклампсии [1], согласно которым преэклампсия может быть диагностирована при отсутствии протеинурии, если присутствуют другие признаки преэклампсии (Таблица 1).
В 2013 г. рабочая группа Американского колледжа акушеров и гинекологов по гипертонии во время беременности представила новые диагностические критерии преэклампсии [1], согласно которым преэклампсия может быть диагностирована при отсутствии протеинурии, если присутствуют другие признаки преэклампсии (Таблица 1).
Таблица 1. Американский колледж акушерства и гинекологии диагностические критерии преэклампсии.
Артериальное давление |
|
И: | |
Протеинурия |
|
Или, при отсутствии протеинурии, впервые возникшая гипертензия с одним из следующего: | |
Тромбоцитопения |
|
Почечная недостаточность |
|
Нарушение функции печени |
|
Отек легких | |
Церебральные или визуальные симптомы | |
* В последних рекомендациях 2019 г. [2] порог был увеличен до +2.
Гестационная гиперфильтрация
Во время нормальной беременности поток плазмы в почках увеличивается, что приводит к увеличению скорости клубочковой фильтрации (СКФ) более чем на 50% [5]. Это, в свою очередь, приводит к относительному снижению концентраций креатинина и мочевины в сыворотке вместе с увеличением экскреции белка [5]. Несмотря на то, что большинство опубликованных данных указывают на благоприятный исход протеинурии во время беременности, нет никаких доказательств того, что это применимо к отдаленному исходу со стороны почек.Устранение протеинурии как требование для диагностики преэклампсии в текущих рекомендациях в основном направлено на повышение чувствительности скрининга на преэклампсию с использованием только артериального давления. Гипертония является поздним следствием продолжающегося процесса (ов), который в конечном итоге приводит к повышению артериального давления. Данные о клинических проявлениях ранних изменений, предшествующих явной артериальной гипертензии, отсутствуют. Поскольку известно, что артериальное давление падает в течение первого триместра беременности, повышение артериального давления от надира до текущего порогового значения 140/90 мм рт.ст. может рассматриваться как «нераспознанный продромальный период».Необходима дополнительная исследовательская работа для поиска более чувствительных инструментов для скрининга групп риска в геномной, протеомной, клинической и эпидемиологической областях.
Несмотря на то, что большинство опубликованных данных указывают на благоприятный исход протеинурии во время беременности, нет никаких доказательств того, что это применимо к отдаленному исходу со стороны почек.Устранение протеинурии как требование для диагностики преэклампсии в текущих рекомендациях в основном направлено на повышение чувствительности скрининга на преэклампсию с использованием только артериального давления. Гипертония является поздним следствием продолжающегося процесса (ов), который в конечном итоге приводит к повышению артериального давления. Данные о клинических проявлениях ранних изменений, предшествующих явной артериальной гипертензии, отсутствуют. Поскольку известно, что артериальное давление падает в течение первого триместра беременности, повышение артериального давления от надира до текущего порогового значения 140/90 мм рт.ст. может рассматриваться как «нераспознанный продромальный период».Необходима дополнительная исследовательская работа для поиска более чувствительных инструментов для скрининга групп риска в геномной, протеомной, клинической и эпидемиологической областях.
В настоящее время используется несколько анализов для обнаружения протеинурии. Эти анализы различаются по точности, стоимости и простоте выполнения.
Уксусная кислота / сульфосалициловая кислота
Во многих странах развивающегося мира тест на тепловую коагуляцию белков мочи (тест на уксусную кислоту или тест на сульфосалициловую кислоту) обычно используется для выявления протеинурии во время беременности [6].Метод прост и включает нанесение нескольких капель разбавленной уксусной кислоты на 5 мл мочи в пробирке, а затем нагрев мочи до температуры ниже точки кипения. В зависимости от результирующего помутнения присутствие белка в моче количественно оценивается от 1+ до 4+. Преимущество этого теста в том, что он дешевле и позволяет обнаруживать другие белки, например Белок и парапротеины Бенс-Джонса, в то время как индикаторная полоска обнаруживает единственный белок. Тест на сульфосалициловую кислоту требует центрифугирования мочи с последующим добавлением 2. 5 мл супернатанта на 7,5 мл 3% сульфосалициловой кислоты. Степень помутнения определяется количественно, как в таблице 2 [7].
5 мл супернатанта на 7,5 мл 3% сульфосалициловой кислоты. Степень помутнения определяется количественно, как в таблице 2 [7].
Таблица 2. Количественное определение сульфосалициловой кислоты
Белок (мг / дл) | Степень мутности |
0 | Прозрачный |
1–10 | Опалесцентный |
15–30 | Может считывать отпечатки через трубку |
40–100 | Может читать только черные линии |
150–400 | Нет видимых черных линий |
> 500 | Флокулянт |
Щуп для измерения уровня мочи
Индикаторная полоска мочи — это широко используемый полуколичественный тест на протеинурию в месте оказания медицинской помощи. Как мы сообщали в нашей предыдущей работе, точность анализа мочи с помощью тест-полоски для прогнозирования значительной протеинурии во время беременности низкая на пороге 1+, с плохими положительными и отрицательными прогностическими значениями для значительной протеинурии [8]. Мы пришли к выводу, что точность теста с полосками может улучшиться при более высоких порогах (протеинурия более 1+) [8]. Текущие рекомендации 2019 г. подняли порог значительной протеинурии до 2+ [2].
Как мы сообщали в нашей предыдущей работе, точность анализа мочи с помощью тест-полоски для прогнозирования значительной протеинурии во время беременности низкая на пороге 1+, с плохими положительными и отрицательными прогностическими значениями для значительной протеинурии [8]. Мы пришли к выводу, что точность теста с полосками может улучшиться при более высоких порогах (протеинурия более 1+) [8]. Текущие рекомендации 2019 г. подняли порог значительной протеинурии до 2+ [2].
Круглосуточный сбор мочи
Золотым стандартом количественной оценки протеинурии является 24-часовой сбор белка в моче.В дополнение к количественному определению экскреции общего белка этот метод также позволяет рассчитать клиренс креатинина как оценку СКФ. Однако 24-часовой сбор мочи является обременительным для пациента и часто бывает неточным из-за чрезмерного или неполного сбора [9]. Таким образом, при интерпретации результатов 24-часового сбора мочи важно оценить полноту сбора: суточная экскреция креатинина с мочой должна составлять 15-20 мг креатинина / кг массы тела с учетом массы тела до беременности.![]()
Отношение белка к креатинину в моче (UPCR)
Отношение белка в моче к креатинину — относительно надежный, точный и простой метод количественной оценки протеинурии, который в значительной степени заменил 24-часовой сбор мочи у неакушерских групп населения. Имеющиеся данные позволяют предположить, что соотношение белок / креатинин в моче является точным для количественной оценки протеинурии во время беременности. Этот анализ стал предпочтительным методом количественной оценки протеинурии благодаря его точности, воспроизводимости и отсутствию необходимости в 24-часовом сборе мочи по времени.
Точность UPCR во время беременности была тщательно оценена [10]. Большинство исследований, оценивающих полезность UPCR при беременности, проводилось на женщинах с подозрением на преэклампсию. Эти исследования показали, что UPCR хорошо коррелирует с рассчитанным по времени 24-часовым выделением белка с мочой [11]. UPCR был признан действительным как для исходной, так и для последующей протеинурии [12]. Получить образец для UPCR просто, поскольку для этого требуется только образец чистого улова в середине потока, без необходимости катетеризации мочевого пузыря [13] или забора образцов по времени [14].
UPCR был признан действительным как для исходной, так и для последующей протеинурии [12]. Получить образец для UPCR просто, поскольку для этого требуется только образец чистого улова в середине потока, без необходимости катетеризации мочевого пузыря [13] или забора образцов по времени [14].
В дополнение к многочисленным исследованиям, оценивающим точность UPCR, было проведено три систематических обзора, которые пришли к такому же выводу [10,15,16]. В этих системных обзорах также оценивались различные пороговые значения UPCR. Из этой работы был сделан вывод, что UPCR> 0,7 мг белка / мг креатинина надежно предсказывает значительную протеинурию, а UPCR <0,15 мг белка / мг креатинина исключает значительную протеинурию. Таким образом, большинство официальных органов принимают точечный UPCR ≥ 0.26–0,3 мг белка / мг креатинина для диагностики преэклампсии [17,18].
Отношение альбумина к креатинину
Альтернативой UPCR является соотношение альбумина к креатинину в моче (UACR) [19]. UACR можно измерить с помощью автоматического анализатора, доступного в качестве теста на месте. Как и UPCR, UACR с отсечением от 20 до 60 мг альбумина / г креатинина точно предсказывает значительную протеинурию и примерно соответствует> 300 мг белка / день при 24-часовом сборе мочи [20,21].
UACR можно измерить с помощью автоматического анализатора, доступного в качестве теста на месте. Как и UPCR, UACR с отсечением от 20 до 60 мг альбумина / г креатинина точно предсказывает значительную протеинурию и примерно соответствует> 300 мг белка / день при 24-часовом сборе мочи [20,21].
Протеинурию при беременности можно разделить на четыре основных класса:
1-Изолированная протеинурия de novo
Протеинурия 2-De novo, ассоциированная с преэклампсией
3-Протеинурия, вторичная по отношению к хронической болезни почек
4-Транзиторная протеинурия, вызванная ИМП у беременных
Изолированная протеинурия de novo
Изолированная протеинурия определяется как появление новой протеинурии более 300 мг / г Cr в любой момент во время беременности при отсутствии гипертонии, ИМП, системных заболеваний или любых других очевидных причин. Гестационная протеинурия — это разновидность изолированной протеинурии, которая определяется как протеинурия, которая проявляется через 20 недель при отсутствии гипертонии [22]. Поскольку гестационная протеинурия часто прогрессирует до преэклампсии, это ретроспективный диагноз, который может быть поставлен только в послеродовом периоде, если преэклампсия не развивается.
Гестационная протеинурия — это разновидность изолированной протеинурии, которая определяется как протеинурия, которая проявляется через 20 недель при отсутствии гипертонии [22]. Поскольку гестационная протеинурия часто прогрессирует до преэклампсии, это ретроспективный диагноз, который может быть поставлен только в послеродовом периоде, если преэклампсия не развивается.
Неясно, что вызывает изолированную протеинурию при отсутствии гипертонии. Некоторые публикации связывают это с материнскими факторами, помимо тех, которые участвуют в патогенезе преэклампсии.Holston et al. Сообщили, что беременные женщины с изолированной протеинурией имеют высокий индекс массы тела и низкий уровень циркулирующих ангиогенных факторов, таких как фактор роста плаценты (PlGF) [23]. Некоторые авторы рассматривают изолированную протеинурию как часть спектра преэклампсии, в то время как другие рассматривают ее как отдельную патологию.
Изолированная протеинурия часто прогрессирует до преэклампсии [24]. Иногда эклампсия может возникать у пациентов с изолированной протеинурией без артериальной гипертензии [24,25].
Иногда эклампсия может возникать у пациентов с изолированной протеинурией без артериальной гипертензии [24,25].
К такому же выводу о значении протеинурии при отсутствии гипертензии пришли Yadama et al. [26] из многоцентрового отчета. Они заявили, что «у некоторых беременных женщин развивается значительная протеинурия при отсутствии гипертонии». Однако клиническое значение изолированной гестационной протеинурии (IGP) до конца не изучено. Kattah et al. [27] провели проспективное исследование с участием 142 женщин без протеинурии в анамнезе. Они сообщили, что изолированная протеинурия развивалась у 13% беременных с нормальным АД.Они обнаружили, что изолированная протеинурия связана с развитием гипертонии. Они пришли к выводу, что может быть другой механизм, который приводит к развитию изолированной протеинурии по сравнению с женщинами с преэклампсией. Akanksha S et al. [28] также сообщили о том же, что он цитировал, что около 50% женщин с изолированной протеинурией во время беременности развивают преэклампсию даже при отсутствии гипертонии [29].
Несмотря на то, что большинство опубликованных данных указывают на благоприятный исход протеинурии во время беременности [8,30], имеется мало данных о отдаленных исходах почек.Преэклампсия увеличивает риск сердечно-сосудистых заболеваний [31-34] и терминальной стадии болезни почек [35,36] в более позднем возрасте.
Протеинурия de novo, ассоциированная с преэклампсией
Гипертония при беременности определяется как артериальное давление выше 140 мм рт. Ст. Систолическое или диастолическое более 90 мм рт. Ст. [1]. Гипертонические расстройства беременности делятся на 4 группы; преэклампсия / эклампсия, хроническая гипертензия во время беременности, хроническая гипертензия с наложенной преэклампсией и гестационная гипертензия.Из них протеинурия характерна для всех, за исключением гестационной гипертензии (при которой протеинурия по определению отсутствует).
Текущие критерии ACOG для диагностики преэклампсии требуют повышенного артериального давления (≥ 140/90 мм рт. UPCR ≥ 0,3 мг / мг, или индикатор уровня белка в моче> 2+, если количественный анализ недоступен) или, при отсутствии протеинурии, высокое кровяное давление плюс другой серьезный признак: почечная недостаточность, низкий уровень тромбоцитов, нарушение функции печени, отек легких , церебральные или зрительные симптомы [1,37] (Таблица 1).
UPCR ≥ 0,3 мг / мг, или индикатор уровня белка в моче> 2+, если количественный анализ недоступен) или, при отсутствии протеинурии, высокое кровяное давление плюс другой серьезный признак: почечная недостаточность, низкий уровень тромбоцитов, нарушение функции печени, отек легких , церебральные или зрительные симптомы [1,37] (Таблица 1).
Высокое кровяное давление, зарегистрированное до 20 недель беременности, вероятно, связано с хронической гипертензией. Хроническая гипертензия может осложняться наложенной преэклампсией. Диагностика наложенной преэклампсии часто является сложной задачей, но общие признаки включают новую или ухудшающуюся протеинурию, усиление артериальной гипертензии или развитие тяжелых признаков преэклампсии (Таблица 1).
Гестационная гипертензия определяется как новое начало гипертензии без протеинурии (или других диагностических признаков преэклампсии) после 20 недель беременности.Гестационная гипертензия обычно проходит в течение 12 недель после родов [38]. Как и изолированная гестационная протеинурия, гестационная гипертензия может быть предвестником преэклампсии.
Как и изолированная гестационная протеинурия, гестационная гипертензия может быть предвестником преэклампсии.
Следует отметить, что определение гипертонии во время беременности (систолическое АД> 140 мм рт. Ст. Или диастолическое АД> 90 мм рт. Ст.) Не основано на доказательствах. Артериальное давление обычно падает на 10-15 мм рт. Ст. На ранних сроках беременности [39]. Таким образом, порог определения гипертонии при беременности, вероятно, должен быть ниже порога у небеременных людей.Таким образом, определение гипертонии как АД> 140/90 мм рт. Ст. Не способствует раннему выявлению гипертонических расстройств во время беременности.
Хроническая протеинурия у беременных с основным заболеванием почек
Протеинурия во время беременности может быть вызвана состояниями, не связанными с преэклампсией, такими как существующая ранее или de novo гломерулярная или тубулоинтерстициальная болезнь почек. Когда протеинурия документируется на ранних сроках беременности (до 20 недель), это называется хронической протеинурией и обычно возникает из-за основного заболевания почек.Когда протеинурия впервые регистрируется поздно (после 20 недель), это обычно связано с протеинурией гестации или преэклампсией.
Когда протеинурия документируется на ранних сроках беременности (до 20 недель), это называется хронической протеинурией и обычно возникает из-за основного заболевания почек.Когда протеинурия впервые регистрируется поздно (после 20 недель), это обычно связано с протеинурией гестации или преэклампсией.
Одно исследование включало две серии беременных пациенток, перенесших чрескожную биопсию почек в антенатальном или послеродовом периоде. У этих женщин было заболевание почек, проявившееся во время беременности, при этом биопсия почек проводилась во время или сразу после беременности [40]. Гломерулярное расстройство было обнаружено у 95% (19/20) беременных, которым была сделана биопсия во время беременности.В послеродовой биопсии у 82,6% женщин (62/75) была выявлена значительная протеинурия (40% преэклампсия) во время беременности, не разрешившаяся в послеродовой период. Гломерулярная аномалия обнаружена у 64%. Долгосрочное наблюдение за 47 женщинами в среднем 51,5 месяца показало, что у 29,7% (14 женщин) сохраняется значительная протеинурия, у 42,6% (20 женщин) СКФ <60 мл / мин / 1,73 м 2 и 12,7 % (6 женщин) достигли терминальной стадии почечной недостаточности (ESKD) [40].
Сахарный диабет 1 или 2 типа (СД 1 или 2) является частой причиной протеинурии.У беременных диабетиков и гипертоников может быть хроническая протеинурия. У женщин с СД 1 или 2 в детородном возрасте может развиться заболевание почек. СД 1 и 2 имеют почти одинаковую распространенность умеренно повышенной альбуминурии и диабетической нефропатии у беременных с сахарным диабетом 1 и 2 типа [41]. Альбуминурия у женщин с СД 1 или 2 также может быть вызвана гломерулярным заболеванием, отличным от диабетической нефропатии. Альбуминурия, которая сохраняется более 3 месяцев, считается хронической болезнью почек (ХБП) [42].
Протеинурия при беременности также может быть вторичной по отношению к хронической гипертонии. Ведение женщин с уже существовавшей хронической гипертензией во время беременности отличается от ведения женщин с острыми гипертензивными синдромами во время беременности, поскольку женщины с хронической артериальной гипертензией будут подвергаться тщательному пренатальному мониторингу [43]. В идеале женщин с хронической гипертонией следует обследовать до беременности, уделяя особое внимание наличию повреждений органов-мишеней, доказательствам вторичных причин гипертонии, корректировке лекарств и консультированию относительно риска преэклампсии и неблагоприятных событий для плода во время беременности [43].
В идеале женщин с хронической гипертонией следует обследовать до беременности, уделяя особое внимание наличию повреждений органов-мишеней, доказательствам вторичных причин гипертонии, корректировке лекарств и консультированию относительно риска преэклампсии и неблагоприятных событий для плода во время беременности [43].
Различие между вторичной гипертензией и высоким кровяным давлением, вызванным синдромом преэклампсии: Во время нормальной беременности происходит несколько уникальных физиологических изменений [44]. Почки увеличиваются в размерах и собирающая система расширяется, ренин-ангиотензин-альдостероновая система (РААС) активируется без гипертензии, а почка гиперфильтрируется без долгосрочных последствий [44]. Наблюдается легкая гипонатриемия и респираторный алкалоз [44].Повышение регуляции (РААС) начинается во время лютеиновой фазы менструального цикла и продолжает расти после оплодотворения вместе с параллельным повышением уровней эстрогена и прогестерона [45]. Уровни ренина могут увеличиваться до восьми раз, ангиотензина — до четырех, а альдостерона — от десяти до двадцати раз от нормального уровня [45]. К нефрологу можно обратиться, если у беременных развивается острое повреждение почек (AKI), гломерулонефрит GN, рефрактерная гипертензия, снижение расчетной скорости клубочковой фильтрации (eGFR), протеинурия или иногда микроангиопатия [46].Крайне важно, но очень сложно отличить высокое кровяное давление, вызванное синдромом преэклампсии, от других причин вторичной гипертензии, например артериальная гипертензия, вторичная по отношению к стенозу почечной артерии. Биохимические параметры, которые обычно используются для дифференциации вторичной гипертензии, а именно стимулированный РААС с высоким содержанием ренина, также высоки из-за беременности как таковой. Несмотря на стимуляцию РААС, у большинства беременных не развивается гипертензия. Предполагается, что это происходит из-за сосудорасширяющего эффекта эстрогена и / или прогестерона и релаксина, секретируемого яичниками гестационного гормона [47].
Уровни ренина могут увеличиваться до восьми раз, ангиотензина — до четырех, а альдостерона — от десяти до двадцати раз от нормального уровня [45]. К нефрологу можно обратиться, если у беременных развивается острое повреждение почек (AKI), гломерулонефрит GN, рефрактерная гипертензия, снижение расчетной скорости клубочковой фильтрации (eGFR), протеинурия или иногда микроангиопатия [46].Крайне важно, но очень сложно отличить высокое кровяное давление, вызванное синдромом преэклампсии, от других причин вторичной гипертензии, например артериальная гипертензия, вторичная по отношению к стенозу почечной артерии. Биохимические параметры, которые обычно используются для дифференциации вторичной гипертензии, а именно стимулированный РААС с высоким содержанием ренина, также высоки из-за беременности как таковой. Несмотря на стимуляцию РААС, у большинства беременных не развивается гипертензия. Предполагается, что это происходит из-за сосудорасширяющего эффекта эстрогена и / или прогестерона и релаксина, секретируемого яичниками гестационного гормона [47]. Сообщалось, что эта гормонально-опосредованная системная вазодилатация снижает систолическое артериальное давление примерно на 10-15 мм рт. Ст. Во время беременности [48]. Гемодинамические изменения, вызванные этой глобальной вазодилатацией, затрагивают почки и приводят к снижению сопротивления сосудов почек, что приводит к раннему увеличению СКФ примерно на 25-50%. Предполагается, что результирующее состояние гиперфильтрации вызывает увеличение экскреции белка при нормальной беременности [8] без долгосрочных последствий, в отличие от того, что мы наблюдаем при других состояниях гиперфильтрации, таких как сахарный диабет, единственная почка и почки у пациентов с высоким ИМТ [8, 49].
Сообщалось, что эта гормонально-опосредованная системная вазодилатация снижает систолическое артериальное давление примерно на 10-15 мм рт. Ст. Во время беременности [48]. Гемодинамические изменения, вызванные этой глобальной вазодилатацией, затрагивают почки и приводят к снижению сопротивления сосудов почек, что приводит к раннему увеличению СКФ примерно на 25-50%. Предполагается, что результирующее состояние гиперфильтрации вызывает увеличение экскреции белка при нормальной беременности [8] без долгосрочных последствий, в отличие от того, что мы наблюдаем при других состояниях гиперфильтрации, таких как сахарный диабет, единственная почка и почки у пациентов с высоким ИМТ [8, 49].
Все больше женщин вступают в беременность с уже существовавшей гипертонией и имеют факторы риска эссенциальной гипертензии, такие как ожирение, расовая принадлежность и преклонный возраст матери [44]. Примерно у 25% этих пациентов может развиться синдром наложенной преэклампсии [8,44]. В этой относительно молодой популяции эссенциальная гипертензия с меньшей вероятностью прожила достаточно долго, чтобы вызвать повреждение органов-мишеней. В таких обстоятельствах развитие протеинурии de novo потенциально может указывать на начало перекрывающегося синдрома преэклампсии [44].
В этой относительно молодой популяции эссенциальная гипертензия с меньшей вероятностью прожила достаточно долго, чтобы вызвать повреждение органов-мишеней. В таких обстоятельствах развитие протеинурии de novo потенциально может указывать на начало перекрывающегося синдрома преэклампсии [44].
Протеинурия также может возникать у беременных, перенесших трансплантацию почки. Терминальная стадия почечной недостаточности нарушает нормальную функцию гонад и делает беременность относительно редкой [50]. Однако после успешной трансплантации почки фертильность улучшается в течение нескольких месяцев [51]. В случае зачатия после трансплантации влияние заболевания почек на исход беременности зависит от степени почечной дисфункции, предшествующей гипертензии и степени протеинурии [52].Беременные женщины с гипертонической болезнью, перенесшие трансплантацию почки, подвергаются повышенному риску наложенной преэклампсии. Заболеваемость колеблется от 15 до 25% по сравнению с 5% нормальных беременностей [53].
Протеинурия, осложняющая ИМП у беременных
Инфекция мочевыводящих путей (ИМП) часто встречается во время беременности из-за застоя мочи и расширения мочевыводящих путей [54]. Инфекция мочевыводящих путей может вызывать преходящую протеинурию, и ее следует исключить, прежде чем связывать протеинурию во время беременности с другой причиной, например, с хронической болезнью почек или преэклампсией [55].Cote et al. Сообщили, что ИМП могут вызывать временное повышение экскреции белка (выше 30 мг / ммоль), поэтому его следует исключить [10]. Некоторые недавние данные предполагают связь между ИМП и преэклампсией [56]. Однако к этим данным следует относиться с осторожностью.
В настоящее время Профилактическая рабочая группа США рекомендует проводить скрининг на преэклампсию у беременных с измерением артериального давления на протяжении всей беременности. Согласно действующим руководствам, преэклампсия может быть диагностирована при отсутствии протеинурии, что вызывает опасения по поводу достоверности имеющейся литературы, которая в значительной степени основана на протеинурии, являющейся обязательным признаком диагноза преэклампсии.
Несмотря на то, что большинство опубликованных данных указывают на благоприятный исход протеинурии во время беременности, нет никаких доказательств того, что это относится к отдаленным исходам почек, в то время как накапливаются данные о том, что преэклампсия увеличивает риск сердечно-сосудистых заболеваний.
Гипертония может быть поздним следствием продолжающейся патологии, которая в конечном итоге приводит к повышению артериального давления. Данные о клинических проявлениях ранних изменений, предшествующих явной артериальной гипертензии, отсутствуют.
Артериальное давление падает ниже нормальных значений в первом триместре. Также неясно, какое значение артериального давления для беременных является нормальным. Необходимы дополнительные исследования для определения норм для беременных женщин и разработки чувствительных инструментов скрининга для групп риска.
- [Авторы не указаны] (2019) Практический бюллетень ACOG No.
 202: Гестационная гипертензия и преэклампсия. Акушерский гинекол 133: e1-1e25. [Crossref]
202: Гестационная гипертензия и преэклампсия. Акушерский гинекол 133: e1-1e25. [Crossref] - Thornton CE, Makris A, Ogle RF, Tooher JM, Hennessy A (2010) Роль протеинурии в определении преэклампсии: клинические результаты для женщин и младенцев. Clin Exp Pharmacol Physiol 37: 466-470. [Crossref]
- Сибай Б.М. (1990) Эклампсия. VI. Материнско-перинатальный исход в 254 последовательных случаях. Am J Obstet Gynecol 163: 1049-1054.[Crossref]
- Williams D, Davison J (2008) Хроническая болезнь почек во время беременности. BMJ 336: 211-215. [Crossref]
- Диссанаяке В.Х., Морган Л., Бротон Пипкин Ф., Ватанан В., Премаратне С. и др. (2004) Тест на тепловую коагуляцию белка в моче — полезный скрининговый тест на протеинурию во время беременности в развивающихся странах: исследование для валидации метода. BJOG 111: 491-494.
 [Crossref]
[Crossref] - Fine LG, Salehmoghaddam S (1990) Протеинурия.В: Walker HK, Hall WD, Hurst JW, редакторы. Клинические методы: история, физикальные и лабораторные исследования. 3-е издание. Бостон: Баттервортс, Глава 192.
- Осман О., Бакаре А.О., Эламин С. (2011) Распространенность протеинурии среди беременных женщин, выявленная полуколичественным методом: опыт одного центра. Arab J Nephrol Transplant 4: 77-82. [Crossref]
- Côté AM, Firoz T., Mattman A, Lam EM, von Dadelszen P, et al.(2008) 24-часовой сбор мочи: золотой стандарт или историческая практика? Am J Obstet Gynecol 199: 625. [Crossref]
- Côté AM, Brown MA, Lam E, von Dadelszen P, Firoz T, et al. (2008) Диагностическая точность соотношения белок пятен мочи: креатинин для протеинурии у беременных с гипертонической болезнью: систематический обзор. BMJ 336: 1003-1006. [Crossref]
- Роберт М.
 , Сепандж Ф, Листон Р.М., Дули К.С. (1997) Случайное соотношение протеина и креатинина для количественного определения протеинурии во время беременности. Акушерский гинекол 90: 893-895. [Crossref]
, Сепандж Ф, Листон Р.М., Дули К.С. (1997) Случайное соотношение протеина и креатинина для количественного определения протеинурии во время беременности. Акушерский гинекол 90: 893-895. [Crossref] - Neithardt AB, Dooley SL, Borensztajn J (2002) Прогнозирование 24-часовой экскреции белка во время беременности с одним соотношением белка к креатинину в моче. Am J Obstet Gynecol 186: 883-886. [Crossref]
- Hirshberg A, Draper J, Curley C, Sammel MD, Schwartz N (2014) Случайное соотношение протеина и креатинина точно предсказывает исходную протеинурию на ранних сроках беременности. J Matern Fetal Neonatal Med 27: 1834-1838.[Crossref]
- Chen BA, Parviainen K, Jeyabalan A (2008) Корреляция соотношений белков / креатинина катетеризованной мочи и чистой уловленной мочи при оценке преэклампсии. Акушерский гинекол 112: 606-610. [Crossref]
- Verdonk K, Niemeijer IC, Hop WC, de Rijke YB, Steegers EA, et al.
 (2014) Изменение соотношения белка в моче и креатинина в течение дня у женщин с подозрением на преэклампсию. BJOG 121: 1660-1665. [Crossref]
(2014) Изменение соотношения белка в моче и креатинина в течение дня у женщин с подозрением на преэклампсию. BJOG 121: 1660-1665. [Crossref] - Papanna R, Mann LK, Kouides RW, Glantz JC (2008) Соотношение белок / креатинин при преэклампсии: систематический обзор. Obstet Gynecol 112: 135-144. [Crossref]
- Morris RK, Riley RD, Doug M, Deeks JJ, Kilby MD (2012) Диагностическая точность точечных соотношений белка в моче и альбумина к креатинину для выявления значительной протеинурии или неблагоприятного исхода беременности у пациентов с подозрением на преэклампсию: систематический обзор и мета -анализ. BMJ 345: e4342. [Crossref]
- Visintin C, Mugglestone MA, Almerie MQ, Nherera LM, Джеймс Д. и др.(2010) Ведение гипертонических расстройств во время беременности: краткое изложение рекомендаций NICE. BMJ 341: c2207. [Crossref]
- Gillon TE, Pels A, von Dadelszen P, MacDonell K, Magee LA (2014) Гипертонические расстройства во время беременности: систематический обзор международных руководств по клинической практике.
 PLoS One 9: e113715. [Crossref]
PLoS One 9: e113715. [Crossref] - Nisell H, Trygg M, Bäck R (2006) Соотношение альбумин / креатинин в моче для оценки альбуминурии при гипертонии при беременности. Acta Obstet Gynecol Scand 85: 1327-1330. [Crossref]
- Gao YF, Huang QT, Zhong M, Wang Y, Wang W и др. (2012) Диагностическая ценность отношения альбуминурии радомного пятна к креатинину у женщин с преэклампсией. Чжунхуа Фу Чан Кэ За Чжи 47: 166-70. Китайский язык. [Crossref]
- Gangaram R, Naicker M, Moodley J (2009) Сравнение исходов беременности у женщин с гипертоническими расстройствами беременности с использованием суточного белка в моче и соотношения микроальбумина в моче и креатинина. Int J Gynecol Obstet 107: 19-22. [Crossref]
- Keizer S (2018) Гестационная протеинурия. https://hsc.ghs.org/obgyn-clinical-practice-guidelines/outpatient/gestational-proteinuria/, дата обращения 07.
 04.2019.
04.2019. - Holston AM, Qian C, Yu KF, Epstein FH, Karumanchi SA и др. (2009) Циркулирующие ангиогенные факторы при гестационной протеинурии без гипертонии. Am J Obstet Gynecol 200: 392.e1-10. [Crossref]
- Морикава М., Ямада Т., Минаками Х. (2009) Исход беременности у пациенток с изолированной протеинурией. Curr Opin Obstet Gynecol 21: 491-495. [Crossref]
- Морикава М., Ямада Т., Ямада Т., Чо К., Ямада Х. и др. (2008) Исход беременности у женщин, у которых после середины гестации развилась протеинурия в отсутствие гипертонии. J Perinat Med 36: 419-424. [Crossref]
- Ямада Т., Обата-Ясуока М., Хамада Х., Баба Ю., Окути А. и др. (2016) Изолированная гестационная протеинурия, предшествующая диагностике преэклампсии — обсервационное исследование. Acta ObstetGynecol Scand 95: 1048-1054. [Crossref]
- Андреа Каттах, Наташа Милич, Венди Уайт и Весна Гарович (2017) Точечные измерения белка в моче при нормальных беременностях, беременностях с изолированной протеинурией и преэклампсией.
 Am J Physiol Regul Integr Comp Physiol 313: R418-R424. [Crossref]
Am J Physiol Regul Integr Comp Physiol 313: R418-R424. [Crossref] - Аканкша С., Стефи М. (2017) Аудит управления гестационной протеинурией [25L]. Акушерский гинекол 129: S128.
- Gongora MC, Венгер Н.К. (2015) Сердечно-сосудистые осложнения беременности. Int J Mol Sci 16: 23905-23928.
- Behrens I, Basit S, Lykke JA, Ranthe MF, Wohlfahrt J, et al. (2016) Ассоциация между гипертоническими расстройствами при беременности и последующим риском кардиомиопатии. JAMA 315: 1026-1033. [Crossref]
- Brown MC, Best KE, Pearce MS, Waugh J, Robson SC и др. (2013) Риск сердечно-сосудистых заболеваний у женщин с преэклампсией: систематический обзор и метаанализ. Eur J Epidemiol 28: 1-19. [Crossref]
- McDonald SD, Malinowski A, Zhou Q, Yusuf S, Devereaux PJ (2008) Сердечно-сосудистые последствия преэклампсии / эклампсии: систематический обзор и метаанализы.
 Am Heart J 156: 918-930. [Crossref]
Am Heart J 156: 918-930. [Crossref] - Vikse BE, Irgens LM, Leivestad T, Skjaerven R, Iversen BM (2008) Преэклампсия и риск терминальной стадии почечной недостаточности. N Engl J Med 359: 800-809. [Crossref]
- Ван И.К., Муо С.Х., Чанг Ю.С. и др.(2013) Связь между гипертоническими расстройствами во время беременности и терминальной стадией почечной недостаточности: популяционное исследование. CMAJ 185: 207-213. [Crossref]
- Kattah AG, Scantlebury DC, Agarwal S, Mielke MM, Rocca WA и др. (2017) Преэклампсия и ТПН: роль общих факторов риска. Am J Kidney Dis 69: 498-505. [Crossref]
- Скрининг преэклампсии: заявление о рекомендации. Ам Фам Врач .[Crossref]
- Акушерство Уильямса (2014) 24 th edn, McGraw-Hill Professional. ISBN 9780071798938.
- Scantlebury DC, Schwartz GL, Acquah LA, White WM, Moser M и др.
 (2013) Лечение гипертонии во время беременности: когда следует начинать прием препаратов от артериального давления? Curr Cardiol Rep 15: 412. [Crossref]
(2013) Лечение гипертонии во время беременности: когда следует начинать прием препаратов от артериального давления? Curr Cardiol Rep 15: 412. [Crossref] - День C, Хьюинс П., Хильдебранд С., Шейх Л., Тейлор Г. и др.(2008) Роль биопсии почек у женщин с заболеванием почек, выявленным во время беременности. Циферблат нефрола для трансплантации 23: 201-206. [Crossref]
- Damm JA, Asbjörnsdóttir B, Callesen NF, Mathiesen JM, Lingholm L, et al. (2013) Диабетическая нефропатия и микроальбуминурия у беременных с диабетом 1 и 2 типа: распространенность, антигипертензивная стратегия и исход беременности. Уход за диабетом 36: 3489-3494. [Crossref]
- Рекомендации KDIGO посвящены темам, связанным с профилактикой или лечением людей с заболеваниями почек.http://kdigo.org/home/guidelines/.
- Каттах А.Г., Гарович В.Д. (2013) Ведение гипертонии во время беременности.
 Adv Chronic Kidney Dis 20: 229-239. [Crossref]
Adv Chronic Kidney Dis 20: 229-239. [Crossref] - Berry C, Atta MG (2016) Гипертонические расстройства во время беременности. World J Nephrol 5: 418-428. [Crossref]
- O’Donnell E, Floras JS, Harvey PJ (2014) Статус эстрогена и ренин-ангиотензин-альдостероновая система. Am J Physiol Regul Integr Comp Physiol 307: R498-R500. [Crossref]
- Чидамбарам М., Дункан Дж. А., Лай В. С., Каттран, округ Колумбия, Флорас Дж. С. и др. (2002) Изменения в системе ренин-ангиотензин на протяжении нормального менструального цикла. J Am SocNephrol 13: 446-452. [Crossref]
- August P (2013) Преэклампсия: нефроцентрический взгляд. Adv Chronic Kidney Dis 20: 280-286. [Crossref]
- Конрад К.П. (2011) Возникающая роль релаксина в адаптации матери к нормальной беременности: последствия для преэклампсии.
 Семин Нефрол 31: 5-32. [Crossref]
Семин Нефрол 31: 5-32. [Crossref] - Scantlebury DC, Schwartz GL, Acquah LA, White WM, Moser M и др. (2013) Лечение гипертонии во время беременности: когда следует начинать прием препаратов от артериального давления? Curr Cardiol Rep 15: 412. [Crossref]
- Piccoli GB, Attini R, Vigotti FN, Parisi S, Fassio F и др. (2015) Защищает ли почечная гиперфильтрация при беременности 1-й стадии хронической болезни почек? Шаг вперед к разгадке тайны влияния хронической болезни почек 1 стадии на исход беременности. Нефрология (Карлтон) 20: 201-208. [Crossref]
- Reddy SS, Holley JL (2007) Ведение беременной пациентки на хроническом диализе. Adv Chronic Kidney Dis 14: 146-155. [Crossref]
- Дэвисон Дж. М. (1991) Диализ, трансплантация и беременность. Am J Kidney Dis 17: 127-132. [Crossref]
- Fischer MJ (2007) Хроническая болезнь почек и беременность: исходы для матери и плода.
 Adv Chronic Kidney Dis 14: 132-145. [Crossref]
Adv Chronic Kidney Dis 14: 132-145. [Crossref] - Подымов Т., Август П. (2007) Гипертония во время беременности. Adv Хроническая почка Dis 14: 178-190. [Crossref]
- Piccoli GB, Attini R, Parisi S, Vigotti FN, Daidola G, et al. (2013) Чрезмерное расширение мочевыводящих путей и протеинурия во время беременности: частая и упускаемая из виду ассоциация ?. BMC Nephrol 14: 52. [Crossref]
- Руководство по клинической практике доступно по адресу https: // hsc.ghs.org/obgyn-clinical-practice-%20guidelines/outpatient/gestational-proteinuria/, по состоянию на 07.05.2019.
- Yan L, Jin Y, Hang H, Yan B (2018) Связь между инфекцией мочевыводящих путей во время беременности и преэклампсией: метаанализ. Медицина (Балтимор) 97: e12192. [Crossref]
Протеинурия во время беременности: определение, патофизиология, методология и клиническое значение
Качественное и количественное измерение экскреции белка с мочой — один из наиболее распространенных тестов, выполняемых во время беременности. Более 100 лет протеинурия была необходима для диагностики преэклампсии, но недавние руководства рекомендуют, чтобы протеинурия была достаточной, но не обязательной для диагностики. Тем не менее, в клинической практике у большинства пациентов с гестационной гипертензией диагностируется преэклампсия на основании протеинурии. Хотя эталонным стандартом для измерения экскреции белка с мочой является 24-часовой сбор мочи, точечное соотношение белок / креатинин в моче является разумным тестом для исключения протеинурии.Скрининг мочи на протеинурию не дает клинической пользы и не должен использоваться для диагностики протеинурии. Классическим пороговым значением для определения протеинурии во время беременности является значение> 300 мг / 24 часа или отношение протеина к креатинину в моче не менее 0,3. Используя это пороговое значение, частота изолированной протеинурии при беременности может достигать 8%, тогда как преэклампсия встречается от 3% до 8% беременностей. Хотя этот порог широко признан, его происхождение основано не на данных о неблагоприятных исходах беременности, а на мнении экспертов и результатах небольших исследований.
Более 100 лет протеинурия была необходима для диагностики преэклампсии, но недавние руководства рекомендуют, чтобы протеинурия была достаточной, но не обязательной для диагностики. Тем не менее, в клинической практике у большинства пациентов с гестационной гипертензией диагностируется преэклампсия на основании протеинурии. Хотя эталонным стандартом для измерения экскреции белка с мочой является 24-часовой сбор мочи, точечное соотношение белок / креатинин в моче является разумным тестом для исключения протеинурии.Скрининг мочи на протеинурию не дает клинической пользы и не должен использоваться для диагностики протеинурии. Классическим пороговым значением для определения протеинурии во время беременности является значение> 300 мг / 24 часа или отношение протеина к креатинину в моче не менее 0,3. Используя это пороговое значение, частота изолированной протеинурии при беременности может достигать 8%, тогда как преэклампсия встречается от 3% до 8% беременностей. Хотя этот порог широко признан, его происхождение основано не на данных о неблагоприятных исходах беременности, а на мнении экспертов и результатах небольших исследований. После анализа доступных данных, наиболее важным фактором, влияющим на исходы у матери и новорожденного, является тяжесть артериального давления и наличие повреждения органов-мишеней, а не избыточная экскреция белка. Поскольку ведение гестационной гипертензии и преэклампсии без тяжелых симптомов практически идентично по частоте наблюдения и времени родов, разделение на 2 расстройства не требуется. Если лечение женщин с гестационной гипертензией с положительной оценкой протеинурии не изменится, мы полагаем, что оценка мочи на протеинурию не нужна женщинам, у которых впервые появляется артериальное давление на или после 20 недель беременности.Кроме того, мы не рекомендуем повторное измерение протеинурии у женщин с преэклампсией, количество протеинурии, по-видимому, не связано с плохими исходами для матери и новорожденного, а мониторинг протеинурии может привести к невыявленным преждевременным родам и связанным с ними неонатальным осложнениям. Наш текущий диагноз преэклампсии у женщин с хроническим заболеванием почек может быть основан на изменении экскреции белка, исходная оценка экскреции белка имеет решающее значение при определенных состояниях, таких как хроническая гипертензия, диабет, аутоиммунные или другие почечные заболевания.
После анализа доступных данных, наиболее важным фактором, влияющим на исходы у матери и новорожденного, является тяжесть артериального давления и наличие повреждения органов-мишеней, а не избыточная экскреция белка. Поскольку ведение гестационной гипертензии и преэклампсии без тяжелых симптомов практически идентично по частоте наблюдения и времени родов, разделение на 2 расстройства не требуется. Если лечение женщин с гестационной гипертензией с положительной оценкой протеинурии не изменится, мы полагаем, что оценка мочи на протеинурию не нужна женщинам, у которых впервые появляется артериальное давление на или после 20 недель беременности.Кроме того, мы не рекомендуем повторное измерение протеинурии у женщин с преэклампсией, количество протеинурии, по-видимому, не связано с плохими исходами для матери и новорожденного, а мониторинг протеинурии может привести к невыявленным преждевременным родам и связанным с ними неонатальным осложнениям. Наш текущий диагноз преэклампсии у женщин с хроническим заболеванием почек может быть основан на изменении экскреции белка, исходная оценка экскреции белка имеет решающее значение при определенных состояниях, таких как хроническая гипертензия, диабет, аутоиммунные или другие почечные заболевания. Текущее определение наложенной преэклампсии сталкивается с диагностической дилеммой, и неясно, отражает ли изменение исходной протеинурии другое системное заболевание, такое как преэклампсия, или женщины с хроническим заболеванием, таким как хроническая гипертензия или диабет, будут испытывать иную «нормальную» картину. выведение белков при беременности. Наконец, имеются ограниченные данные об ангиогенных и других биомаркерах у женщин с хроническим заболеванием почек, которые могут помочь отличить исходное ухудшение хронической болезни почек и хронической гипертензии от наложенной преэклампсии.
Текущее определение наложенной преэклампсии сталкивается с диагностической дилеммой, и неясно, отражает ли изменение исходной протеинурии другое системное заболевание, такое как преэклампсия, или женщины с хроническим заболеванием, таким как хроническая гипертензия или диабет, будут испытывать иную «нормальную» картину. выведение белков при беременности. Наконец, имеются ограниченные данные об ангиогенных и других биомаркерах у женщин с хроническим заболеванием почек, которые могут помочь отличить исходное ухудшение хронической болезни почек и хронической гипертензии от наложенной преэклампсии.
Беременность и почки | Американское общество нефрологов
При распознавании почечной недостаточности измерение функции почек и протеинурия являются первыми стандартными носителями субклинической патологии. В связи с резкими гормональными и гемодинамическими изменениями во время беременности функция почек изменяется, и эти изменения необходимо учитывать при оценке функции почек во время беременности и при выборе лекарств, принимаемых во время родов. Почечная функция и фильтрация также страдают при преэклампсии, и недавние достижения значительно расширили наше понимание патофизиологических механизмов этого специфического для беременных почечного синдрома.
Почечная функция и фильтрация также страдают при преэклампсии, и недавние достижения значительно расширили наше понимание патофизиологических механизмов этого специфического для беременных почечного синдрома.
ОЦЕНКА СКФ И ПРОТЕИНУРИИ ВО ВРЕМЯ БЕРЕМЕННОСТИ
Оценка СКФ при беременности
Физиологическое увеличение СКФ во время беременности обычно приводит к снижению концентрации креатинина в сыворотке, которая падает в среднем на 0,4 мг / дл до диапазона беременных. От 0,4 до 0,8 мг / дл. 1 Следовательно, сывороточный креатинин 1,0 мг / дл, хотя и является нормальным для небеременных людей, отражает почечную недостаточность у беременной женщины. Формула модификации диеты при почечной недостаточности (MDRD), которая оценивает СКФ с использованием комбинации сывороточных маркеров и клинических параметров, стала стандартным клиническим методом оценки функции почек у пациентов с хронической болезнью почек (ХБП).Использование этой формулы у беременных недостаточно изучено, и рекомендации по применению формулы MDRD специально исключают интерпретацию у беременных женщин. Формулы на основе креатинина, разработанные для небеременных женщин, скорее всего, будут неточными при применении для беременных. Например, падение уровня креатинина в сыворотке крови во время беременности отражает не только вызванное беременностью увеличение реальной СКФ, но и гемодилюцию в результате увеличения объема плазмы на 30–50% к родам.Возможно, более важно то, что формула MDRD систематически занижает СКФ, поскольку СКФ превышает 60 мл / мин на м 2 . Эта врожденная неточность, вероятно, будет более выражена при высокой СКФ при беременности. Формулы на основе веса, такие как Кокрофт-Голт, могут переоценивать СКФ, потому что увеличение массы тела во время беременности обычно не отражает увеличение мышечной массы или выработку креатинина.
Формулы на основе креатинина, разработанные для небеременных женщин, скорее всего, будут неточными при применении для беременных. Например, падение уровня креатинина в сыворотке крови во время беременности отражает не только вызванное беременностью увеличение реальной СКФ, но и гемодилюцию в результате увеличения объема плазмы на 30–50% к родам.Возможно, более важно то, что формула MDRD систематически занижает СКФ, поскольку СКФ превышает 60 мл / мин на м 2 . Эта врожденная неточность, вероятно, будет более выражена при высокой СКФ при беременности. Формулы на основе веса, такие как Кокрофт-Голт, могут переоценивать СКФ, потому что увеличение массы тела во время беременности обычно не отражает увеличение мышечной массы или выработку креатинина.
В 2007 году точность формулы MDRD у беременных впервые была официально оценена в двух проспективных исследованиях. 2,3 Smith et al. 2 сравнили эффективность модифицированной формулы MDRD (на основе возраста, креатинина сыворотки и пола) с клиренсом инулина в трех группах женщин: здоровых беременных добровольцах, женщинах с преэклампсией и беременных с ХБП до беременности.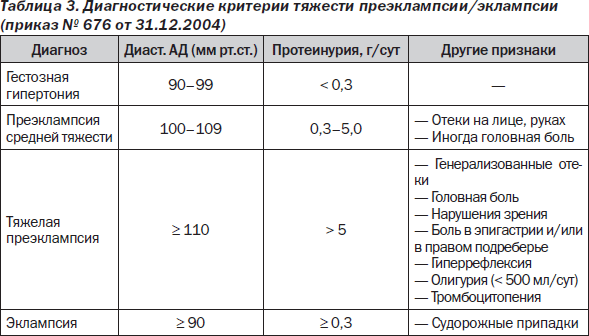 У здоровых беременных женщин клиренс креатинина при 24-часовом сборе мочи близко соответствовал СКФ по клиренсу инулина; однако MDRD занижает СКФ более чем на 40 мл / мин, степень систематической ошибки несколько выше, чем наблюдаемая у небеременных доноров трансплантата почки с нормальной функцией почек (29 мл / мин). 4 Среди беременных с преэклампсией или ХБП формула MDRD показала несколько лучшие результаты, занижая СКФ на 23,3 и 27,3 мл / мин соответственно; однако средняя СКФ во всех трех группах была> 60 мл / мин, это диапазон СКФ, для которого формула MDRD также смещена в популяции небеременных. Следовательно, предвзятость, о которой сообщили авторы, вероятно, представляет собой неточность уравнения MDRD при применении к любой пациентке с почти нормальной функцией почек, независимо от того, беременна ли она.
У здоровых беременных женщин клиренс креатинина при 24-часовом сборе мочи близко соответствовал СКФ по клиренсу инулина; однако MDRD занижает СКФ более чем на 40 мл / мин, степень систематической ошибки несколько выше, чем наблюдаемая у небеременных доноров трансплантата почки с нормальной функцией почек (29 мл / мин). 4 Среди беременных с преэклампсией или ХБП формула MDRD показала несколько лучшие результаты, занижая СКФ на 23,3 и 27,3 мл / мин соответственно; однако средняя СКФ во всех трех группах была> 60 мл / мин, это диапазон СКФ, для которого формула MDRD также смещена в популяции небеременных. Следовательно, предвзятость, о которой сообщили авторы, вероятно, представляет собой неточность уравнения MDRD при применении к любой пациентке с почти нормальной функцией почек, независимо от того, беременна ли она.
Альпер et al. 3 изучали оценку СКФ в когорте из 209 женщин с преэклампсией. Они сравнили клиренс креатинина при 24-часовом сборе мочи, формуле Кокрофта-Голта и двух версиях формулы MDRD. Неудивительно, что они обнаружили, что формула Кокрофта-Голта завышает СКФ примерно на 40 мл / мин, тогда как формулы MDRD занижают СКФ (на 19,68 мл / мин для полного MDRD и 12,6 мл / мин для модифицированного MDRD). Как и в исследовании Smith et al. 2 , средняя СКФ у участников их исследования была значительно выше 60 мл / мин, диапазона СКФ, для которого формула MDRD, как известно, неточна.Нет опубликованных данных о точности формулы MDRD у беременных с СКФ <60 мл / мин. Учитывая эти проблемы, суточный сбор мочи для определения клиренса креатинина остается золотым стандартом для оценки СКФ во время беременности.
Неудивительно, что они обнаружили, что формула Кокрофта-Голта завышает СКФ примерно на 40 мл / мин, тогда как формулы MDRD занижают СКФ (на 19,68 мл / мин для полного MDRD и 12,6 мл / мин для модифицированного MDRD). Как и в исследовании Smith et al. 2 , средняя СКФ у участников их исследования была значительно выше 60 мл / мин, диапазона СКФ, для которого формула MDRD, как известно, неточна.Нет опубликованных данных о точности формулы MDRD у беременных с СКФ <60 мл / мин. Учитывая эти проблемы, суточный сбор мочи для определения клиренса креатинина остается золотым стандартом для оценки СКФ во время беременности.
Оценка протеинурии во время беременности
Соотношение протеинурии и креатинина в моче (соотношение P: C) стало предпочтительным методом количественной оценки протеинурии у небеременных из-за высокой точности, воспроизводимости и удобства по сравнению с измерением по времени. сбор мочи. 5 Количественное определение протеинурии во время беременности показано как минимум в двух клинических ситуациях. Первый — это мониторинг протеинурии у беременных с уже существующей протеинурией почек. В этой ситуации предположения, лежащие в основе использования соотношения P: C у небеременных пациентов (фактически, устойчивое состояние в отношении продукции и экскреции креатинина), как ожидается, будут примерно соблюдаться, и это соотношение можно и нужно использовать для отслеживания изменений в протеинурия при беременности.
Первый — это мониторинг протеинурии у беременных с уже существующей протеинурией почек. В этой ситуации предположения, лежащие в основе использования соотношения P: C у небеременных пациентов (фактически, устойчивое состояние в отношении продукции и экскреции креатинина), как ожидается, будут примерно соблюдаться, и это соотношение можно и нужно использовать для отслеживания изменений в протеинурия при беременности.
Вторым важным показанием для количественного определения протеинурии во время беременности является диагностика преэклампсии. Преэклампсия определяется Американским колледжем акушерства и гинекологии 6 как новое начало гипертонии (АД> 140/90) и протеинурии (≥300 мг белка в 24-часовом сборе мочи) после 20 недель беременности. Регулярная акушерская помощь включает в себя тест-полосками на белок произвольно взятой пробы мочи при каждом пренатальном посещении, метод скрининга, который, как было показано, дает высокий уровень ложноположительных и ложноотрицательных результатов по сравнению с 24-часовым измерением белка в моче. 7 Круглосуточный сбор мочи, хотя и является золотым стандартом количественной оценки протеинурии, имеет несколько ограничений. Это обременительно для пациента, часто неточно из-за неполного сбора, а получение результатов откладывается как минимум на 24 часа, пока сбор завершается.
7 Круглосуточный сбор мочи, хотя и является золотым стандартом количественной оценки протеинурии, имеет несколько ограничений. Это обременительно для пациента, часто неточно из-за неполного сбора, а получение результатов откладывается как минимум на 24 часа, пока сбор завершается.
Использование соотношения P: C для оценки суточной экскреции белка для диагностики преэклампсии было спорным. В нескольких исследованиях сравнивали соотношение P: C с 24-часовым сбором мочи в этой обстановке с противоречивыми выводами.Эти исследования различаются в зависимости от исследуемой популяции и порога, используемого для определения ненормального соотношения. Тем не менее, метаанализ с участием 974 беременных женщин из 10 исследований показал совокупную чувствительность 90% и специфичность 78% с использованием пороговых значений соотношения P: C от 0,19 до 0,25 по сравнению с золотым стандартом 24-часовой экскреции белка с мочой ( > 300 мг / сут). 8 Большинство ошибок в классификации, как правило, происходит у женщин с пограничной протеинурией (от 250 до 400 мг / сут). 9 Следовательно, для диагностики преэклампсии разумно использовать соотношение P: C в моче, при этом 24-часовой сбор проводится, когда результат неоднозначен.
9 Следовательно, для диагностики преэклампсии разумно использовать соотношение P: C в моче, при этом 24-часовой сбор проводится, когда результат неоднозначен.
БЕРЕМЕННОСТЬ ПРИ ХЗП
В литературе о беременности у женщин с ХБП преобладают одноцентровые, ретроспективные и часто неконтролируемые исследования с разнородными определениями заболевания почек и неблагоприятных исходов почек и беременности. К счастью, есть убедительные доказательства того, что женщины с легкой почечной недостаточностью, нормальным АД и небольшой протеинурией или без нее имеют хорошие исходы для матери и плода с небольшим риском ускоренного прогрессирования в сторону ТПН или преждевременных родов. 10,11 Хотя имеется мало данных относительно исходов беременности при конкретных заболеваниях почек, текущий консенсус предполагает, что степень почечной недостаточности, а не основной почечный диагноз, является основным фактором, определяющим исход.
Умеренная и тяжелая ХБП приводит к повышенному риску осложнений беременности и неонатальной заболеваемости: более 70% женщин, забеременевших с уровнем креатинина сыворотки> 2,5 мг / дл, будут преждевременными, а у> 40% разовьется преэклампсия. 12,13 Беременность также может привести к ухудшению функции почек у некоторых женщин, хотя причинно-следственную связь установить трудно. В эпохальном исследовании 1996 года, проведенном Jones and Hayslett, 13 женщин, начавших беременность с уровнем креатинина сыворотки> 2,0 мг / дл, имели высокую (33%) вероятность ускоренного снижения функции почек во время или сразу после беременности. Недавнее исследование Imbasciati et al. 14 — единственное на данный момент исследование, в котором проспективно сравнивается скорость потери СКФ до и после беременности в когорте женщин с 3–5 стадиями ХБП.Они обнаружили, что скорость снижения СКФ после родов существенно не различалась по сравнению с показателем до зачатия во всей когорте женщин с креатинином сыворотки> 1,5 мг / дл; однако ускоренная скорость потери СКФ после родов наблюдалась в подгруппе женщин с расчетной СКФ <40 мл / мин на 1,73 м 2 и протеинурией> 1 г / день до беременности.
12,13 Беременность также может привести к ухудшению функции почек у некоторых женщин, хотя причинно-следственную связь установить трудно. В эпохальном исследовании 1996 года, проведенном Jones and Hayslett, 13 женщин, начавших беременность с уровнем креатинина сыворотки> 2,0 мг / дл, имели высокую (33%) вероятность ускоренного снижения функции почек во время или сразу после беременности. Недавнее исследование Imbasciati et al. 14 — единственное на данный момент исследование, в котором проспективно сравнивается скорость потери СКФ до и после беременности в когорте женщин с 3–5 стадиями ХБП.Они обнаружили, что скорость снижения СКФ после родов существенно не различалась по сравнению с показателем до зачатия во всей когорте женщин с креатинином сыворотки> 1,5 мг / дл; однако ускоренная скорость потери СКФ после родов наблюдалась в подгруппе женщин с расчетной СКФ <40 мл / мин на 1,73 м 2 и протеинурией> 1 г / день до беременности.![]() Эту группу следует рассматривать как группу с особенно высоким риском потери почек и осложнений беременности, и, вероятно, следует избегать беременности.
Эту группу следует рассматривать как группу с особенно высоким риском потери почек и осложнений беременности, и, вероятно, следует избегать беременности.
Беременность после трансплантации почки
Показатели фертильности резко возрастают после трансплантации у женщин с терминальной стадией болезни почек; Таким образом, беременность является обычным явлением среди молодых женщин-реципиентов трансплантата. Большинство данных свидетельствует о том, что беременность после трансплантации не увеличивает риск потери функции трансплантата, 15 , пока функция почек в порядке (креатинин <1,5 мг / дл) и пациентка находится на стабильном иммуносупрессивном режиме. В этой ситуации частота отторжения аналогична общей популяции трансплантатов, и, похоже, нет повышенного риска врожденных дефектов. 16
Неонатальные исходы беременностей у пациенток с трансплантацией почки в целом хорошие. Наиболее неблагоприятные неонатальные исходы связаны с более высокой частотой преждевременных родов (от 50 до 54%), низкой для гестационного возраста (от 33 до 45%) и неонатальной смертностью (от 1 до 3%) по сравнению с населением в целом (12,3, 5). , и 0,68% соответственно). 17,18 Самый высокий риск преждевременных родов и малых для гестационного возраста наблюдается при материнской гипертензии и нарушении исходной функции почечного трансплантата (креатинин> 1.5 мг / дл). 17 Долгосрочные результаты развития выживших младенцев кажутся хорошими. 19
, и 0,68% соответственно). 17,18 Самый высокий риск преждевременных родов и малых для гестационного возраста наблюдается при материнской гипертензии и нарушении исходной функции почечного трансплантата (креатинин> 1.5 мг / дл). 17 Долгосрочные результаты развития выживших младенцев кажутся хорошими. 19
ЛЕКАРСТВЕННЫЕ СРЕДСТВА ИСПОЛЬЗОВАНИЯ ПРИ БЕРЕМЕННОСТИ
Ингибиторы системы ренин-ангиотензин-альдостерон
Широко известные тератогенные эффекты ингибиторов ангиотензин-превращающего фермента (ACEi) включают гипотензию плода, ограничение роста легочной артерии, ануриозно-олигопораминий тубулярная дисплазия, почечная недостаточность новорожденных и гипокальвария. Эти эффекты возникают при воздействии ИАПФ во втором и третьем триместре беременности и приводят к неонатальной смертности до 25%. 17 Выжившие младенцы имеют повышенный риск нарушения функции почек и гипертонии в детстве и в раннем взрослом возрасте. 20 Сообщалось о подобной картине аномалий плода при воздействии антагонистов рецепторов ангиотензина II во втором и третьем триместре. 21,22 Воздействие ИАПФ в первом триместре ранее считалось безвредным, а продолжение приема ИАПФ в начале первого триместра считалось безопасным многими практикующими врачами; однако первое крупное эпидемиологическое исследование воздействия ИАПФ в первом триместре показало более высокую частоту серьезных врожденных аномалий (в первую очередь пороков сердечно-сосудистой системы и центральной нервной системы) по сравнению с беременностями без воздействия (7.1 против на 2,6%). 23 Таким образом, в настоящее время рекомендуется прекратить прием блокаторов рецепторов ACEi и ангиотензина до зачатия и проинформировать пациентов о применении соответствующих средств контроля рождаемости при приеме этих препаратов. Кроме того, женщины с непреднамеренным воздействием ИАПФ или блокаторов рецепторов ангиотензина в первом триместре должны быть обследованы с помощью подробного ультразвукового исследования плода и эхокардиографии в середине беременности для выявления врожденных аномалий.
21,22 Воздействие ИАПФ в первом триместре ранее считалось безвредным, а продолжение приема ИАПФ в начале первого триместра считалось безопасным многими практикующими врачами; однако первое крупное эпидемиологическое исследование воздействия ИАПФ в первом триместре показало более высокую частоту серьезных врожденных аномалий (в первую очередь пороков сердечно-сосудистой системы и центральной нервной системы) по сравнению с беременностями без воздействия (7.1 против на 2,6%). 23 Таким образом, в настоящее время рекомендуется прекратить прием блокаторов рецепторов ACEi и ангиотензина до зачатия и проинформировать пациентов о применении соответствующих средств контроля рождаемости при приеме этих препаратов. Кроме того, женщины с непреднамеренным воздействием ИАПФ или блокаторов рецепторов ангиотензина в первом триместре должны быть обследованы с помощью подробного ультразвукового исследования плода и эхокардиографии в середине беременности для выявления врожденных аномалий.![]() Данные о безопасности антагонистов альдостерона или ингибиторов ренина при беременности немногочисленны или отсутствуют.Учитывая установленную тератогенность ИАПФ и ключевую роль ренин-ангиотензин-альдостероновой системы в развитии плода, применение этих препаратов при беременности, как правило, противопоказано.
Данные о безопасности антагонистов альдостерона или ингибиторов ренина при беременности немногочисленны или отсутствуют.Учитывая установленную тератогенность ИАПФ и ключевую роль ренин-ангиотензин-альдостероновой системы в развитии плода, применение этих препаратов при беременности, как правило, противопоказано.
Иммуносупрессивные препараты
Ингибиторы кальциневрина, стероиды и азатиоприн являются основой безопасной иммуносупрессивной терапии беременных-реципиентов трансплантата. Микофенолятмофетил (ММФ) долгое время избегали при беременности на основании исследований на животных, предполагающих токсичность для развития, пороки развития и внутриутробную гибель в терапевтических дозах.Продолжается накопление доказательств, подтверждающих потенциально тератогенные эффекты MMF при беременности человека, такие как подавление костного мозга плода и структурные аномалии, включая гипопластические ногти, укороченные пальцы, микротию (пороки развития ушей) и расщелину губы / неба. Текущие рекомендации предполагают, что женщинам, принимающим MMF и планирующим беременность, следует прекратить прием лекарства по крайней мере за 6 недель до зачатия. Хотя данных о безопасности сиролимуса при беременности на людях мало, исследования на животных предполагают тератогенность, поэтому его тоже следует избегать. 24
Текущие рекомендации предполагают, что женщинам, принимающим MMF и планирующим беременность, следует прекратить прием лекарства по крайней мере за 6 недель до зачатия. Хотя данных о безопасности сиролимуса при беременности на людях мало, исследования на животных предполагают тератогенность, поэтому его тоже следует избегать. 24
sFlt1 является циркулирующим антагонистом как фактора роста эндотелия сосудов (VEGF), так и фактора роста плаценты (PlGF) и сверхэкспрессируется в плаценте женщин с преэклампсией. Исходная модель преэклампсии, вызванной sFlt1, на крысах 25 была воспроизведена другими. 26 Животные модели преэклампсии, основанные на индукции маточно-плацентарной ишемии у крыс и приматов, характеризуются повышенным циркулирующим и плацентарным sFlt1. 27,28 У женщин с преэклампсией концентрация sFlt1 в маточной вене превышает sFlt1 в антекубитальной вене, что подтверждает фетоплацентарный источник избыточного циркулирующего sFlt1. 29 В настоящее время существует более десятка исследований, подтверждающих, что циркулирующие уровни sFlt1 и одной из его мишеней, проангиогенного PlGF, изменяются за несколько недель до появления клинических признаков и симптомов преэклампсии — в случае PlGF — уже на ранней стадии. как первый триместр.На моделях мышей получены данные о том, что VEGF важен для поддержания здоровья и заживления эндотелиальных клеток клубочков, а его отсутствие вызывает протеинурию и тромботическую микроангиопатию, напоминающую патологические изменения клубочков при преэклампсии. 30 Эти разнообразные результаты подтверждают теорию, согласно которой измененная плацентарная экспрессия ангиогенных факторов, индуцированная или усугубляемая плацентарной ишемией, является основным фактором эндотелиальной дисфункции при преэклампсии.
как первый триместр.На моделях мышей получены данные о том, что VEGF важен для поддержания здоровья и заживления эндотелиальных клеток клубочков, а его отсутствие вызывает протеинурию и тромботическую микроангиопатию, напоминающую патологические изменения клубочков при преэклампсии. 30 Эти разнообразные результаты подтверждают теорию, согласно которой измененная плацентарная экспрессия ангиогенных факторов, индуцированная или усугубляемая плацентарной ишемией, является основным фактором эндотелиальной дисфункции при преэклампсии.
Рисунок 1.
Краткое изложение современного взгляда на патогенез преэклампсии.Дисфункция плаценты, вызванная плохо изученными механизмами, включая генетические, иммунологические и экологические, играет раннюю и основную роль в развитии преэклампсии. Поврежденная плацента, в свою очередь, выделяет антиангиогенные факторы sFlt1 и sEng в кровоток матери. Эти факторы приводят к нарушению передачи сигналов VEGF / PlGF и TGF-β, что приводит к системной дисфункции эндотелиальных клеток, опосредованной множеством факторов, как показано. Эндотелиальная дисфункция, в свою очередь, приводит к системным проявлениям преэклампсии.HO, гемоксигеназа; AT 1 AA, агонистические аутоантитела к ангиотензину 1 типа; COMT / 2ME, катехол-O -метилтрансфераза и 2-метоксиэстрадиол; sFlt1, растворимая fms-подобная тирозинкиназа-1; sEng, растворимый эндоглин; ЕТ-1, эндотелин 1; АФК, активные формы кислорода; NO, оксид азота; ЗВУР — задержка внутриутробного развития плода; АД, гемолиз, повышенные ферменты печени, низкие тромбоциты.
Эндотелиальная дисфункция, в свою очередь, приводит к системным проявлениям преэклампсии.HO, гемоксигеназа; AT 1 AA, агонистические аутоантитела к ангиотензину 1 типа; COMT / 2ME, катехол-O -метилтрансфераза и 2-метоксиэстрадиол; sFlt1, растворимая fms-подобная тирозинкиназа-1; sEng, растворимый эндоглин; ЕТ-1, эндотелин 1; АФК, активные формы кислорода; NO, оксид азота; ЗВУР — задержка внутриутробного развития плода; АД, гемолиз, повышенные ферменты печени, низкие тромбоциты.
sFlt1, вероятно, только один из нескольких циркулирующих факторов, которые способствуют эндотелиальной дисфункции.Растворимый эндоглин (sEng), продукт протеолитического расщепления эндоглина рецептора TGF-β, по-видимому, действует синергетически с sFlt1; при совместном введении беременным крысам sFlt1 и sEng вызывают синдром, напоминающий HELLP (гемолиз, повышенные ферменты печени и низкие тромбоциты), тяжелый вариант преэклампсии. 31,32 Последующие исследования на людях подтверждают, что sEng увеличивается в кровообращении до начала преэклампсии по гестационному типу, аналогичному sFlt1, с резким повышением уровней непосредственно перед появлением клинических симптомов. 33–35
33–35
Ангиогенные факторы в группах высокого риска
Ангиогенные факторы дают представление о патофизиологии нескольких установленных факторов риска преэклампсии. Например, преэклампсия тесно связана как с первой беременностью, так и с беременностью при многоплодной беременности. В обеих этих группах наблюдаются более высокие уровни sFlt1 в сыворотке по сравнению со второй беременностью и одноплодной беременностью, соответственно. 36,37 Точно так же беременные женщины, чьи плоды поражены трисомией 13 (состояние, связанное с повышенным риском преэклампсии), имеют более высокие уровни циркулирующего sFlt1 по сравнению с контрольными субъектами, 38 , возможно, в результате дополнительной копии sFlt1 ген, который находится на хромосоме 13.Курение связано как со снижением риска преэклампсии 39,40 , так и с более низкими уровнями циркулирующего sFlt1 как у беременных 33,41 , так и у небеременных 42 лиц по сравнению с некурящими. Экстракт сигаретного дыма снижает продукцию sFlt1 плацентарными клетками in vitro . 43 Молекулярный механизм, с помощью которого курение подавляет sFlt1 (тем самым снижая риск преэклампсии), неизвестен, но такая реакция неудивительна, учитывая известные проангиогенные эффекты никотина. 44 Тем не менее, никто не рекомендует курить во время беременности.
Экстракт сигаретного дыма снижает продукцию sFlt1 плацентарными клетками in vitro . 43 Молекулярный механизм, с помощью которого курение подавляет sFlt1 (тем самым снижая риск преэклампсии), неизвестен, но такая реакция неудивительна, учитывая известные проангиогенные эффекты никотина. 44 Тем не менее, никто не рекомендует курить во время беременности.
Несколько факторов риска преэклампсии, включая хроническую гипертензию, диабет и ожирение, связаны с основной материнской эндотелиальной дисфункцией. Эти женщины могут быть более восприимчивы к неблагоприятным эндотелиальным эффектам антиангиогенных факторов. Если это так, то можно ожидать, что преэклампсия разовьется при более низком пороге циркулирующего sFlt1 у женщин с этими материнскими эндотелиальными факторами риска по сравнению с ранее здоровыми женщинами.Действительно, уровни sFlt1 ниже у полных женщин с установленной преэклампсией по сравнению с женщинами с нормальным весом с преэклампсией. 45 Аналогичным образом, у женщин с преэклампсией в сочетании с относительно низкими уровнями циркулирующего sFlt1 было обнаружено более высокое АД при бронировании (от 13 до 20 недель беременности) по сравнению с женщинами с преэклампсией с высоким sFlt1, 46 предполагают субклиническую эндотелиальную дисфункцию. при более низком пороге sFlt1 для развития преэклампсии. Еще предстоит выяснить, имеют ли другие сосудистые факторы риска, такие как хроническая гипертензия и диабет, аналогичную картину.
45 Аналогичным образом, у женщин с преэклампсией в сочетании с относительно низкими уровнями циркулирующего sFlt1 было обнаружено более высокое АД при бронировании (от 13 до 20 недель беременности) по сравнению с женщинами с преэклампсией с высоким sFlt1, 46 предполагают субклиническую эндотелиальную дисфункцию. при более низком пороге sFlt1 для развития преэклампсии. Еще предстоит выяснить, имеют ли другие сосудистые факторы риска, такие как хроническая гипертензия и диабет, аналогичную картину.
Молекулярные пути, влияющие на экспрессию sFlt1 и sEng, и то, как они могут быть связаны с другими теориями патогенеза преэклампсии, только появляются. Гемоксигеназа (HO), противовоспалительный фермент с антиоксидантными свойствами, ослабляет экспрессию sFlt1, вызванную VEGF. 47 Снижение активности HO наблюдается у женщин с преэклампсией 48,49 и опосредует повышенную экспрессию sFlt1 и sEng в плаценте. Это наблюдение предполагает потенциальное терапевтическое использование статинов при преэклампсии, потому что эти агенты активируют HO-1 и уменьшают VEGF-индуцированное высвобождение sFlt1 из эксплантатов ворсинок плаценты 47 ; однако в клинических испытаниях сначала необходимо исключить нежелательные эффекты для плода, что является критическим стандартом для любой новой терапии преэклампсии.
В последние годы возросла потенциальная роль агонистических аутоантител к рецептору ангиотензина AT1 (AT1-AA) в патогенезе преэклампсии. Повышение циркулирующих уровней AT1-AA у женщин с преэклампсией было впервые описано в 1999 50 и предположительно опосредовало повышенную реактивность сосудов к ангиотензину II и, возможно, эндотелиальную дисфункцию, которые характерны для преэклампсии. Хотя последующая работа показала, что эти аутоантитела не специфичны для преэклампсии, остаются значительные экспериментальные данные, позволяющие предположить, что они могут играть важную патогенную роль.AT1-AA связаны с окислительным стрессом и снижением инвазии трофобластов, 51 и повышением циркулирующих уровней в модели преэклампсии у трансгенных мышей. 52 Аутоантитела к рецептору AT1 стимулируют продукцию sFlt1 трофобластами in vitro и, следовательно, могут опосредовать избыточную продукцию sFlt1 плацентой при преэклампсии 53 ; однако, AT1-AA не были временно коррелированы с клиническим фенотипом преэклампсии в крупных клинических исследованиях.![]()
В последнее время дефицит плацентарного фермента катехол-O-метил-трансферазы (COMT) и 2-метоксиэстрадиола (2-ME) также был связан с преэклампсией. 54 У мышей с дефицитом COMT развиваются признаки и симптомы, подобные преэклампсии, которые устраняются экзогенной терапией 2-ME, возможно, посредством ингибирования индуцируемого гипоксией фактора 1-α и последующих мишеней, таких как sFlt1. Исследователи также продемонстрировали, что плацента человека, полученная от пациентов с преэклампсией, не имеет СОМТ, что сопровождается низким уровнем циркулирующего 2-МЕ. Необходима дополнительная работа, чтобы понять точную роль СОМТ при нормальной и патологической беременности.
Скрининг преэклампсии
Способность выявлять преэклампсию до начала гипертонии, протеинурии и других явных проявлений заболевания, вероятно, будет первым применением ангиогенных факторов в клиническом ведении преэклампсии. На сегодняшний день более десятка независимых исследований подтвердили значительные изменения в PlGF, sFlt1 или sEng до начала преэклампсии. 33,35,55–69 Изменения PlGF наблюдаются в первом триместре, 67–69 , тогда как воспроизводимые изменения sFlt1 и sEng наблюдаются в середине и конце второго триместра и далее.PlGF выводится с мочой на более низких уровнях при преэклампсии, и измерение PlGF в моче может иметь значение для скрининга преэклампсии 70 или диагностики. 71–73 Объединение этих трех биомаркеров в единый ангиогенный индекс 33,55,65 или допплерографию маточной артерии 74–77 может быть более предсказуемым, чем любой отдельный маркер.
33,35,55–69 Изменения PlGF наблюдаются в первом триместре, 67–69 , тогда как воспроизводимые изменения sFlt1 и sEng наблюдаются в середине и конце второго триместра и далее.PlGF выводится с мочой на более низких уровнях при преэклампсии, и измерение PlGF в моче может иметь значение для скрининга преэклампсии 70 или диагностики. 71–73 Объединение этих трех биомаркеров в единый ангиогенный индекс 33,55,65 или допплерографию маточной артерии 74–77 может быть более предсказуемым, чем любой отдельный маркер.
Еще неизвестно, будут ли ангиогенные биомаркеры достаточно чувствительными и специфичными для широкого клинического использования.Например, изменения ангиогенных факторов связаны с беременностями с нормальным давлением, осложненными задержкой внутриутробного развития (ЗВУР). 58,78–81 Изменения ангиогенного фактора в IUGR менее выражены, чем при преэклампсии, и (за исключением sEng 33 ) не наблюдались в образцах второго и начала третьего триместра, 33,58, 63,82 , поэтому это совпадение может не иметь отношения к раннему скрининговому тесту на преэклампсию. Продолжается международное проспективное когортное исследование ангиогенных биомаркеров для скрининга преэклампсии, спонсируемое Всемирной организацией здравоохранения и с целью набора 10 000 женщин (http: // www.crep.com.ar/plgf/) и поможет прояснить многие из этих противоречий. В дополнение к скринингу и диагностике до появления клинических симптомов, ангиогенные факторы могут оказаться полезными для дифференциации преэклампсии от других гипертензивных расстройств беременности, таких как гестационная гипертензия и хроническая гипертензия. 83,84
Продолжается международное проспективное когортное исследование ангиогенных биомаркеров для скрининга преэклампсии, спонсируемое Всемирной организацией здравоохранения и с целью набора 10 000 женщин (http: // www.crep.com.ar/plgf/) и поможет прояснить многие из этих противоречий. В дополнение к скринингу и диагностике до появления клинических симптомов, ангиогенные факторы могут оказаться полезными для дифференциации преэклампсии от других гипертензивных расстройств беременности, таких как гестационная гипертензия и хроническая гипертензия. 83,84
Плацентарный протеин-13 (PP-13) также появился в качестве раннего биомаркера преэклампсии и других заболеваний, связанных с неадекватной плацентой. PP-13 — это специфический для плаценты белок, который участвует в нормальной имплантации и развитии сосудов плаценты.Уровни PP-13 в материнской сыворотке крови в первом триместре значительно ниже у женщин, у которых развивается преэклампсия, ЗВУР и преждевременные роды. Некоторые ранние исследования предполагали превосходное прогнозирование преэклампсии по сыворотке PP-13 в первом триместре, 85 , хотя в других исследованиях предполагалось, что PP-13 является надежным биомаркером только для раннего начала заболевания и менее полезен для преэклампсии, возникающей ближе к сроку. 86 Сочетание скрининга сыворотки PP-13 в первом триместре с допплерографией маточной артерии может дополнительно улучшить прогноз. 87 Мутации в LGALS13 , гене, кодирующем PP-13, были обнаружены в случаях преэклампсии. 88 Этот полиморфизм может привести к образованию более короткого варианта сплайсинга PP-13, который не обнаруживается с помощью обычных анализов, что способствует низкому уровню циркуляции и снижению локальной активности PP-13 в некоторых случаях преэклампсии.
86 Сочетание скрининга сыворотки PP-13 в первом триместре с допплерографией маточной артерии может дополнительно улучшить прогноз. 87 Мутации в LGALS13 , гене, кодирующем PP-13, были обнаружены в случаях преэклампсии. 88 Этот полиморфизм может привести к образованию более короткого варианта сплайсинга PP-13, который не обнаруживается с помощью обычных анализов, что способствует низкому уровню циркуляции и снижению локальной активности PP-13 в некоторых случаях преэклампсии.
Инструмент для скрининга преэклампсии окажет наибольшее влияние на клинические исходы, когда станут доступны эффективная профилактика или лечение.На сегодняшний день не существует эффективной профилактики преэклампсии, и лечение является поддерживающим, и единственным окончательным лечением является доставка новорожденному. Тем не менее, ранняя диагностика преэклампсии с помощью ангиогенных биомаркеров, вероятно, улучшит клинические исходы при использовании доступных в настоящее время вмешательств. Например, интенсивный мониторинг пациентов с положительным результатом скрининга позволит своевременно назначить антигипертензивные препараты, постельный режим, магний для профилактики судорог, стероиды для созревания легких плода и своевременные роды (при необходимости).Необходимо будет доказать влияние скрининга на клинические исходы с использованием этих методов. Наибольшее потенциальное влияние скрининга и ранней диагностики будет зависеть от новых стратегий лечения или профилактики преэклампсии, основанных на изменении продукции плаценты или эндотелиальных эффектов ангиогенных факторов. Вмешательства, позволяющие безопасно отложить роды всего на 1 неделю, могут значительно улучшить неонатальные исходы при преэклампсии. 89 Такие методы лечения еще не за горами, но они возлагают большие надежды на преобразование нашей помощи женщинам с преэклампсией.
Например, интенсивный мониторинг пациентов с положительным результатом скрининга позволит своевременно назначить антигипертензивные препараты, постельный режим, магний для профилактики судорог, стероиды для созревания легких плода и своевременные роды (при необходимости).Необходимо будет доказать влияние скрининга на клинические исходы с использованием этих методов. Наибольшее потенциальное влияние скрининга и ранней диагностики будет зависеть от новых стратегий лечения или профилактики преэклампсии, основанных на изменении продукции плаценты или эндотелиальных эффектов ангиогенных факторов. Вмешательства, позволяющие безопасно отложить роды всего на 1 неделю, могут значительно улучшить неонатальные исходы при преэклампсии. 89 Такие методы лечения еще не за горами, но они возлагают большие надежды на преобразование нашей помощи женщинам с преэклампсией.
ПРОФИЛАКТИКА И ЛЕЧЕНИЕ ПРЕЭКЛАМПСИИ
Некоторые лекарства и новые методы лечения могут играть роль в лечении преэклампсии.
Аспирин
Теоретические преимущества аспирина основаны на заметных изменениях баланса простациклин-тромбоксан при преэклампсии. Аспирин для профилактики преэклампсии широко изучался. Десятки испытаний дали смешанные результаты, завершившиеся тремя крупными рандомизированными контролируемыми испытаниями, в которых в середине 1990-х годов приняли участие 12 000 женщин из группы высокого риска. 90–92 Все три исследования выявили небольшую, несущественную тенденцию к снижению частоты преэклампсии в группах, получавших аспирин. Подробный метаанализ, опубликованный в 2004 году, впоследствии подкрепленный вторым метаанализом в 2007 году, объединил данные рандомизированных контролируемых исследований с участием более 32 000 женщин с различным статусом риска из 31 исследования. Оба метаанализа показали небольшую, но значительную общую пользу с относительным риском преэклампсии от 0,81 до 0,90 для пациентов, принимавших аспирин. 93,94 В обоих анализах также наблюдалось небольшое снижение риска преждевременных родов. Низкие дозировки аспирина кажутся безопасными: ранние опасения по поводу повышенного риска послеродового кровотечения явно развеялись. Учитывая небольшой, но значительный защитный эффект, профилактику аспирином следует рассматривать как первичную профилактику преэклампсии, особенно для женщин с высоким исходным риском и для которых абсолютное снижение риска будет наибольшим.
Антиоксиданты
Пищевые добавки, включая антиоксиданты, кальций и фолиевую кислоту, были предложены для защиты от преэклампсии.К сожалению, ни один из них не оказался эффективным в рандомизированных контролируемых исследованиях. Использование антиоксидантов вызвало особый энтузиазм в последние несколько лет, отчасти благодаря исследованиям, предполагающим важную роль оксидантного стресса в патогенезе преэклампсии; однако три крупных рандомизированных контролируемых испытания добавок витаминов C и E с размерами выборки от 700 до 2400 женщин не показали положительного эффекта у женщин из группы высокого риска 95,96 или у здоровых первородящих женщин. 97 Продолжается более крупное испытание, спонсируемое Сетью отделений материнско-фетальной медицины Национальных институтов здравоохранения, в котором предполагается принять участие 10 000 женщин из группы низкого риска; однако текущие данные не поддерживают рутинное использование антиоксидантов для профилактики преэклампсии.
Кальций и фолиевая кислота
Добавки кальция неэффективны для женщин с нормальным или высоким исходным уровнем потребления кальция, но могут быть полезны для групп населения с низким (<600 мг / день) потреблением кальция с пищей. 98,99 Фолиевая кислота считается защитной по данным наблюдений, 100 , но пока нет рандомизированных контролируемых испытаний, подтверждающих это утверждение.
Ангиогенная терапия
Повреждение эндотелия при преэклампсии опосредуется, по крайней мере частично, нарушением баланса между проангиогенными (VEGF, PlGF и TGF-β) и антиангиогенными (sFlt1 и sEng) факторами циркуляции.Учитывая это, вмешательства, направленные на восстановление ангиогенного баланса, являются многообещающими для профилактики или лечения преэклампсии. На крысиной модели преэклампсии, вызванной sFlt1, рекомбинантный VEGF-121 уменьшал гипертензию и повреждение почек. 101 Другие стратегии, которые можно изучить, включают использование фактора роста плаценты; mAbs к sFlt1 или sEng; низкомолекулярные ингибиторы sFlt1 или sEng действия; или агенты, которые усиливают продукцию эндогенного VEGF, PlGF или TGF-β.
l-аргинин
Другая потенциальная стратегия лечения преэклампсии основана на роли оксида азота (NO) в патогенезе заболевания.Эндотелиальный защитный эффект VEGF и PlGF при нормальной беременности опосредуется NO, а нарушение синтеза NO может способствовать эндотелиальной дисфункции при преэклампсии. У женщин с преэклампсией высокий уровень циркулирующего асимметричного диметиларгинина, эндогенного ингибитора NO-синтазы, наблюдается еще до клинического начала заболевания. 102,103 Следовательно, доноры или предшественники NO, такие как l-аргинин, могут быть эффективными для профилактики или лечения преэклампсии. Хотя клинические исследования до сих пор были слишком малы, чтобы продемонстрировать убедительную пользу, 104 пилотные данные показали, что l-аргинин может продлить беременность и снизить АД у женщин с гестационной гипертензией. 105 Необходимы более масштабные исследования, чтобы определить, являются ли L-аргинин или другие вмешательства, направленные на восстановление эндотелиальной активности NO, безопасными и эффективными при преэклампсии.
По-прежнему существуют серьезные проблемы с разработкой новых методов лечения преэклампсии, и неясно, окажутся ли эти новые методы лечения безопасными и эффективными. Тем не менее, приятно наблюдать за достижениями в нашем понимании патофизиологии преэклампсии, которые могут в конечном итоге привести к вариантам лечения этого сложного заболевания.
Границы | Исходы беременности для матери и плода при нефротическом синдроме, вызванном первичным гломерулонефритом
Введение
В прошлом страх прогрессирования хронической болезни почек (ХБП) мог помешать нефрологам поддержать идею своих пациенток о зачатии или продолжении беременности, даже если доказательства неблагоприятных исходов были разбросаны. Сегодня легкая форма ХБП поражает почти 3% женщин детородного возраста, тогда как ХБП 3-5 стадии можно обнаружить у 0,7% женщин того же возраста (1).Однако реальную распространенность у беременных невозможно оценить, учитывая, что рекомендации по гестационному скринингу обычно включают только общий анализ мочи для выявления инфекций мочевыводящих путей (ИМП) или протеинурии. С другой стороны, количество случаев легкой ХБП при более расширенных лабораторных обследованиях, проводимых во время беременности, увеличивается, вероятно, из-за увеличения возраста матери и более высокой частоты случаев гипертонии, ожирения, сахарного диабета 2 типа (ДМТ2) или курения. Таким образом, первая беременность часто является настоящим пробным камнем для обнаружения нарушений обмена веществ, нарушения функции почек или ИМП.Среди первичных заболеваний почек гломерулопатии, особенно нефротический синдром, являются редкими состояниями, лечение которых во время беременности должно включать в себя специальное наблюдение и оценку факторов риска неблагоприятных событий у матери и плода и / или прогрессирования почечной недостаточности у матери. Все исследования, основанные на различных случаях ХБП, демонстрируют, что стадия почечной недостаточности, но прежде всего исходная протеинурия и гипертензия, являются значительными факторами риска неблагоприятных исходов. Целью нашего обзора является изучение исходов у женщин, страдающих нефротическим синдромом из-за первичных гломерулопатий, включая фокальный и сегментарный гломерулосклероз (FSGS), болезнь минимальных изменений (MCD), мембранозную нефропатию (MN) и мембранопролиферативный гломерулонефрит (MPGN).
Нефротический синдром и беременность, трудный анализ данных
Этические соображения относительно беременности не позволяют начать интервенционные рандомизированные контролируемые исследования, поэтому литература в этой области в основном основана на ретроспективных или, в меньшей степени, проспективных обсервационных исследованиях. Более того, статистический анализ исходов со стороны матери и плода или почек в этих исследованиях часто основан на стадии ХБП, а не на конкретных основных причинах, которые варьируются от гипертонии и / или протеинурии, диабетической нефропатии (ДН) и гломерулонефрита до аутосомно-доминантной поликистозной болезни почек. (ADPKD), пороки развития почек, нефролитиаз или хронические ИМП.Стоит учитывать, что некоторые из них могут подвергать пациентов особым рискам, таким как повышенная частота деформации плода при DN или наследственная передача ADPKD, в дополнение к другим неблагоприятным исходам, таким как прогрессирование CKD у матери или смерть матери и плода, недоношенность, небольшая для гестационный возраст (SGA) младенцев или поступление в отделение интенсивной терапии новорожденных (NICU), которые являются общими для всех причин ХБП. Наконец, необходимо учитывать долгосрочные эффекты умеренно-тяжелой ХБП, которые приводят к более высокой частоте гипертонии и ишемической болезни сердца у женщин, страдающих материнско-плодными осложнениями.За исключением IgA-нефропатии (IgAN) и системной красной волчанки, которые приводят к наиболее частым гломерулярным заболеваниям у женщин детородного возраста, исследование специфических исходов других гломерулопатий представляется довольно сложным, поскольку трудно найти когорту беременных, достаточно большую для достижения статистической значимости. после стратификации индивидуальных факторов риска.
Преэклампсия или прогрессирование болезни почек?
Нефротический синдром встречается у 0.028% беременностей (2), но повышенную или впервые возникшую протеинурию следует отличать от преэклампсии. Обычно время и клиническая картина являются диагностическими критериями, когда протеинурия увеличивается вдвое по сравнению с исходным значением, если она> 2 г / день, или в 5 раз, если она ниже, после 20 недели гестации, что связано с началом гипертонии и сильных головных болей или боли в эпигастрии. , а также с лабораторными отклонениями, такими как тромбоцитопения и титр сывороточной аспартатаминотрансферазы> 70 Ед / л (3).
В настоящее время подоцитурия и нефринурия рассматриваются как прямые маркеры повреждения подоцитов в моче. Подоцитурия имеет более высокую чувствительность (88%) и специфичность (79%) с методами иммунофлуоресценции, нацеленными на подокаликсин, а не на синаптоподин или подоцин. Нефринурия определяется как повышение уровня нефрина в моче, предшествующее началу клинических проявлений преэклампсии примерно на 9 дней, с наилучшей чувствительностью (100%) и специфичностью (97%) в течение 3 триместра беременности.Однако их преимущество в качестве предикторов преэклампсии может не иметь особого значения при дифференциальной диагностике между этим состоянием и новым началом или прогрессированием нефротического синдрома. Фактор роста плаценты (PlGF) — это ангиогенный фактор, продукция которого увеличивается до 26–30 недель беременности у здоровых женщин. Напротив, при преэклампсии снижение титра PlGF может быть выражением плацентарной дисфункции. Растворимый FMS-подобный рецептор тирозинкиназы 1 (sFlt-1) противодействует PlGF и также продемонстрировал подавление экспрессии компонентов щелевой диафрагмы, ответственных за протеинурию.Отношение sFlt-1 / PlGF, по-видимому, является многообещающим плацентароспецифическим маркером преэклампсии с точки зрения как специфичности, так и чувствительности (4), и коррелирует с тяжестью заболевания, предполагая его начало примерно через 5 недель.
Особые исходы при первичном нефротическом синдроме
Исходы для матери и плода у пациенток с ФСГС изучались с 1980 по 2017 г. в нескольких сериях случаев беременных женщин с подтвержденными биопсией первичными гломерулярными заболеваниями. За исключением проспективного испытания и двух ретроспективных исследований, каждое из которых включало только случай ФСГС и сообщение, соответственно, о прогрессировании заболевания почек, мертворождении и преждевременных родах (5-7), другие исследования включали ряд беременностей в диапазоне от 10 до 84, со сроком доставки в 16–78 лет.5% случаев (8–14). Анализ неблагоприятных исходов беременности и родов показал высокую частоту самопроизвольных абортов (5,9–28,6%), преждевременных родов (5,9–58,8%) и перинатальной смерти (11,7–45,2%) (8–14). Что касается материнских почечных исходов, гипертензия возникала в 20–71% беременностей, но сохранялась через 6 месяцев после родов у 4–66% женщин (8–14). Самый высокий уровень послеродовой гипертензии был достигнут в когорте Саудовской Аравии из 84 беременностей у 18 женщин с ФСГС, у которых было 38 беременностей до развития нефротического синдрома.Малик и др. сравнили материнско-фетальные исходы их беременностей, продемонстрировав отсутствие статистической значимости увеличения частоты абортов, зарегистрированных после постановки диагноза ФСГС. И наоборот, более высокая частота преждевременных родов (5,9%, p = 0,0006) и младенцев с SGA (16,6%, p = 0,0001) в когорте FSGS, чем в контрольной группе, оказалась значимой (13). Интересно, что протеинурия увеличилась с 3,8 ± 3,4 г / сут при первой беременности до 4,8 ± 2,0 г / сут при последней, но разница не была значимой ( p = 0.275). При последнем наблюдении, которое происходило в среднем через 10,5 ± 3,3 года после постановки диагноза ФСГС, половина их когорты имела прогрессирование ХБП, а четыре женщины (22,2%) достигли терминальной стадии почечной недостаточности (ТПН), требующей заместительной почечной терапии (13). ). Эти результаты согласуются с предыдущим опытом Packham et al., Которые сообщили о временном нарушении функции почек в 49% беременностей, сохраняющемся у четырех пациенток и приводящем к ТПН у трех из них (19%), соответственно, после двух беременностей. , 7 и 18 лет, в отличие от более высокой выживаемости почек (93% через 10 лет после постановки диагноза) контрольной группы из 58 небеременных женщин, пораженных ФСГС (11).
В шести исследованиях оценивали исходы беременности и БКР (2, 5, 6, 8, 14). Два ретроспективных исследования, включавшие в отчет только семь пациентов с БЦД, выявили 50–66% новорожденных с СГА. Что касается почечных исходов, они, по-видимому, ограничивались беременностью, с повышенным уровнем протеинурии и началом гипертонии, зарегистрированными только при беременности для каждого испытания, оба из которых проходили в послеродовом периоде (2, 5). В соответствии с этими результатами Суриан (8) не зарегистрировал никаких осложнений при двух беременностях. В 1985 году Abe et al.изучили 17 беременностей у 10 пациенток с MCD, выделив осложнения со стороны матери и плода (младенцы SGA, преждевременные роды, многоводие, преждевременная отслойка плаценты и сильное кровотечение после родов) в 12% беременностей и потеря плода и аборт в 12 и 17% случаев, соответственно. Основными выявленными факторами риска были артериальная гипертензия и скорость клубочковой фильтрации <70 мл / мин (6). Совсем недавно ретроспективное испытание включало семь беременностей, из которых 71,4% не решались преждевременно родить, а 14 беременностей.3% случаев гибели плода после 20 недели гестации. Только у пациентки наблюдалось стабильное увеличение протеинурии в послеродовом периоде (14).
Испытания, изучающие ЗН и беременность, выявили снижение влияния этой гломерулопатии на частоту абортов и мертворождений в отсутствие факторов риска, таких как протеинурия нефротического диапазона во время беременности (2, 5, 6, 8, 9, 12, 14-20 ). Преходящее развитие артериальной гипертензии было зарегистрировано в 7,7–45,4% беременностей, а повышение протеинурии до 60% случаев подтвердило связь ЗН с худшими исходами для плода и матери.Packham et al. сообщили о самом высоком уровне материнско-плодных осложнений с потерей плода в 24% случаев, преждевременными родами в 43% беременностей, прогрессированием ХБП в 9%, но гипертонией у 46% беременных пациенток и более высокой протеинурией в 54,5%. (17). Саудовское когортное исследование, сравнивающее материнские исходы у девяти женщин, переживших беременность до ( n = 21) и после ( n = 30) диагноза MN, продемонстрировало, что разная частота абортов (4,7 против 3,3%, p = 0.843), преждевременные роды (0 против 6,6%, p = 0,152) и перинатальная смертность (0 против 3,3%, p = 0,317) между двумя группами не были статистически значимыми (18). Более того, повышение среднего уровня креатинина в сыворотке от первой беременности после постановки диагноза ЗН до последней из той же когорты также не было значимым (среднее значение SCr 68 ± 17 против 80 ± 48 мкмоль / л, соответственно, p = 0,489) (18).
MPGN определяет патологический паттерн, характеризующийся субэндотелиальными, субэпителиальными и мезангиальными отложениями иммунных комплексов (из-за инфекций, аутоиммунных или моноклональных нарушений) или комплемента (из-за нарушения регуляции альтернативного пути).Случаи идиопатической МПГН были изучены в пяти исследованиях, в которых приняли участие 36 пациентов (5–9). Два исследования включали только пациента и дали противоположные результаты: смерть новорожденного (6) и физиологическая беременность (7). Другие ретроспективные исследования показали, что доношенные роды были у 50% пациентов, тогда как у 16,7–23,8% были преждевременные роды. Смерть плода была более частой у пациентов с ФСГС и МН, оцениваемых в тех же исследованиях, с показателем абортов и послеродовой смертностью в 0–11,1% беременностей (5–9).Более того, Barcelò et al. Стратифицировали исходы пациентов с MPGN, FSGS и MN на основе протеинурии и обнаружили значительную связь только уровней протеинурии> 2,5 г / день с преждевременными родами и низкой массой тела при рождении (1930 ± 301 г) (9). .
Новые данные получены из ретроспективного исследования De Castro et al. 26 беременностей у 19 пациенток с подтвержденным биопсией первичным нефротическим синдромом со средней протеинурией 8,33 ± 6,7 г / день (19). Из 26 описанных беременностей наиболее представленными гломерулопатиями были ФСГС (42%), МН (16%) и IgAN (16%), за которыми следовали MCD, MPGN, гломерулонефрит C3 (C3GN) и фибриллярный гломерулонефрит, на каждый из которых приходилось 5%.Новый диагноз был поставлен 12 женщинам во время беременности со средней гестационной неделей 18,6 ± 9,1, а биопсия почки была выполнена у восьми пациенток со средним гестационным возрастом 21 неделя. В этой группе женщин было зарегистрировано только два незначительных осложнения биопсии (гематома и гематурия) по сравнению с одним нежелательным явлением, зарегистрированным у 11 пациенток, у которых был патологический диагноз до или после беременности (1 небольшой артериовенозный свищ), но процедура оправдала себя. риск, потому что это позволило изменить лечение нефротического синдрома у шести пациентов, которые начали прием преднизона в дозе от 60 до 120 мг / день.Один пациент с известным C3GN получил экулизумаб. Основными описанными неблагоприятными исходами для матери были преэклампсия (27%), острое повреждение почек (ОПП, 23%) и целлюлит (12%), которые не были связаны со стероидной терапией. На ФСГС приходилась половина эпизодов ОПП, один из которых прогрессировал до ТПН, тогда как оставшийся приходился на пациентов с IgAN и C3GN. Исходы плода включали преждевременные роды и низкий вес при рождении (менее 2500 г) в 54% беременностей, задержку внутриутробного развития (ЗВР) в 11% и госпитализацию в ОИТН в 31%.У пациентов, получавших высокие дозы глюкокортикоидов, выявлено два случая преждевременного разрыва плодных оболочек. В этой когорте MN подтвердили наилучшие результаты выживаемости матери и плода и почек с тремя пациентами со стабильным уровнем креатинина сыворотки во время беременности и временным увеличением протеинурии, которая вернулась к не нефротическому диапазону через год после родов. Статистический анализ факторов риска для всей когорты подтвердил сильную связь протеинурии с неблагоприятными исходами, такими как преэклампсия ( p = 0.002), низкой массой тела при рождении ( p = 0,002) и преждевременными родами ( p = 0,02) (19).
Последнее ретроспективное исследование, проведенное Liu et al. сообщили о сохранении функции почек, но о возникновении неблагоприятных материнско-плодных осложнений, включая потерю плода (11%), преждевременные роды (26%) и тяжелую преэклампсию (15%), у 27 беременностей с 2008 по 2018 год в когорте женщин, страдающих ЗН. (20). В соответствии с наблюдениями Де Кастро (19), Лю также продемонстрировал корреляцию протеинурии до 20 недели (подразумевается как усредненный по времени белок в моче, OR 67.5, p <0,001; максимальная протеинурия> 3,5 г / день, OR 29,3, p = 0,001), гипоальбуминемия (усредненный по времени альбумин, OR 67,5, p <0,001; минимальный сывороточный альбумин <25 г / л, OR 10,9, p = 0,01) и отсутствие ремиссии во время беременности (OR 21,6, p = 0,004) с неблагоприятными материнско-фетальными исходами. В частности, усредненная по времени протеинурия и сывороточный альбумин были связаны с процентилем массы тела при рождении новорожденных. Более того, положительность антител против PLA2R ( p = 0.03) проявился как специфический фактор риска для беременных пациенток с ЗН (20). Интересно, что в описании случая беременной пациентки с PLA2R-положительным МН показано трансплацентарное прохождение этих аутоантител, которые были обнаружены в пуповинной крови плода (21). Sachdeva et al. подтвердили этот вывод в новом отчете о случае, а также показали переход PLA2R новорожденному во время грудного вскармливания, что поднимает вопросы о возможности этой практики и проверки титра PLA2R, сывороточного альбумина и анализа мочи у детей матери, пораженной первичным ЗН (22) .
Симптоматическое лечение нефротического синдрома у беременных
При первичном гломерулонефрите может потребоваться введение иммунодепрессантов, таких как микофеноловая кислота и циклофосфамид, тератогенный риск которых известен и поэтому их следует заменить до беременности (23). Следует избегать применения моноклональных антител, таких как ритуксимаб к CD20, из-за их трансплацентарного транспорта в последних триместрах беременности, который может вызвать временное истощение В-клеток у плода (24).И наоборот, кортикостероиды с коротким периодом полувыведения, такие как преднизон и метилпреднизолон, считаются допустимой альтернативой из-за их инактивации плацентарной 11β-гидроксистероиддегидрогеназой типа 2, которая предотвращает неблагоприятное воздействие стероидов на плод (23). Ингибиторы кальциневрина (CNI), такие как циклоспорин (CsA) или такролимус (TAC), по-видимому, безопасны, без доказательств повышенного риска тератогенности (25), а экспериментальные модели на крысах показывают, как P-гликопротеин нарушает трансплацентарный проход CsA. (26).
Ингибиторы ангиотензинпревращающего фермента (ИАПФ) и / или блокаторы рецепторов ангиотензина II (БРА) широко рекомендуются в рекомендациях KDIGO в качестве терапии первой линии нефротического синдрома из-за их нефропротективного действия (27). Их тератогенное действие на сердечно-сосудистую, мочевую, скелетную и центральную нервную системы делает их противопоказаниями при беременности, особенно во втором триместре беременности, поэтому общий совет — немедленно прекратить их прием в начале беременности (28–30).Hoeltzenbein et al. провели проспективное обсервационное исследование, в котором сравнивали 329 женщин, случайно подвергшихся воздействию ИАПФ в течение первого триместра беременности и не дольше 20 недели, и 654 беременных из контрольной группы без гипертонии в анамнезе (31). Значительно повышенная частота серьезных врожденных дефектов в когорте ИАПФ подтвердила результаты предыдущих исследований этих препаратов во время беременности (32, 33), но они также исследовали влияние материнской гипертензии на пороки развития, уже продемонстрированное в других исследованиях (34, 35).Сравнивая пациентов, страдающих хронической гипертензией, получавших ИАПФ, и пациентов, получавших метилдопу, они пришли к выводу, что частота пороков развития существенно не различалась, что также предполагает потенциальную роль тяжелой гипертензии per se как фактора риска неблагоприятных исходов для плода (31).
Безопасный вариант поддержания артериального давления у беременных с ХБП в пределах значений 135/85 мм рт. отскок при прекращении.Другие варианты антигипертензивных препаратов представлены блокаторами кальция, такими как нифедипин длительного действия или лабеталол, комбинированные альфа- и бета-блокаторы, эффективность и безопасность которых сравнимы с метилдопой. Другие β-адреноблокаторы представляют собой второй вариант из-за риска побочных эффектов у новорожденных (обычно преходящая брадикардия, гипотензия и гипогликемия). При беременности диуретики обычно не применяют, и их можно применять при нефротическом синдроме, резистентном к иммуносупрессивной терапии, под строгим контролем во избежание истощения объема и риска ОПП.
Что касается инфузии альбумина при нефротическом синдроме у беременных, то ни одно исследование не дает окончательных выводов о его потенциальной пользе. Напротив, необходимо учитывать риск гиперфильтрации с парадоксальным увеличением протеинурии, и это препятствует систематическому использованию альбумина в этих условиях (36, 37).
Нефротический синдром также характеризуется состоянием гиперкоагуляции, которое необходимо лечить, когда уровень альбумина ниже 2 г / дл. Низкомолекулярный гепарин — правильный выбор как для профилактики, так и для лечения тромбоэмболических осложнений во время беременности и в послеродовой период, поскольку он не проникает через плаценту.Гепарин следует отменить до индукции родов или планового кесарева сечения, но его можно возобновить после родов (38). Во время беременности низкие дозы ацетилсалицилата также являются полезным средством профилактики преэклампсии у пациентов с высоким риском, таких как ХБП и пациенты с протеинурией. Несмотря на рекомендации, рекомендующие начинать терапию после первого триместра во избежание геморрагического риска в случае самопроизвольных абортов, защитный эффект на плацентацию выше при раннем начале приема ацетилсалицилата (39, 40).
Положительный эффект низкобелковой диеты с добавлением аминокислот и кетокислот у беременных с ХБП следует рассматривать как терапевтический вариант при отсутствии специфической антипротеинурической терапии (41, 42).
Выводы
Наш обзор был сфокусирован на результатах материнско-фетальной и почечной выживаемости у беременных пациенток с нефротическим синдромом (таблица 1). Исходные уровни протеинурии, а также артериальная гипертензия и стадия ХБП являются наиболее важными факторами риска неблагоприятных исходов, что подтверждается другими исследованиями с участием беременных женщин, страдающих ХБП.Частота кесарева сечения и преждевременных родов выше, чем у здоровых людей, как сообщили Piccoli et al. В проспективном исследовании у пациентов с ХБП (54,8 и 33,4% соответственно) (43). Среди нефротических синдромов ЗН оказался наиболее благоприятным с точки зрения исходов, тогда как МПГН и ФСГС подвергают пациентов более высокой степени нежелательных явлений как со стороны матери, плода, так и со стороны почек. Адекватное консультирование, по-видимому, необходимо для повышения осведомленности женщин о преимуществах планирования беременности для управления потенциальными тератогенными препаратами и минимизации рисков гестационных осложнений и прогрессирования заболевания, особенно если полная и стабильная ремиссия не достигается до зачатия.Требуются дополнительные проспективные исследования, чтобы лучше оценить конкретные предикторы тяжелых неблагоприятных исходов и достичь статистической значимости после стратификации индивидуальных факторов риска.
Таблица 1 . Ретроспективные исследования первичного нефротического синдрома, материнско-фетальных и почечных исходов.
Авторские взносы
RS, GG и DS: концептуальная разработка и написание — подготовка первоначального проекта. RS, VC, GG и DS: методология. RS и DS: расследование. RG и DS: ресурсы.RS, RG и VC: курирование данных. RS, RG, AS, FT, VC и DS: написание — просмотр и редактирование. RS, RG, AS, FT и DS: визуализация. RG, DS и GG: наблюдение. Все авторы внесли свой вклад в статью и одобрили представленную версию.
Конфликт интересов
Авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могут быть истолкованы как потенциальный конфликт интересов.
Список литературы
3. Американский колледж акушеров и гинекологов, рабочая группа по гипертонии у беременных.Гипертония при беременности. Отчет рабочей группы Американского колледжа акушеров и гинекологов по гипертонии во время беременности. Акушерский гинекол . (2013) 122: 1122–31. DOI: 10.1097 / 01.AOG.0000437382.03963.88
CrossRef Полный текст | Google Scholar
6. Абэ С., Амагасаки Ю., Кониси К., Като Э, Сакагути Х., Иёри С. Влияние предшествующей почечной недостаточности на беременность. Am J Obstet Gynecol. (1985) 153: 508–14. DOI: 10.1016 / 0002-9378 (85)
PubMed Аннотация | CrossRef Полный текст | Google Scholar
7.Алексопулос Э., Били Х., Тампакудис П., Экономиду Д., Сакеллариу Г., Манталенакис С. и др. Исход беременности у женщин с гломерулярными заболеваниями. Почечная недостаточность. (1996) 19: 121–9. DOI: 10.3109 / 088602296082
PubMed Аннотация | CrossRef Полный текст | Google Scholar
8. Суриан М., Имбациати Э., Коши П., Банфи Дж., Барбиано ди Бельгиохосо Дж., Бранкаччо Д. и др. Гломерулярная болезнь и беременность. Исследование 123 беременностей у пациенток с первичными и вторичными гломерулярными заболеваниями. Нефрон. (1984) 36: 101–5. DOI: 10.1159 / 000183126
PubMed Аннотация | CrossRef Полный текст | Google Scholar
10. Кинкейд-Смит П., Фэрли К.Ф. Заболевания почек при беременности. Три спорных вопроса: мезангиальная IgA-нефропатия, очаговый гломерулярный склероз (очаговый и сегментарный гиалиноз и склероз) и рефлюкс-нефропатия. Am J Kidney Dis. (1987) 9: 328–33. DOI: 10.1016 / S0272-6386 (87) 80131-2
PubMed Аннотация | CrossRef Полный текст | Google Scholar
11.Packham DK, North RA, Fairley KF, Ihle BU, Whitworth JA, Kincaid-Smith P. Беременность у женщин с первичным фокальным и сегментарным гиалинозом и склерозом. Клин Нефрол. (1988) 29: 185–92.
PubMed Аннотация | Google Scholar
12. Jungers P, Houillier P, Forget D, Henry-Amar M. Конкретные разногласия относительно естественного течения болезни почек во время беременности. Am J Kidney Dis. (1991) 17: 116–22. DOI: 10.1016 / S0272-6386 (12) 81114-0
PubMed Аннотация | CrossRef Полный текст | Google Scholar
13.Малик Г. Х., Аль-Мохая С., Аль-Вакил Дж., Шейх Дж. Ф., Аль-Хозаим В., Аль-Духайми Н. и др. Повторные беременности у пациенток с первично-очаговым сегментарным гломерулосклерозом. Индийский Дж. Нефрол. (2002) 12: 33–9.
14. О’Шонесси М.М., Джобсон М.А., Симс К., Либерти А.Л., Нахман PH, Pendergraft WF. Исходы беременности у пациенток с гломерулярными заболеваниями, посещающих единственный академический центр в Северной Каролине. Am J Nephrol. (2017) 45: 442–51. DOI: 10.1159 / 000471894
PubMed Аннотация | CrossRef Полный текст | Google Scholar
17.Packham DK, North RA, Fairley KF, Whitworth JA, Kincaid-Smith P. Мембранозный гломерулонефрит и беременность. Клин Нефрол . (1987) 28: 56–64.
PubMed Аннотация | Google Scholar
18. Малик Г. Х., Аль-Харби А.С., Аль-Мохая С., Аль-Вакил Дж., Аль-Хозайм В., Кечрид М. и др. Повторные беременности у пациенток с первичным мембранозным гломерулонефритом. Нефрон. (2002) 91: 21–4. DOI: 10.1159 / 000057600
PubMed Аннотация | CrossRef Полный текст | Google Scholar
19.Де Кастро I, Истерлинг Т. Р., Бансал Н, Джефферсон Дж. А. Нефротический синдром при беременности сопряжен с риском осложнений как для матери, так и для плода. Kidney Int. (2017) 91: 1464–72. DOI: 10.1016 / j.kint.2016.12.019
PubMed Аннотация | CrossRef Полный текст | Google Scholar
21. Аль-Рабади Л., Аялон Р., Бонегио Р. Г., Баллард Дж. Э., Фуджи А. М., Хендерсон Дж. М. и др. Беременность у пациентки с первичной мембранозной нефропатией и циркулирующими антителами к PLA2R: отчет о клиническом случае. Am J Kidney Dis .(2016) 67: 775–8. DOI: 10.1053 / j.ajkd.2015.10.031
PubMed Аннотация | CrossRef Полный текст | Google Scholar
22. Sachdeva M, Beck LH, Jr, Miller I., Bijol V, Fishbane S. Phospholipase A 2 беременность с положительной реакцией на антитела к рецепторам : отчет о болезни. Am J Kidney Dis. (2020) 76: 586–9. DOI: 10.1053 / j.ajkd.2019.11.011
PubMed Аннотация | CrossRef Полный текст | Google Scholar
25. Шах С., Венкатесан Р.Л., Гупта А., Сангхави М.К., Велге Дж., Йохансен Р. и др.Исходы беременности у женщин с трансплантатом почки: метаанализ и систематический обзор. BMC Nephrol. (2019) 20:24. DOI: 10.1186 / s12882-019-1213-5
PubMed Аннотация | CrossRef Полный текст | Google Scholar
26. Павек П., Фендрих З., Стауд Ф., Малакова Дж., Брозманова Х., Лазницек М. и др. Влияние Р-гликопротеина на трансплацентарный пассаж циклоспорина. J Pharm Sci. (2001) 90: 1583–92. DOI: 10.1002 / jps.1108
PubMed Аннотация | CrossRef Полный текст | Google Scholar
27.Заболевание почек: улучшение глобальных результатов (KDIGO) Рабочая группа по гломерулонефриту. KDIGO Руководство по клинической практике гломерулонефрита. Почки Интенсивное . (2012) 2: 139–274. DOI: 10.1038 / kisup.2012.9
PubMed Аннотация | CrossRef Полный текст | Google Scholar
29. Льюис Г., Максвелл А.П. Следует ли женщинам с диабетической нефропатией с учетом беременности продолжать терапию ингибиторами АПФ или блокаторами рецепторов ангиотензина II до подтверждения беременности? Diabetologia. (2014) 57: 1082–3. DOI: 10.1007 / s00125-014-3188-x
CrossRef Полный текст | Google Scholar
30. Купер В.О., Эрнандес-Диаз С., Арбогаст П.Г., Дадли Дж. А., Дайер С., Гидеон П.С. и др. Серьезные врожденные пороки развития после приема ингибиторов АПФ в первом триместре. N Engl J Med. (2006) 354: 2443–51 DOI: 10.1056 / NEJMoa055202
PubMed Аннотация | CrossRef Полный текст | Google Scholar
31. Hoeltzenbein M, Tissen-Diabaté T, Fietz, A.-K, Zinke S, Kayser A, et al.Повышенная частота врожденных дефектов после приема ингибиторов ангиотензинпревращающего фермента в первом триместре — лечение или гипертония? Наблюдательное когортное исследование. Беременные гипертоники. (2018) 13: 65–71. DOI: 10.1016 / j.preghy.2018.04.022
CrossRef Полный текст | Google Scholar
32. Бейтман Б.Т., Паторно Э., Десаи Р.Дж., Сили Э.В., Могун Х., Деджене С.З. и др. Ингибиторы ангиотензинпревращающего фермента и риск врожденных пороков развития. Obstet Gynecol. (2017) 129: 174–84.DOI: 10.1097 / AOG.0000000000001775
PubMed Аннотация | CrossRef Полный текст | Google Scholar
33. Ли Д.К., Ян Ц., Андраде С., Таварес В., Фербер-младший. Воздействие на мать ингибиторов ангиотензинпревращающего фермента в первом триместре и риск пороков развития у потомства: ретроспективное когортное исследование. BMJ. (2011) 343: d5931. DOI: 10.1136 / bmj.d5931
PubMed Аннотация | CrossRef Полный текст | Google Scholar
34. Бейтман Б.Т., Хайбрехтс К.Ф., Фишер М.А., Сили Е.В., Эккер Дж.Л., Оберг А.С. и др.Хроническая гипертензия при беременности и риск врожденных пороков развития: когортное исследование. Am J Obstet Gynecol. (2015) 212: 337 e1–14. DOI: 10.1016 / j.ajog.2014.09.031
PubMed Аннотация | CrossRef Полный текст | Google Scholar
35. Рамакришнан А., Ли Л.Дж., Митчелл Л.Э., Агопиан А.Дж. Материнская гипертензия во время беременности и риск врожденных пороков сердца у потомства: систематический обзор и метаанализ. Pediatr Cardiol. (2015) 36: 1442–51.DOI: 10.1007 / s00246-015-1182-9
PubMed Аннотация | CrossRef Полный текст | Google Scholar
37. Кабидду Дж., Кастеллино С., Герноне Дж., Санторо Д., Морони Дж., Джаннаттазио М. и др. Изложение позиции передовой практики в отношении беременности при хронической болезни почек: Итальянская исследовательская группа по почкам и беременности. J Nephrol. (2016) 29: 277–303. DOI: 10.1007 / s40620-016-0285-6
CrossRef Полный текст | Google Scholar
39. Хендерсон Дж. Т., Уитлок Е. П., О’Коннер Е., Зенгер, Калифорния, Томпсон Дж. Х., Роуленд М. Г.. Низкие дозы аспирина для предотвращения заболеваемости и смертности от преэклампсии: систематический обзор данных для Целевой группы профилактических служб США . Роквилл, Мэриленд: Агентство медицинских исследований и качества (США). Отчет №: 14-05207-EF-1 (2014).
Google Scholar
40. Роберж С., Вилла П, Николаидес К., Жигер Й, Вайнио М., Бакти А. и др. Раннее введение низких доз аспирина для профилактики преэклампсии и преэклампсии в срок: систематический обзор и метаанализ. Fetal Diagn Ther. (2012) 31: 141–6. DOI: 10.1159 / 000336662
PubMed Аннотация | CrossRef Полный текст | Google Scholar
41. Аттини Р., Леоне Ф., Монтерсино Б., Фассио Ф., Минелли Ф., Колла Л. и др. Беременность, протеинурия, диеты с добавками растений и очаговый сегментарный гломерулосклероз: отчет о трех случаях и критическая оценка литературы. Питательные вещества. (2017) 9: E770. DOI: 10.3390 / nu70
PubMed Аннотация | CrossRef Полный текст | Google Scholar
42.Аттини Р., Монтерсино Б., Леоне Ф., Минелли Ф., Фассио Ф., Россетти М. М. и др. Диализ или растительная диета при поздних стадиях ХБП во время беременности? Отчет о болезни и критическая оценка литературы. J Clin Med. (2019) 8: 123. DOI: 10.3390 / jcm8010123
CrossRef Полный текст | Google Scholar
43. Пикколи Г.Б., Кабидду Дж., Аттини Р., Виготти Ф.Н., Максиа С., Лепори Н. и др. Риск неблагоприятных исходов беременности у женщин с ХБП. J Am Soc Nephrol. (2015) 26: 2011–22.DOI: 10.1681 / ASN.2014050459
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Преэклампсия — Диагностика и лечение
Диагноз
Для диагностики преэклампсии у вас должно быть высокое кровяное давление и одно или несколько из следующих осложнений после 20-й недели беременности:
- Белок в моче (протеинурия)
- Низкое количество тромбоцитов
- Нарушение функции печени
- Признаки проблем с почками, кроме белков в моче
- Жидкость в легких (отек легких)
- Новые головные боли или нарушения зрения
Раньше преэклампсия диагностировалась только при высоком артериальном давлении и содержании белка в моче.Однако теперь специалисты знают, что преэклампсия возможна, но в моче никогда не бывает белка.
Показания артериального давления, превышающие 140/90 мм рт. Ст., Являются ненормальными при беременности. Однако однократное показание высокого кровяного давления не означает, что у вас преэклампсия. Если у вас есть одно показание в ненормальном диапазоне — или показание, которое значительно выше, чем ваше обычное артериальное давление, — ваш врач будет внимательно следить за вашими цифрами.
Повторное показание аномального артериального давления через четыре часа после первого может подтвердить подозрение вашего врача на преэклампсию.Ваш врач может попросить вас прийти для дополнительных измерений артериального давления и анализов крови и мочи.
Тесты, которые могут потребоваться
Если ваш врач подозревает преэклампсию, вам могут потребоваться определенные тесты, в том числе:
- Анализы крови. Ваш врач назначит тесты функции печени и почек, а также измерит ваши тромбоциты — клетки, которые способствуют свертыванию крови.
- Анализ мочи. Ваш врач попросит вас собирать мочу в течение 24 часов для измерения количества белка в моче.Один образец мочи, который измеряет соотношение белка к креатинину — химическому веществу, которое всегда присутствует в моче, — также может быть использован для постановки диагноза.
- УЗИ плода. Ваш врач может также порекомендовать внимательно следить за ростом вашего ребенка, обычно с помощью ультразвука. Изображения вашего ребенка, созданные во время ультразвукового исследования, позволяют вашему врачу оценить вес плода и количество жидкости в матке (околоплодных водах).
- Нестресс-тест или биофизический профиль. Нестрессовый тест — это простая процедура, которая проверяет, как частота пульса вашего ребенка реагирует на движения ребенка. Биофизический профиль использует ультразвук для измерения дыхания вашего ребенка, мышечного тонуса, движений и объема околоплодных вод в матке.
Лечение
Самым эффективным методом лечения преэклампсии является родоразрешение. У вас повышенный риск судорог, отслойки плаценты, инсульта и, возможно, сильного кровотечения, пока ваше кровяное давление не снизится.Конечно, на слишком раннем сроке беременности роды могут быть не лучшим решением для вашего ребенка.
Если у вас диагностирована преэклампсия, ваш врач сообщит вам, как часто вам нужно будет приходить на пренатальные визиты — вероятно, чаще, чем обычно рекомендуется для беременных. Вам также потребуются более частые анализы крови, ультразвук и нестрессовые тесты, чем можно было бы ожидать при неосложненной беременности.
Лекарства
Возможное лечение преэклампсии может включать:
Лекарства для снижения артериального давления. Эти лекарства, называемые гипотензивными средствами, используются для снижения артериального давления, если оно опасно высоко. Артериальное давление в диапазоне 140/90 миллиметров ртутного столба (мм рт. Ст.) Обычно не лечится.
Хотя существует множество различных типов гипотензивных препаратов, некоторые из них небезопасны для использования во время беременности. Обсудите со своим врачом, нужно ли вам в вашей ситуации принимать гипотензивные препараты для контроля артериального давления.
- Кортикостероиды. Если у вас тяжелая преэклампсия или HELLP-синдром, кортикостероидные препараты могут временно улучшить функцию печени и тромбоцитов, чтобы продлить вашу беременность. Кортикостероиды также могут помочь легким вашего ребенка стать более зрелыми всего за 48 часов — важный шаг в подготовке недоношенного ребенка к жизни вне матки.
- Противосудорожные препараты. Если у вас тяжелая преэклампсия, ваш врач может назначить противосудорожное лекарство, такое как сульфат магния, для предотвращения первого приступа.
Постельный режим
Постельный режим обычно рекомендовался женщинам с преэклампсией. Но исследования не показали пользы от этой практики, и она может увеличить риск образования тромбов, а также повлиять на вашу экономическую и социальную жизнь. Для большинства женщин постельный режим больше не рекомендуется.
Госпитализация
При тяжелой преэклампсии может потребоваться госпитализация. В больнице ваш врач может проводить регулярные нестрессовые тесты или биофизические профили, чтобы следить за благополучием вашего ребенка и измерять объем околоплодных вод.Недостаток околоплодных вод — признак плохого кровоснабжения малыша.
Роды
Если вам поставили диагноз преэклампсия ближе к концу беременности, ваш врач может порекомендовать немедленно вызвать роды. Готовность шейки матки — независимо от того, начинает ли она открываться (расширяться), истончаться (стираться) и размягчаться (созревать) — также может быть фактором, определяющим, будут ли начаты роды и когда они начнутся.
В тяжелых случаях невозможно определить срок беременности вашего ребенка или состояние шейки матки.Если нет возможности ждать, ваш врач может вызвать роды или сразу назначить кесарево сечение. Во время родов вам могут ввести сульфат магния внутривенно, чтобы предотвратить судороги.
Если после родов вам понадобятся обезболивающие, узнайте у врача, что вам следует принимать. НПВП, такие как ибупрофен (Advil, Motrin IB, другие) и напроксен натрия (Aleve), могут повышать артериальное давление.
После родов может пройти некоторое время, прежде чем высокое кровяное давление и другие симптомы преэклампсии исчезнут.
Помощь и поддержка
Обнаружение потенциально серьезного осложнения беременности может быть пугающим. Если вам поставили диагноз преэклампсия на поздних сроках беременности, вы можете быть удивлены и напуганы, узнав, что у вас сразу же спровоцируют. Если вам поставили диагноз на ранних сроках беременности, у вас может быть много недель, чтобы беспокоиться о здоровье вашего ребенка.
Это может помочь узнать о вашем состоянии.Помимо разговора с врачом, проведите небольшое исследование. Убедитесь, что вы понимаете, когда звонить своему врачу, как следить за своим ребенком и своим состоянием, а затем найти что-то еще, чем занять ваше время, чтобы не тратить слишком много времени на беспокойство.
Подготовка к приему
Преэклампсия, вероятно, будет диагностирована во время обычного дородового осмотра. После этого у вас, вероятно, будут дополнительные посещения акушера.
Вот некоторая информация, которая поможет вам подготовиться к приему и чего ожидать от врача.
Что вы можете сделать
Чтобы подготовиться к встрече:
- Запишите все симптомы, которые вы испытываете, , даже если вы считаете, что это нормальные симптомы беременности.
- Составьте список всех лекарств, витаминов и добавок, которые вы принимаете.
- Возьмите с собой члена семьи или друга, по возможности , чтобы помочь вам запомнить всю информацию, предоставленную во время приема.
- Запишите вопросы, которые нужно задать своему врачу, перечислив их в порядке важности на тот случай, если время истечет.
При преэклампсии вам нужно задать врачу следующие основные вопросы:
- Повлияло ли это состояние на моего ребенка?
- Безопасно ли продолжать беременность?
- На какие признаки мне нужно обращать внимание и когда мне позвонить вам?
- Как часто вам нужно меня видеть? Как вы будете следить за здоровьем моего ребенка?
- Какие процедуры доступны и что вы мне порекомендуете?
- У меня другие проблемы со здоровьем.Как мне вместе лучше всего справиться с этими условиями?
- Нужно ли мне соблюдать какие-либо ограничения деятельности?
- Мне понадобится кесарево сечение?
- У вас есть брошюры или другие печатные материалы, которые я могу получить? Какие сайты вы рекомендуете?
Помимо вопросов, которые вы подготовили, не стесняйтесь задавать вопросы, которые возникают у вас во время приема.
Чего ожидать от врача
Ваш врач может задать следующие вопросы:
- Это ваша первая беременность или первая беременность от отца этого ребенка?
- Были ли у вас в последнее время какие-либо необычные симптомы, такие как нечеткость зрения или головные боли?
- Вы когда-нибудь чувствовали боль в верхней части живота, которая, кажется, не связана с движениями вашего ребенка?
- Было ли у вас в прошлом высокое кровяное давление?
- Были ли у вас преэклампсия при предыдущих беременностях?
- Были ли у вас осложнения во время предыдущей беременности?
- С какими другими заболеваниями вы имеете дело?
.


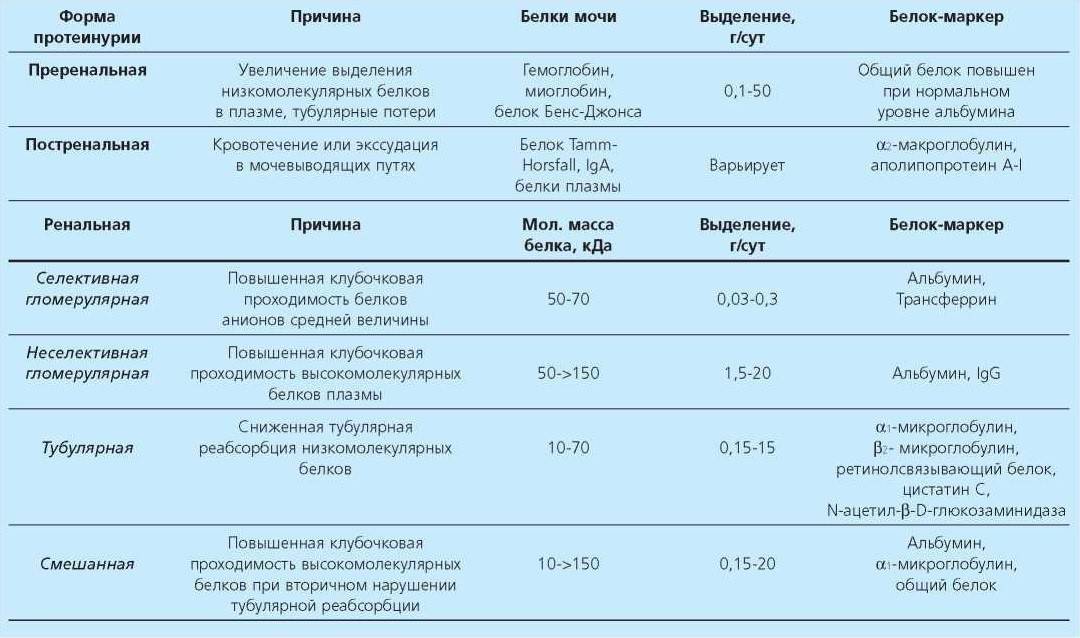


 Суточный анализ мочи на белок назначается, как правило, после того, как повышенный белок был обнаружен при общеклиническом анализе. Нормальные значения для суточного анализа: выделение белка 0,08-0,24 г/сут, концентрация – 0,0 – 0,14 г/л;
Суточный анализ мочи на белок назначается, как правило, после того, как повышенный белок был обнаружен при общеклиническом анализе. Нормальные значения для суточного анализа: выделение белка 0,08-0,24 г/сут, концентрация – 0,0 – 0,14 г/л;
 1 мг / дл или
1 мг / дл или [Crossref]
[Crossref] (2014) Изменение соотношения белка в моче и креатинина в течение дня у женщин с подозрением на преэклампсию. BJOG 121: 1660-1665. [Crossref]
(2014) Изменение соотношения белка в моче и креатинина в течение дня у женщин с подозрением на преэклампсию. BJOG 121: 1660-1665. [Crossref] PLoS One 9: e113715. [Crossref]
PLoS One 9: e113715. [Crossref] Am J Physiol Regul Integr Comp Physiol 313: R418-R424. [Crossref]
Am J Physiol Regul Integr Comp Physiol 313: R418-R424. [Crossref] Am Heart J 156: 918-930. [Crossref]
Am Heart J 156: 918-930. [Crossref] (2013) Лечение гипертонии во время беременности: когда следует начинать прием препаратов от артериального давления? Curr Cardiol Rep 15: 412. [Crossref]
(2013) Лечение гипертонии во время беременности: когда следует начинать прием препаратов от артериального давления? Curr Cardiol Rep 15: 412. [Crossref] Adv Chronic Kidney Dis 20: 229-239. [Crossref]
Adv Chronic Kidney Dis 20: 229-239. [Crossref] Семин Нефрол 31: 5-32. [Crossref]
Семин Нефрол 31: 5-32. [Crossref] Adv Chronic Kidney Dis 14: 132-145. [Crossref]
Adv Chronic Kidney Dis 14: 132-145. [Crossref]