Содержание
Зи-фактор®
Дата вступления в силу: «12» ноября 2015 г.
Настоящие Условия онлайн-использования регламентируют Ваш доступ к веб-сайтам, контролируемым компанией «Верофарм», включая ее подразделения и филиалы (совместно именуемые «Верофарм»), которые ссылаются на настоящие Условия онлайн- использования (совместно именуемые «веб-сайтами компании «Верофарм»). Настоящие Условия онлайн-использования не применимы к веб-сайтам компании «Верофарм», которые не ссылаются на настоящие Условия онлайн-использования и к веб-сайтам третьих лиц, с которыми могут быть связаны веб-сайты компании «Верофарм». Использование Вами веб-сайтов компании «Верофарм» подпадает под действие настоящих Условий онлайн-использования и Политики в отношении обработки персональных данных на веб-сайтах компании «Верофарм».
В пределах, допустимых применимым законодательством, компания «Верофарм» сохраняет за собой право вносить поправки в данные Условия онлайн-использования с учетом технологического прогресса, юридических и правовых изменений, надлежащей бизнес-практики. Если компания «Верофарм» внесет изменения в настоящие Условия онлайн-использования, обновленная версия Условий онлайн-использования будет отражать соответствующие изменения, и мы уведомим Вас об их наличии, обновив дату вступления в силу Условий онлайн-использования, указанную выше.
Если компания «Верофарм» внесет изменения в настоящие Условия онлайн-использования, обновленная версия Условий онлайн-использования будет отражать соответствующие изменения, и мы уведомим Вас об их наличии, обновив дату вступления в силу Условий онлайн-использования, указанную выше.
Осуществляя доступ и используя веб-сайты компании «Верофарм», Вы соглашаетесь с тем, что прочитали, поняли и согласились соблюдать настоящие Условия онлайн-использования в их текущей версии, с которыми Вы имели возможность ознакомиться при доступе к веб-сайтам компании «Верофарм». Если Вы не согласны с данными Условиями онлайн-использования или не удовлетворены деятельностью веб-сайтов компании «Верофарм», Вашим единственным и исключительным способом правовой защиты, в пределах допустимых применимым законодательством, является прекращение использования данного веб-сайта компании «Верофарм».
Отказ от ответственности
Вы признаете и соглашаетесь с тем, что:
а. Несмотря на то что на веб-сайтах компании «Верофарм» мы всегда стремимся представить новейшие разработки, связанные с нашими продуктами и услугами, а также иную информацию о компании «Верофарм», информация представлена в формате «КАК ЕСТЬ» и может содержать технические неточности, типографские ошибки или являться неактуальной. Компания «Верофарм» сохраняет за собой право добавлять, удалять или изменять информацию, содержащуюся на веб-сайтах компании «Верофарм» в любое время без предварительного уведомления.
Несмотря на то что на веб-сайтах компании «Верофарм» мы всегда стремимся представить новейшие разработки, связанные с нашими продуктами и услугами, а также иную информацию о компании «Верофарм», информация представлена в формате «КАК ЕСТЬ» и может содержать технические неточности, типографские ошибки или являться неактуальной. Компания «Верофарм» сохраняет за собой право добавлять, удалять или изменять информацию, содержащуюся на веб-сайтах компании «Верофарм» в любое время без предварительного уведомления.
б. Компания «Верофарм» не предоставляет никаких заверений или гарантий какого-либо рода или характера относительно информации или данных, размещенных на веб-сайтах компании «Верофарм».
В пределах, допустимых действующим законодательством, настоящим компания «Верофарм» снимает с себя ответственность за любые утверждения или гарантии, высказанные или подразумеваемые, предписанные законом, контрактом или иным образом, ни в коем случае компания «Верофарм» не несет ответственности за любой ущерб любого рода или характера, в том числе, без ограничений, прямой, косвенный, особый (включая упущенную выгоду), явившийся следствием или случайным, ущерб, возникший в связи или на основе существования или использования веб-сайтов компании «Верофарм», и/или информации или сведений, размещенных на веб-сайтах компании «Верофарм» независимо от того, предполагала ли компания «Верофарм» возможность такого ущерба.
в. Компания «Верофарм» не несет ответственности и не предоставляет никаких гарантий относительно точности, эффективности, своевременности и приемлемости любой информации или сведений, полученных от третьих лиц, включая гиперссылки на или с сайтов третьих лиц. За исключением случаев, оговоренных на веб-сайтах компании «Верофарм», компания «Верофарм» не проводит редактирование, рецензирование или иной контроль информационного наполнения, представляемого третьими лицами на досках объявлений, в чатах и на других аналогичных форумах, размещаемых на веб-сайтах компании «Верофарм». В этой связи, такая информация должна рассматриваться как подозрительная и не является подтвержденной компанией «Верофарм».
г. Веб-сайты компании «Верофарм» могут содержать прогностические утверждения, которые отражают ожидания компании «Верофарм» в отношении предстоящих событий и развития бизнеса. Прогностические утверждения предполагают риски и неопределенность. Реальное развитие событий или результаты могут значительно отличаться от предполагаемых и зависят от множества факторов, включая (но не ограничиваясь этим) успешным завершением продолжающихся программ разработки, результатами текущих или будущих клинических исследований, продолжающимся коммерческим внедрением продукции, регуляторным одобрением фармацевтических препаратов, достоверностью и приведением в действие патентов, стабильностью коммерческих взаимоотношений и общими экономическими условия. Компания «Верофарм» намерена регулярно обновлять свои веб-сайты, однако не принимает на себя никаких обязательств по обновлению любого информационного наполнения веб-сайтов.
Компания «Верофарм» намерена регулярно обновлять свои веб-сайты, однако не принимает на себя никаких обязательств по обновлению любого информационного наполнения веб-сайтов.
Ваше использование
Вы понимаете, принимаете к сведению и соглашаетесь, что:
а. Используя веб-сайты компании «Верофарм», Вы согласны не изменять и не разрушать нашу электронную информацию, размещенную на веб-сайтах компании «Верофарм» или на любых наших серверах. Кроме того, Вы также соглашаетесь не пытаться обойти меры безопасности веб-сайтов компании «Верофарм» и соблюдать требования всех действующих местных, государственных, федеральных и международных законов, правил и постановлений.
б. Вы предоставляете компании «Верофарм» право использовать любые материалы, которые Вы загружаете или иным образом передаете на веб-сайты компании «Верофарм», в соответствии с настоящими Условиями онлайн-использования и Политикой в отношении обработки персональных данных на веб-сайтах компании «Верофарм», любым способом, который компания «Верофарм» сочтет предпочтительным, включая, но не ограничиваясь копированием, показом, воспроизводством или публикацией в каком бы то ни было формате, с изменением материалов, включением в иные материалы или проведением основанных на этих материалах работ.
в. За исключением случаев, специально оговоренных и заранее согласованных компанией «Верофарм», отношения по конфиденциальности между компанией «Верофарм» и пользователем веб-сайтов компании «Верофарм» не будут возникать в том случае, если пользователь веб-сайтов компании «Верофарм» направит какое-либо устное, письменное или электронное сообщение компании «Верофарм» (обратная связь, вопросы, комментарии, предложения, идеи и т.д.).
Если какой-либо веб-сайт компании «Верофарм» требует или просит предоставить такую информацию, и эта информация содержит сведения, позволяющие идентифицировать личность (например, фамилию, адрес, номер телефона, электронный адрес), компания «Верофарм» намерена получить, использовать и сохранить эту информацию с согласия соответствующего пользователя в соответствии с положениями, указанными в Политике в отношении обработки персональных данных на веб-сайтах компании «Верофарм».
В ином случае такие сообщения и любая информация, предоставленная в их контексте, будет рассматриваться как не конфиденциальная, и компания «Верофарм» будет располагать правом воспроизводить, публиковать или иным образом использовать эту информацию для каких бы то ни было целей, включая, без ограничений, исследование, разработку, производство, использование или продажу продукции, предполагающие внедрение данной информации. Лицо, направившее какую-либо информацию в компанию «Верофарм», несет полную ответственность за ее содержание, включая ее достоверность, точность и тот факт, что она не несет в себе нарушения чьих-либо прав, в том числе, права собственности.
Лицо, направившее какую-либо информацию в компанию «Верофарм», несет полную ответственность за ее содержание, включая ее достоверность, точность и тот факт, что она не несет в себе нарушения чьих-либо прав, в том числе, права собственности.
Маркировка продукции
Локальные веб-сайты компании «Верофарм» содержат общую информацию о компании «Верофарм» и ее продуктах, которые официально зарегистрированы на соответствующей территории и находятся в свободном обращении, рекламные материалы, строго соответствующие локальному законодательству, а также иную научную информацию, которую мы посчитали полезной для размещения на соответствующем веб-сайте для Вашего ознакомления с такой информации в личных некоммерческих целях или для повышения Вашего профессионального уровня, если Вы являетесь медицинским, фармацевтическим работником или иным работником системы здравоохранения.
Тем не менее, обращаем Ваше внимание на то, что на локальных веб-сайтах соответствующей страны могут иметься ссылки на зарубежные веб-сайты компании «Верофарм». В таком случае названия, описания и маркировки продуктов могут иметь более тесную связь или быть созданы в соответствии с законодательством иной страны, которая не является страной вашего постоянного места жительства. Некоторые продукты могут быть доступны не во всех странах или быть доступны под другими торговыми наименованиями, в другой дозировке или с иными показаниями к применению. Многие из перечисленных продуктов могут отпускаться только по назначению местного специалиста в области здравоохранения.
В таком случае названия, описания и маркировки продуктов могут иметь более тесную связь или быть созданы в соответствии с законодательством иной страны, которая не является страной вашего постоянного места жительства. Некоторые продукты могут быть доступны не во всех странах или быть доступны под другими торговыми наименованиями, в другой дозировке или с иными показаниями к применению. Многие из перечисленных продуктов могут отпускаться только по назначению местного специалиста в области здравоохранения.
За исключением случаев, заранее согласованных компанией «Верофарм», директор, сотрудники, агенты или представители компании «Верофарм», ее дочерних компаний и филиалов, не принимают участия в проведении медицинских консультаций, диагностике, лечении или осуществлении иных медицинских услуг, которые могли бы создать какую бы то ни было взаимосвязь, как, например, «врач-пациент», посредством веб-сайтов компании «Верофарм». В любом случае никакая информация о наших продуктах, размещенная на наших веб-сайтах, не должна рассматриваться и пониматься как непосредственная консультация специалиста или замена такой консультации у соответствующего специалиста (врача).
Обращаем Ваше внимание на то, что у продуктов «Верофарм» имеются противопоказания к применению, поэтому перед их употреблением необходимо внимательно ознакомится с инструкцией по их применению и обратиться за консультацией врача.
Ни в коем случае информация, размещенная на веб-сайтах компании «Верофарм», не должна использоваться для самостоятельной диагностики Вашего здоровья и возможных заболеваний.
В соответствии с требованиями законодательства РФ, информация, расположенная в некоторых разделах веб-сайтов компании «Верофарм», может предназначаться исключительно для медицинских и фармацевтических работников, а также иных работников системы здравоохранения. В этом случае доступ к таким разделам может быть ограничен в соответствии с правилами, указанными в Правилах пользования разделом по рецептурным лекарственным средствам и медицинским изделиям, для использования которых требуется специальная подготовка.
Для входа в такие разделы компания «Верофарм» оставляет за собой право попросить Вас ответить на некоторые вопросы, связанные с медициной или фармацевтикой, и/или предоставить информацию путем осуществления дополнительной регистрации на веб-сайтах для целей подтверждения действительного статуса медицинского, фармацевтического работника или иного работника системы здравоохранения на момент посещения соответствующего веб-сайта.
Интеллектуальная собственность
Информация, документы и соответствующая графика, опубликованные на веб-сайтах компании «Верофарм» (далее — «Информация») являются исключительной собственностью компании «Верофарм», за исключением информации, предоставленной третьим лицом, связанным с компанией «Верофарм» контрактными взаимоотношениями. Разрешение на использование Информации предоставляется при условии, что (1) на всех копиях будет приведено ссылка на оригинальный источник и вышеупомянутое заявление об авторском праве; (2) Информация будет использоваться для информационных некоммерческих целей и только в рамках личного использования; (3) Информация не будет никаким образом изменяться; (4) графические изображения, представленные на данном веб-сайте компании «Верофарм», не будут использоваться отдельно от сопровождающего их текста.
Компания «Верофарм» не несет ответственности за информационное наполнение, предоставленное третьим лицом, и Вы не вправе использовать и распространять такие материалы без разрешения их правообладателей. За исключением описанных выше разрешенных случаев, никому не предоставляются никакие лицензии или права, явные и подразумеваемые, ни по каким патентам, торговым маркам или иным правам собственности компании «Верофарм».
За исключением описанных выше разрешенных случаев, никому не предоставляются никакие лицензии или права, явные и подразумеваемые, ни по каким патентам, торговым маркам или иным правам собственности компании «Верофарм».
Использование товарных знаков, торговых названий, фирменного стиля или продуктов компании «Верофарм» на веб-сайтах компании «ВЕРОФАРМ» не допускается без предварительного письменного разрешения компании «ВЕРОФАРМ».
КОНФИДЕНЦИАЛЬНОСТЬ И БЕЗОПАСНОСТЬ
Компания «Верофарм» обязуется сохранять конфиденциальность Вашей информации, переданной через настоящий веб-сайт. Мы осознаем важность конфиденциальности для наших потребителей и посетителей веб-сайтов компании «Верофарм». Использование нами персональных данных определяется нашей Политикой в отношении обработки персональных данных на веб-сайтах компании «Верофарм», свое согласие с которой Вы подтвердили, начав использовать веб-сайты компании «Верофарм».
Настоящим Вы признаете и согласны с тем, что при отправке Ваших персональных данных на веб-сайты компании «Верофарм», несмотря на то, что компания «Верофарм» располагает действенными мерами защиты для предотвращения неавторизованного доступа или вмешательства, абсолютная конфиденциальность Ваших персональных данных, предоставленных на веб-сайты компании «Верофарм», не может полностью зависеть от принятых компанией «Верофарм» мер.
В том маловероятном случае, если, несмотря на наши усилия, произойдет вмешательство или неавторизованный доступ, компания «Верофарм» не будет нести ответственности за подобное вмешательство или неавторизованный доступ в пределах, допустимых применимиым законодательством, а также за любой прямой, косвенный, особый, случайный или явившийся следствием ущерб (также упущенную выгоду), от которого пострадает потребитель или пользователь, даже в том случае, если ранее компания «Верофарм» была предупреждена о возможности такого ущерба, компания «Верофарм» не гарантирует прямо или косвенно, что информация, предоставленная пользователем, не подвергнется вмешательству или неавторизованному доступу, и не предоставляет никаких потенциальных гарантий относительно коммерческого качества и пригодности при применении для определенных целей.
Каждый пользователь несет самостоятельную ответственность за сохранение конфиденциальности своего пароля.
Ограничения ответственности
Компания «Верофарм» не принимает на себя никаких обязательств в отношении материалов, информации или мнений, представленных, направленных или иным путем попавших на веб-сайты компании «Верофарм». Вы можете полагаться на достоверность этих материалов, информации и мнений исключительно на свой риск. Компания «Верофарм» не несет ответственности за вред и/или ущерб, причиненный в результате использования веб-сайтов компании «Верофарм» или представленных на них материалов.
Вы можете полагаться на достоверность этих материалов, информации и мнений исключительно на свой риск. Компания «Верофарм» не несет ответственности за вред и/или ущерб, причиненный в результате использования веб-сайтов компании «Верофарм» или представленных на них материалов.
Веб-сайты компании «Верофарм», содержимое сайта, продукты и услуги, предоставляемые на сайтах или через веб-сайты компании «Верофарм» представлены в форме «как есть» и «по мере поступления», со всеми вытекающими последствиями. Ни в каком случае компания «Верофарм» или ее поставщики, или, соответственно, их руководители, сотрудники или агенты (именуемые ниже «лица, связанные с «Верофарм», не будут нести ответственность за какой-либо ущерб любого рода, возникший на основе или в связи с вашим использованием или неспособностью использовать веб-сайты компании «Верофарм».
А также материалов сайтов, услуги, предоставляемые на сайтах или через них, или на каких-либо связанных с ними сайтах, включая любой особый, косвенный, штрафной, случайный, присужденный в порядке наказания или явившийся следствием ущерб, в том числе (но не ограничиваясь этим) вред, потерю выгоды или ущерб, связанный с задержкой, временным прекращением услуг, вирусами, удалением файлов или электронных сообщений, ошибками, пропусками или другими неточностями на веб-сайтах компании «Верофарм» или в материалах сайтов, независимо от того, связано ли это с какими-либо упущениями со стороны компании «Верофарм» и была ли предупреждена компания «Верофарм» о возможности такого ущерба.
Помните, что к веб-сайтам компании «Верофарм» могут быть применены дополнительные официальные уведомления, заявления об отказе от ответственности и прочие правила и условия.
Общие положения
Настоящим Вы соглашаетесь, что настоящие Условия онлайн-использования и Политика в отношении обработки персональных данных на веб-сайтах компании «Верофарм» являются единым неделимым соглашением. Настоящим Вы соглашаетесь с тем, что, ознакомившись с настоящими Условиями онлайн-использования и Политикой в отношении обработки персональных данных на веб-сайтах компании «Верофарм». Вы подтверждаете свое согласие с ними, и уведомлены, что указанные Условия онлайн-использования, а также иные условия функционирования Веб-сайтов компании «Верофарм» регулируются в том числе законами штата Иллинойс и иными федеральными законами США.
Законы штата Иллинойс будут контролировать выполнение настоящих Условий онлайн-использования в той степени, в какой законы штата Иллинойс не противоречат императивным нормам законодательства Российской Федерации, в частности, законодательства о защите прав потребителя. В том случае, если компетентные судебные органы решат, что какое-либо положение настоящих Условий онлайн-использования недействительно или не имеет юридической силы, Вы соглашаетесь с тем, что остальные положения настоящих Условий онлайн-использования сохранят свою полную силу и действие.
В том случае, если компетентные судебные органы решат, что какое-либо положение настоящих Условий онлайн-использования недействительно или не имеет юридической силы, Вы соглашаетесь с тем, что остальные положения настоящих Условий онлайн-использования сохранят свою полную силу и действие.
В связи с вышеизложенным любыми Вашим действиями, направленными на использование Вами веб-сайтов компании «Верофарм» посредством Вашего доступа или иного использования веб-сайтов и содержащейся на них информации, Вы подтверждаете, что ознакомлены с настоящими Условиями онлайн-использования и полностью согласны с такими Условиями онлайн-использования. Таким образом, Вы автоматически принимаете на себя обязательства по их безусловному соблюдению и обеспечению их выполнения с Вашей стороны без каких-либо ограничений или оговорок в процессе Вашего посещения и использования веб-сайтов компании «Верофарм», а также любой информации, содержащейся на них.
Корпус для диска HPE XP7, большой форм-фактор (3,5″»), модернизация
Корпус для диска HPE XP7, большой форм-фактор (3,5″»), модернизация | HPE Store Russia
connect. hpe.com/visitor/v200/svrGP
hpe.com/visitor/v200/svrGP
50
2048
d6547807cf984896b000ad5232552b28
etrack.ext.hpe.com
secure.p01.eloqua.com/visitor/v200/svrGP
50
2048
10831b2db3a34b9ea5863b752a46bfad
C_EmailAddress,C_FirstName,C_LastName,C_BusPhone,C_Company,C_Address1,C_Address2,C_City,C_Zip_Postal,C_State_Prov,C_Country,C_Number_of_Employees1,C_Email_Opt_In1,C_Estimated_Budget1,C_Industry1,C_Language1,C_Lead_Source___Most_Recent1,C_Mail_Opt_in1,C_Mobile_Opt_in1,C_Phone_Opt_in1,C_MobilePhone,C_Timeframe_to_Buy1,C_Response_Type1,C_Purchase_Role1,C_Contact_Me_Request1,ContactIDExt
2
price.disclaimer.pten
Цены, предлагаемые местными реселлерами, могут отличаться.
Развернуть
Свернуть
https://connect.hpe.com/e/f2?nocache
ru
Наша система не смогла подтвердить правильность вашего адреса и не может найти его альтернативный вариант. Настоятельно рекомендуем изменить адрес и повторить попытку. Можно также продолжить с введенным вами адресом, если вы уверены в его правильности.
Можно также продолжить с введенным вами адресом, если вы уверены в его правильности.
true
addalertattachmentbookmarkbrand markcalculatorcalendardownnextcaret-nextcartchatcheckmarkplaycloseconfigurecontactcost savingscredit card securitycriticalcycledeliverdirectionsadd documentPDF documentdownduplicateeditexpansionfast forwardfilterfoldergridhost maintenanceinternal storageIT transformationlanguagelikedownnextnextpreviouslistlockmailmanagement softwarelocationmarket growthmemorymoneynextnotificationokoperating systemperformanceGoogleGooglepower supplypreviousprintprocessor + memoryprocessorresetreturnsavescorecardsearchdownserviceFacebookLinkedinLinkedinTwitterYoutubespinnerstandardssubtractsupporttrashtreeupuservirtual machinewarning
Реальный продукт может отличаться от представленного на изображении
№ артикула
H6F61AU
{«baseProduct»:{«productID»:»H6F61AU»,»productName»:»Корпус для диска HPE XP7, большой форм-фактор (3,5\»\»), модернизация»},»navigationList»:[«Опция»,»Варианты моделей/корпусов»,»Корпусы/модули систем хранения»,»Шасси HPE XP»,»Корпус для диска HPE XP7, большой форм-фактор (3,5\»\»), модернизация»],»cartDetail»:{},»productInfo»:[{«productInfo»:{«quantity»:»1″,»productID»:»H6F61AU»,»productName»:»Корпус для диска HPE XP7, большой форм-фактор (3,5\»\»), модернизация»}}]}
Дополнительные сведения
Связанные ссылки
Чем мы можем помочь?
Получите советы, ответы на вопросы и решения, когда они необходимы. По общим вопросам пишите на [email protected]
По общим вопросам пишите на [email protected]
Нашли то, что искали?
Нужна помощь в поиске оптимального продукта для вашего бизнеса?
Наши специалисты с удовольствием пообщаются с вами и помогут найти продукты и услуги, которые откроют новые возможности и решат проблемы вашего бизнеса.
Продолжить покупки
{«baseProduct»:{«productID»:»H6F61AU»,»productName»:»Корпус для диска HPE XP7, большой форм-фактор (3,5\»\»), модернизация»},»navigationList»:[«Опция»,»Варианты моделей/корпусов»,»Корпусы/модули систем хранения»,»Шасси HPE XP»,»Корпус для диска HPE XP7, большой форм-фактор (3,5\»\»), модернизация»],»cartDetail»:{},»productInfo»:[{«productInfo»:{«quantity»:»1″,»productID»:»H6F61AU»,»productName»:»Корпус для диска HPE XP7, большой форм-фактор (3,5\»\»), модернизация»}}]}
H6F61AU
Для сравнения можно добавить до 4 товаров.

ГК РФ Статья 831. Права финансового агента (фактора) на суммы, полученные от должника / КонсультантПлюс
ГК РФ Статья 831. Права финансового агента (фактора) на суммы, полученные от должника
(в ред. Федерального закона от 26.07.2017 N 212-ФЗ)
Перспективы и риски арбитражных споров. Ситуации, связанные со ст. 831 ГК РФ
1. Если уступка денежного требования по договору факторинга осуществлена в целях приобретения этого требования финансовым агентом (фактором), последний приобретает право на все суммы, которые он получит от должника во исполнение указанного требования, а клиент не несет ответственности перед финансовым агентом (фактором) за то, что полученные им суммы оказались меньше цены, за которую агент приобрел указанное требование, если иное не предусмотрено договором.
2. Если уступка денежного требования финансовому агенту (фактору) осуществлена в целях обеспечения исполнения обязательства клиента перед финансовым агентом (фактором) и договором факторинга не предусмотрено иное, финансовый агент (фактор) обязан представить отчет клиенту и после получения исполнения от должника передать клиенту сумму, превышающую сумму долга клиента, обеспеченную уступкой требования. В силу уступки денежного требования в целях обеспечения исполнения обязательства клиента при получении финансовым агентом (фактором) денежных средств от должника по уступленному финансовому агенту (фактору) клиентом денежному требованию обязательство клиента перед финансовым агентом (фактором) считается надлежащим образом исполненным в том объеме, в котором должник исполнил свое обязательство перед финансовым агентом (фактором). Если денежные средства, полученные финансовым агентом (фактором) от должника, оказались меньше суммы долга клиента финансовому агенту (фактору), обеспеченной уступкой требования, клиент остается ответственным перед финансовым агентом (фактором) за остаток своего долга.
В силу уступки денежного требования в целях обеспечения исполнения обязательства клиента при получении финансовым агентом (фактором) денежных средств от должника по уступленному финансовому агенту (фактору) клиентом денежному требованию обязательство клиента перед финансовым агентом (фактором) считается надлежащим образом исполненным в том объеме, в котором должник исполнил свое обязательство перед финансовым агентом (фактором). Если денежные средства, полученные финансовым агентом (фактором) от должника, оказались меньше суммы долга клиента финансовому агенту (фактору), обеспеченной уступкой требования, клиент остается ответственным перед финансовым агентом (фактором) за остаток своего долга.
3. Если уступка денежного требования осуществлена в целях оказания финансовым агентом (фактором) клиенту услуг, связанных с денежными требованиями, являющимися предметом уступки, финансовый агент (фактор) обязан представить отчет клиенту и передать ему все суммы, полученные во исполнение уступленных денежных требований, а клиент обязан оплатить оказанные услуги.
4. Финансовый агент (фактор) вправе при передаче клиенту денежных средств предъявить к зачету свои денежные требования по договору.
Открыть полный текст документа
Х фактор 10 сезон 2020: смотреть онлайн
Шоу Х-Фактор — одно из самых популярных шоу в мире. Проект покорил десятки стран и Украина не стала исключением. Вот уже 6 сезон, как телеканал СТБ дает шанс тысячам талантливых исполнителей воплотить свою мечту в реальность, выступить на большой сцене, покорить многомиллионную аудиторию и выиграть главный приз. Мы открываем миру лучшие, сильнейшие голоса, новых артистов, блистательных звезд.
Прекрасная Оксана Марченко — украшение каждого прямого эфира Х-Фактора, и не только 6 сезона. Бессменная ведущая шоу поддерживает участников на протяжении всех сезонов шоу. Экспертные жюри шоу xfactor оценивают вокальные данные участника, манеру исполнения, умение держаться на большой сцене, создавать связь со зрительным залом. После прохождения тренировочного лагеря и отборочного тура, все участники распределяются по категориям и дальше их развитием и подготовкой к прямым эфирам, выбором песни для исполнения и образа для выступления занимаются члены жюри. Лирические и заводные, классические и современные, зарубежные и отечественные — на сцене X-Фактора звучат всемирно известные песни.
После прохождения тренировочного лагеря и отборочного тура, все участники распределяются по категориям и дальше их развитием и подготовкой к прямым эфирам, выбором песни для исполнения и образа для выступления занимаются члены жюри. Лирические и заводные, классические и современные, зарубежные и отечественные — на сцене X-Фактора звучат всемирно известные песни.
Для подготовки к очередному эфиру xfactor у команды телеканала и участников есть всего неделя, однако, несмотря на сжатые сроки, в день прямого эфира шоу все проходит идеально. Невероятные спецэффекты, освещение и декорации создают особую атмосферу. Образ участников продуман до мелочей, что уж говорить о выборе песен для исполнения — они наиболее полно отражают их талант. Каждый прямой эфир шоу X-Фактор закрывается телефонным голосованием телезрителей, по результатам которого и определяется судьба участников — кто покинет проект, а кто продолжит борьбу дальше.
Все выпуски проекта Икс фактор вы можете смотреть онлайн, в день прямого эфира, поэтому увидеть выступление любимого участника и обсудить его выступление вы можете прямо на нашем сайте, онлайн.
К тому же, можно не только бесплатно смотреть видео Икс фактор онлайн, но и испытать свои силы в онлайн-проекте “X factor Онлайн”. Итак, чтобы выступить на большой сцене, не обязательно приходить на реальный кастинг, достаточно просто зайти на онлайн-версию проекта. Просматривайте видео других участников, голосуйте за понравившегося исполнителя и записывайте собственное видео.
Все факты об участнике, его биографию и, конечно же, видео всех его выступлений вы также найдете на нашей онлайн-версии проекта X factor. Становитесь частью нашей большой семьи, присоединяйтесь к нашей фан-зоне и, конечно же, отдавайте свои голоса за любимого участника.
Свернуть
Трансфер фактор — иммунитет от самой природы.
Мощная и хорошо функционирующая иммунная система это, прежде всего, здоровый образ жизни, который включает в себя здоровое питание, ведение активного образа жизни, правильный отдых, отсутствие стрессов. Но мы недаром упомянули об ухудшающейся экологии на планете. Пришло время когда человек уже не может обойтись без иммунных препаратов, которые снабжают организм, необходимыми для нормального функционирования, биоактивными элементами. Трансфер фактор 4life — один из таких препаратов и, пожалуй, самый эффективный из них.
Пришло время когда человек уже не может обойтись без иммунных препаратов, которые снабжают организм, необходимыми для нормального функционирования, биоактивными элементами. Трансфер фактор 4life — один из таких препаратов и, пожалуй, самый эффективный из них.
Состав Трансфер фактора
В 1949 году, тогда еще неизвестный доктор Шервуд Лоуренс сделал открытие, которое впоследствии стало революционным для иммунологии. Он установил, что иммунный опыт имеет возможность передаваться от одного организма к другому вместе с информацией, которую тот или иной организм накопил о различных вирусах и микробах, с которыми он соприкасался и боролся на всем протяжении своего существования. Носителями этой «иммунной памяти» являются молекулы, имеющие очень маленький размер и массу — около 5 килодальтонов, состоящие из 44 аминокислот. Этим молекулам дали название трансфер факторы (факторы переноса).
Как оказалось, так формируется изначальный иммунитет младенца: путем передачи его от матери с помощью этих удивительных молекул. Именно по этим молекулам и был назван наш препарат — Трансфер фактор. Состав его уникален: он содержит три фракции, которые, в свою очередь, выполняют различные функции и эти функции очень важны для обеспечения эффективной деятельности иммунитета:
Именно по этим молекулам и был назван наш препарат — Трансфер фактор. Состав его уникален: он содержит три фракции, которые, в свою очередь, выполняют различные функции и эти функции очень важны для обеспечения эффективной деятельности иммунитета:
-Индукторы. Они отвечают за обеспечение общей готовности иммунной системы, стимулируют Т-клеточный иммунитет и приводят к усилению функции натуральных клеток-киллеров организма.
-Супрессоры. Регулируют и подавляют гиперактивный иммунный ответ организма, при этом предотвращая аутоиммунные реакции.
-Антигены. Они дают возможность иммунитету заблаговременно идентифицировать многие болезнетворные микроорганизмы.
Вот поэтому Трансфер фактор, состав которого не имеет больше аналогов ни в одном другом иммунном препарате, является уникальным иммуномодулятором.
Функции Трансфер фактора
Прежде чем принимать любой препарат, его необходимо тщательно изучить и в первую очередь, понять его функции. Не является исключением из этого правила и Трансфер фактор. Функции этого иммуномодулятора охватывают весь спектр проблем иммунной системы (ИС). Но рассмотрим это подробнее:
Не является исключением из этого правила и Трансфер фактор. Функции этого иммуномодулятора охватывают весь спектр проблем иммунной системы (ИС). Но рассмотрим это подробнее:
1. Первая и главная функция препарата заключается в усилении иммунного ответа организма в случаях его иммунодефицитного состояния. К этому состоянию относятся, главным образом, инфекционные заболевания (простуды, ОРЗ, ангина, гриппы). Кстати, СПИД, туберкулез тоже являются следствием иммунодефицитного состояния организма.
2. Вторая функция — это подавление и оптимизация иммунного ответа при аутоиммунных заболеваниях. В этом случае ИС воспринимает ткани своего организма за чужеродные и начинает атаковать их. Проявлением этого состояния являются, прежде всего, все аллергические заболевания.
3. Третья функция — запоминание и распознавание различных вирусов и болезнетворных микробов посредством передачи иммунной информации между клетками организма. В результате чего образуется память иммунитета и, в случае атаки на организм, иммунная система извлекает из своей картотеки файл с записями о той или иной болезни, с которой ему приходилось справляться, и, имея данные о методе действия противника, с большим эффектом справляется с ним.
Применение Трансфер фактора и его свойства
Трансфер фактор — инструкция для нашего иммунитета, это прекрасное средство для поддержания иммунной системы при лечении большого количества заболеваний: иммунодефицитных, аутоиммунных, вирусных, инфекционных, хронических, гепатита, герпеса, язвенной болезни, кожных, нервных, заболеваний опорно-двигательного аппарата, онкологических, туберкулеза, диабета, аллергии и.т.д. При комплексном применении с другими препаратами, например антибиотиками в сочетании с препаратом Трансфер фактор, лечение дает наиболее видимый и более устойчивый результат.
Трансферфактор не лечит болезнь, он дает возможность организму самому справиться с причиной заболевания, работая непосредственно с иммунитетом, путем передачи информации о патогенах и активизируя иммунную систему для обнаружения и борьбы с причиной заболевания. Препарат Трансфер фактор, действие которого становиться наиболее эффективным еще из за того, что его применение полностью сводит на нет побочное воздействие антибиотиков и уменьшает длительность течения болезни, за счет ускорения иммунного ответа организма. При этом сам ТФ совершенно не вызывает аллергий и индивидуальной непереносимости, не имеет передозировок. От его применения нет эффекта привыкания и зависимости, он совершенно не токсичен и безвреден абсолютно для всех, даже при самых больших дозах. Может применяться беременными женщинами и детьми с самого рождения.
При этом сам ТФ совершенно не вызывает аллергий и индивидуальной непереносимости, не имеет передозировок. От его применения нет эффекта привыкания и зависимости, он совершенно не токсичен и безвреден абсолютно для всех, даже при самых больших дозах. Может применяться беременными женщинами и детьми с самого рождения.
Эта безопасность обуславливается тем, что из 50 кг сухого молозива вырабатывают всего лишь 1 кг чистейшего трансферфактора . В процессе переработки отделяют 49 килограмм различных веществ, и такая технология обработки позволяет получить, поистине, натуральный и качественный продукт. Безопасность препарата подтверждена и доказана медицинскими исследованиями, признанием специалистов во многих областях медицины и практическим опытом применения.
Трансфер фактор: стоимость и продажа
Препарат с каждым годом пользуется все большим спросом и сейчас уже более чем в 65 странах мира можно купить Трансфер фактор. Цена препарата варьируется в зависимости от его типа и количества капсул в упаковке. Упаковки бывают по 30, 60, 90, 120 капсул. Более подробную информацию и цены можно посмотреть на нашем сайте, так же на нашем сайте Вы можете заказать Трансфер фактор.
Упаковки бывают по 30, 60, 90, 120 капсул. Более подробную информацию и цены можно посмотреть на нашем сайте, так же на нашем сайте Вы можете заказать Трансфер фактор.
Купить препарат можно осуществив заказ через сайт, либо связавшись с нашим менеджером по телефону. Доставка осуществляется курьером, либо по почте наложенным платежом. Продажа препарата производиться только через официальных дистрибьюторов компании-производителя препарата 4 Life Research, что гарантирует подлинность и адекватную цену, без накруток и промежуточных точек между производителем и конечным потребителем продукта.
Не является лекарством (БАД).
Трансфер фактор: отзывы
Конечно же, ничего не может дать более высокую оценку продукту, чем та польза, которую он принес и те результаты, которые от него получили.
Трансфер фактор, отзывы о котором мы постоянно получаем от тех людей, которые его принимали и принимают, действительно, по своей эффективности превосходит любой другой иммунный препарат. Всю эту информацию Вы можете получить в разделе Отзывы или Отзывы ученых.
Всю эту информацию Вы можете получить в разделе Отзывы или Отзывы ученых.
Вы можете купить Трансфер фактор, оформив заказ на сайте или по телефону 8 (495) 642-52-96.
Фактор отличия
Коммерческая
19.12
В течение всего года мы анализировали коммерческий облик самых развитых с позиции стрит-ритейла улиц города.
Жилая
10.10
Чтобы увидеть, как локация может влиять на цену жилья, можно обратиться к актуальной экспозиции недвижимости на окраине.
Загородная
10.10
Как выглядят самые доступные предложения на городских просеках?
Коммерческая
09. 10
10
Коммерческий потенциал улицы Победы неминуемо сдувается, уверены скептики.
Коммерческая
12.09
Сегодня в Самаре есть только один крупный торговый центр, который может похвастаться 100%-й укомплектованностью арендаторами.
Коммерческая
12.09
Проспект Масленникова можно отнести к городским местам былой коммерческой славы
Жилая
11.09
«Ты — мне, я – тебе» — этот принцип, подразумевающий чистый обмен на рынке жилой недвижимости?
Загородная
08. 09
09
С чего начать поиск земельного участка для ИЖС или садоводства?
Коммерческая
12.07
. Стоит ли связывать это с затянувшимися экономическими сложностями в стане арендаторов?
Какие бывают форм-факторы корпусов для ПК | Корпусы | Блог
Компактная реализация, сетчатая панель или, может быть, продуманный кабель менеджмент? Разнообразие корпусов представленных в продаже позволяет подобрать устройство под любые нужды. Главное — определить круг требований предъявляемых к устройству. Но, несмотря на все это множество, самым распространенным остается классический вариант исполнения — Tower. О его различных вариациях мы и поговорим в данном материале.
Какие бывают форм-факторы корпусов Tower для ПК
Корпуса Tower подразделяются на несколько типоразмеров примерно одинаковой высоты. Но на деле размеры корпуса могут немного отличаться от типичного стандарта, потому что каждый производитель хочет «удивить» покупателя дизайном и внутренним наполнением изделия. Косвенно это касается и форм-фактора совместимых плат. Посадочные места под них остаются неизменными из-за унификации, хотя размер самих плат может варьироваться в зависимости от производителя и модели.
Но на деле размеры корпуса могут немного отличаться от типичного стандарта, потому что каждый производитель хочет «удивить» покупателя дизайном и внутренним наполнением изделия. Косвенно это касается и форм-фактора совместимых плат. Посадочные места под них остаются неизменными из-за унификации, хотя размер самих плат может варьироваться в зависимости от производителя и модели.
Full-Tower
Большое количество накопителей, плат расширения или массивное кастомное жидкостное охлаждение — типоразмер Full-Tower позволяет воплотить любую задумку. Высота корпусов данного типоразмера превышает 50 см, а количество слотов расширения, как правило, более восьми. В среднем в таких корпусах бывает от четырех до восьми отсеков для накопителей 3.5, но некоторые модели позволяют разместить и вовсе 12 штук. Поддерживаются материнские платы крупного форм-фактора XL-ATX и E-ATX, а также стандартные форм-факторы в виде Standard, Micro и Mini. Данный типоразмер подойдет для создания высокопроизводительного игрового ПК или рабочей станции.
За счет внушительных размеров можно без проблем устанавливать крупные видеокарты и системы охлаждения, но для этого придется более тщательно выбирать блок питания — с достаточной длиной проводов.
Намного реже встречаются типоразмеры Super-Tower и Ultra-Tower. Они крупнее Full-Tower и в бытовых сборках встречаются довольно редко. Высота таких корпусов — 65 см и более. Они подойдут для двухпроцессорных систем, серверов и иных узконаправленных специализированных задач.
Midi-Tower
Midi-Tower — самая массовая вариация типоразмера Tower. Причина тому — удачное сочетание функциональности и размера. Подобрать Midi-Tower можно практически под любые запросы. Как правило, в таких корпусах можно разместить любые материнские платы — от Mini-ITX до E-ATX, а также до трех устройств в отсеки 5.25. Высота корпуса может варьироваться от 40 до 50 см, а ширина от 20 до 25 см. Количество слотов расширения в среднем составляет шесть или семь штук, а для размещения накопителей 3. 5 предусмотрено от двух и более посадочных мест.
5 предусмотрено от двух и более посадочных мест.
Midi-Tower — универсальный типоразмер, который подойдет для сборки офисного, домашнего и даже игрового ПК. В общей своей массе корпуса данного типоразмера дешевле своих более крупных и более мелких собратьев.
Mini-Tower
Mini-Tower и Micro-Tower незначительно отличаются друг от друга в размерах. Это компактная альтернатива более крупным корпусам Tower. Как правило, в таких корпусах всего один отсек под устройства 5.25, а под установку накопителей 3.5 редко выделено более двух отсеков. Высота данного типоразмера в среднем 30–37 см, что сказыается на количестве слотов расширения — их обычно три или четыре. Также есть ограничения и по форм-фактору совместимых плат — поддерживаются только Mini-ITX и Micro-ATX.
Mini-Tower — хорошая альтернатива Midi-Tower, если нужен простой многофункциональный ПК или крепкий игровой «середнячок». Такие корпуса занимают меньше места на рабочем столе.
SFF
Бывают еще более скромные по размеру корпуса. Эту отдельную категорию обозначают SFF — малый форм-фактор. Их размеры обычно измеряются не высотой и шириной, а литрами — объемом внутреннего пространства.
Эту отдельную категорию обозначают SFF — малый форм-фактор. Их размеры обычно измеряются не высотой и шириной, а литрами — объемом внутреннего пространства.
SFF корпуса могут быть реализованы в следующих видах:
Mini-tower — стандартная компоновка, как у более крупного варианта, о котором говорилось выше, но с уменьшенной высотой.
Desktop — узкие, но с высотой примерно такой же, как у полноразмерных версий. Видеокарта в такой реализации, как правило, располагается на одной линии с материнской платой. Такие корпуса можно расположить как вертикально, так и горизонтально.
Cube — корпус в виде небольшого «куба», где материнская плата располагается горизонтально.
Сэндвич — приближенный к Mini-tower вариант, но в такой реализации плата и видеокарта разделены перегородкой, образующей своеобразный «бутерброд».
Из-за своих малых габаритов SFF-корпуса поддерживают установку лишь самых небольших материнских плат форм-фактора Mini-ITX. Система хранения в виде жестких дисков формата 3.5 сильно ограничена. SFF позволяют сэкономить место при малой площади рабочего места, их легко можно поместить в рюкзак и взять с собой, например, в рабочие поездки. Такие корпуса отлично подойдут для основы ПК в виде домашнего кинотеатра, офисного и даже игрового решения. Все зависит от того, какие комплектующие подберет пользователь.
Система хранения в виде жестких дисков формата 3.5 сильно ограничена. SFF позволяют сэкономить место при малой площади рабочего места, их легко можно поместить в рюкзак и взять с собой, например, в рабочие поездки. Такие корпуса отлично подойдут для основы ПК в виде домашнего кинотеатра, офисного и даже игрового решения. Все зависит от того, какие комплектующие подберет пользователь.
06,13.05,0,24,0,24s0.06,10.95,1.48,16.26c0.78,2.93,2.49,5.41,5.42,6.19 C12.21,47.87,34,48,34,48s21.79-0.13,27.1-1.55c2.93-0.78,4.64-3.26,5.42-6.19C67.94,34.95,68,24,68,24S67.94,13.05,66.52,7.74z’></path><path fill=#fff d=’M 45,24 27,14 27,34′></path></svg></a>» frameborder=»0″ allow=»accelerometer; autoplay; encrypted-media; gyroscope; picture-in-picture» allowfullscreen=»»/>
Сложности игровых сборок в компактных корпусах
Несмотря на размеры, SFF-корпуса позволяют собирать в них высокопроизводительные игровые решения. Но компактность несет в себе ряд проблем, с которыми пользователь столкнется при сборке.
Во-первых, необходимо заранее спланировать порядок установки комплектующих. При неправильном подходе придется снимать некоторые детали, чтобы подобраться к нужной. Во-вторых, важен кабель-менеджмент. Тут уже не получится просто бросить подключенную связку проводов как попало — боковые крышки могут попросту не закрыться.
В-третьих, подбор комплектующих. Для SFF выбор ограничен рамками размера Mini-ITX-плат. Также могут возникнуть проблемы и с охлаждением. Конечно, корпуса с большой шириной — Mini-tower и Cube — позволяют вместить крупногабаритные башенные кулеры, так что здесь выбрать будет просто. Но когда речь заходит об узких версиях корпусов, то могут возникнуть некоторые трудности. От башенной конструкции придется отказаться и свести выбор к версиям с горизонтальной реализацией. Такие системы охлаждения предсказуемо проигрывают по рассеиванию тепла «башням» в этой же ценовой категории.
Примерно та же ситуация и с видекартами. Корпуса Mini-tower и Сэндвич вместят и крупногабаритные карты с тремя вентиляторами. А в более мелких и узких корпусах придется ограничиться одновентиляторной версией — о топовой видеокарте можно забыть. Но здесь могут пригодиться турбинные модели, которые зачастую обходят стороной обладатели полноразмерных корпусов. В условиях тесного расположения комплектующих система охлаждения с прямым выбросом нагретого воздуха за пределы корпуса будет весьма полезной, хотя и немного шумной.
Ограничения коснутся и выбора блока питания. Выбор блоков питания формата SFX, которые являются уменьшенной версий стандартного ATX-блока для компактных корпусов, очень скудный. Качественные модели с наиболее востребованной номинальной мощностью в 500–650 Вт появляются в очень небольшом количестве и моментально исчезают. Именно эта особенность может поставить крест на сборке небольшого ПК.
Форм-факторы платформы
У каждого типоразмера корпуса имеется конкретный список поддерживаемых форм-факторов материнских плат. Ниже представлена таблица с типовыми значениями для каждой платформы.
| XL-ATX | E-ATX | Standard-ATX | Micro-ATX | Mini-ITX | |
| Ultra/Super Tower | + | + | + | + | + |
| Full-Tower | + | + | + | + | + |
| Midi-Tower | — | + | + | + | + |
| Mini/Micro-Tower | — | — | — | + | + |
Standard-ATX
Многолетний стандарт материнских плат — Standard-ATX. Это полноразмерные платы 305х244 мм, выбор которых весьма обширен. Данный форм-фактор позволяет при желании разместить восемь устройств в разъемах M.2. Количество слотов для модулей оперативной памяти может быть как стандартным — четыре разъема, так и продвинутым — восемь слотов, что актуально для старших чипсетов, которые используются в рабочих станциях. Как правило, платы Standard-ATX имеют на борту множество интерфейсов для подключения и слотов расширения PCI-E, что служит большим подспорьем для пользователя.
Это полноразмерные платы 305х244 мм, выбор которых весьма обширен. Данный форм-фактор позволяет при желании разместить восемь устройств в разъемах M.2. Количество слотов для модулей оперативной памяти может быть как стандартным — четыре разъема, так и продвинутым — восемь слотов, что актуально для старших чипсетов, которые используются в рабочих станциях. Как правило, платы Standard-ATX имеют на борту множество интерфейсов для подключения и слотов расширения PCI-E, что служит большим подспорьем для пользователя.
Данный форм-фактор плат можно использовать для разнообразнейших сборок ПК. Мощные игровые решения, серверы с множеством накопителей или рабочие станции с несколькими видеокартами.
Более крупные версии данного форм-фактора — E-ATX и XL-ATX. E-ATX представляет собой расширенную вбок плату ATX с типоразмером 305х330 мм. В свою очередь XL-ATX расширена не только вбок, но и в высоту. Ее размер — 345х262 мм. Эти платы предназначены для ультимативных решений на старших чипсетах.
Micro-ATX
Micro-ATX — своеобразная золотая середина среди материнских плат. За счет более компактных размеров в этом форм-факторе может не быть пары PCI-E слотов, которые зачастую не используются, а вот система питания остается неизменной — от старшей модели. Стандартный размер платы Micro-ATX — 244х244 мм. Слотов для установки модулей оперативной памяти обчно 2–4. Меньше всего слотов, как правило, у бюджетных моделей.
На основе материнских плат Micro-ATX можно собирать высокопроизводительные ПК разной направленности, но с некоторыми нюансами. Из-за меньшего количества слотов расширения и более плотной компоновки схем не всегда удастся разместить одновременно всё необходимое, а количество разъемов SATA и M.2, как правило, уступает полноразмерной плате Standard-ATX.
Mini-ITX
Материнские платы Mini-ITX размером всего в 170х170 мм являются отличным решением для компактной сборки, хотя и немного ограничены по функционалу. Количество слотов для модулей оперативной памяти не может быть больше двух, разъемов на задней панели и для накопителей, как правило, меньше, чем у более крупных плат. Но самый явный нюанс — всего один слот PCI-Е.
Но самый явный нюанс — всего один слот PCI-Е.
На основе платы Mini-ITX можно собрать как производительный ПК, так и вариант попроще для офиса или мультимедийной системы. Еще одной вариацией мини-плат является Mini-STX с размером 140х140 мм. Данный вариант предназначен для ультракомпактных систем, а его отличительная особенность — использование модулей оперативной памяти от ноутбука и внешних блоков питания.
Еще одной вариацией мини-плат является Mini-STX с размером 140х140 мм. Данный вариант предназначен для ультракомпактных систем, а его отличительная особенность — использование модулей оперативной памяти от ноутбука и внешних блоков питания.
Корпуса бывают самых разных размеров и форм. Главный вопрос — что нужно вам. Если это простое решение для домашних задач, то можно вполне ограничиться самым маленьким SFF-корпусом, чтобы было компактно и симпатично. А вот геймерам и создателям качественного профессионального контента нужно хорошо подумать: стоит ли компактность тех ухищрений, к которым придется прибегнуть, чтобы собрать производительную машину.
границ | Белки семейства фактора Н в комплементе Уклонение от микроорганизмов
Введение
Врожденные и адаптивные иммунные механизмы работают совместно, эффективно уничтожая проникающие микроорганизмы и развивая иммунную память. В свою очередь, патогенные микробы во время своей совместной эволюции с организмами-хозяевами приобрели различные средства уклонения от иммунных ответов хозяина. Система комплемента, основное гуморальное звено врожденного иммунитета, включает около 40 белков, закрепленных в плазме и клеточных мембранах, которые действуют каскадным образом, опсонизируя микробы и облегчая их фагоцитоз, активируя клеточные ответы, инициируя воспаление или непосредственно разрушая определенные микробы. пробив в них отверстия (1).Комплемент может активироваться тремя основными путями: классическим, лектиновым и альтернативным. Молекулы распознавания путей инициируют активацию, взаимодействуя с ферментативно активными компонентами, которые распространяют каскад и генерируют активные фрагменты и комплексы комплемента, которые опосредуют биологические эффекты системы (рис. 1А) (2).
Система комплемента, основное гуморальное звено врожденного иммунитета, включает около 40 белков, закрепленных в плазме и клеточных мембранах, которые действуют каскадным образом, опсонизируя микробы и облегчая их фагоцитоз, активируя клеточные ответы, инициируя воспаление или непосредственно разрушая определенные микробы. пробив в них отверстия (1).Комплемент может активироваться тремя основными путями: классическим, лектиновым и альтернативным. Молекулы распознавания путей инициируют активацию, взаимодействуя с ферментативно активными компонентами, которые распространяют каскад и генерируют активные фрагменты и комплексы комплемента, которые опосредуют биологические эффекты системы (рис. 1А) (2).
Рисунок 1. Пути комплемента и семейство белков человеческого фактора H (FH). (A) Схематический обзор основных путей активации и регуляции комплемента.Молекулы, действующие как ингибиторы комплемента, показаны красным цветом. (B) Пять белков, родственных FH человека (FHR), сохранили домены, гомологичные доменам 6–9 и 18–20 контрольного белка FH (показано вертикальным выравниванием). Цвета обозначают домены, идентичные между FH и FHR; светлые оттенки указывают на высокое сходство последовательностей (>80% идентичности), но не на полную идентичность. Домены, отмеченные зеленым, тесно связаны друг с другом, но лишь отдаленно связаны с FH и опосредуют димеризацию FHR-1, FHR-2 и FHR-5.Функциональные участки в FH показаны горизонтальными линиями. FH-подобный белок 1 (FHL-1) представляет собой вариант сплайсинга FH.
Цвета обозначают домены, идентичные между FH и FHR; светлые оттенки указывают на высокое сходство последовательностей (>80% идентичности), но не на полную идентичность. Домены, отмеченные зеленым, тесно связаны друг с другом, но лишь отдаленно связаны с FH и опосредуют димеризацию FHR-1, FHR-2 и FHR-5.Функциональные участки в FH показаны горизонтальными линиями. FH-подобный белок 1 (FHL-1) представляет собой вариант сплайсинга FH.
Поскольку комплемент представляет собой мощную систему, облегчающую разрушение микробов или других клеток-мишеней, клетки-хозяева и ткани защищены различными комбинациями белков, регулирующих жидкую фазу и мембранный комплемент, которые точно настраивают и/или блокируют этапы активации каскада комплемента, ограничивают активация как во времени, так и в пространстве, и предотвратить потенциальные вредные последствия полномасштабной чрезмерной активации (рис. 1А) (3).Большинство регуляторных белков комплемента являются негативными регуляторами, то есть ингибиторами различных стадий активации, включая растворимые регуляторы С1-ингибитор, С4b-связывающий белок, фактор H (FH), витронектин и кластерин, а также заякоренные на мембране регуляторы рецептора комплемента типа 1. , белок мембранного кофактора, фактор ускорения распада и CD59. Пропердин является положительным регулятором активации комплемента. Недавно FH-родственные (FHR) белки появились как дополнительные позитивные регуляторы, которые способствуют активации системы, особенно альтернативного пути (4, 5).
, белок мембранного кофактора, фактор ускорения распада и CD59. Пропердин является положительным регулятором активации комплемента. Недавно FH-родственные (FHR) белки появились как дополнительные позитивные регуляторы, которые способствуют активации системы, особенно альтернативного пути (4, 5).
Семейство белков FH человека
Фактор H представляет собой консервативный гликопротеин плазмы, который ингибирует альтернативный путь и петлю амплификации (6, 7). Связываясь с C3b, основным продуктом расщепления центрального компонента комплемента C3, FH предотвращает сборку фермента конвертазы C3 альтернативного пути C3bBb, облегчает распад конвертазы, если она уже образовалась, путем вытеснения связанного Bb из C3b (активность, ускоряющая распад), и действует как кофактор фактора I сериновой протеазы плазмы, который затем расщепляет C3b до неактивной формы iC3b (активность кофактора).Взаимодействие FH с C3b также позволяет регулировать конвертазы C5.
Фактор H состоит из 20 доменов белка, контролирующего комплемент (CCP), с индивидуальной укладкой. Активность регуляции комплемента FH опосредована N-концевыми доменами CCP1-4, которые содержат сайт связывания C3b (8). CCP7 содержит сайты связывания для определенных лигандов, включая гликозаминогликаны на клеточных поверхностях хозяина, пентраксины и эпитопы малонового диальдегида (MDA), образующиеся в результате перекисного окисления липидов. С-концевые домены CCP19-20 содержат сайты связывания для C3b/C3d, пентраксинов и сиаловой кислоты/гликозаминогликанов и, таким образом, закрепляют FH на поверхности хозяина при атаке комплемента (т.э., с депонированным C3b) (9–11). Это позволяет FH ограничивать активацию комплемента на клетках-хозяевах, а также на неклеточных поверхностях, лишенных мембранных регуляторов комплемента, таких как базальные мембраны. Таким образом, FH выполняет важную функцию в различении себя и чужого, распознавая специфические поверхности хозяина (12, 13).
Активность регуляции комплемента FH опосредована N-концевыми доменами CCP1-4, которые содержат сайт связывания C3b (8). CCP7 содержит сайты связывания для определенных лигандов, включая гликозаминогликаны на клеточных поверхностях хозяина, пентраксины и эпитопы малонового диальдегида (MDA), образующиеся в результате перекисного окисления липидов. С-концевые домены CCP19-20 содержат сайты связывания для C3b/C3d, пентраксинов и сиаловой кислоты/гликозаминогликанов и, таким образом, закрепляют FH на поверхности хозяина при атаке комплемента (т.э., с депонированным C3b) (9–11). Это позволяет FH ограничивать активацию комплемента на клетках-хозяевах, а также на неклеточных поверхностях, лишенных мембранных регуляторов комплемента, таких как базальные мембраны. Таким образом, FH выполняет важную функцию в различении себя и чужого, распознавая специфические поверхности хозяина (12, 13).
FH-подобный белок 1 (FHL-1) получен из альтернативного транскрипта гена CFH и включает семь N-концевых CCP FH плюс четыре аминокислоты на его C-конце. FHL-1 разделяет с FH способности ингибировать комплемент и лиганд-связывать, связанные с этими доменами, но также может проявлять функциональные различия, которые необходимо более точно определить в будущем (14).
FHL-1 разделяет с FH способности ингибировать комплемент и лиганд-связывать, связанные с этими доменами, но также может проявлять функциональные различия, которые необходимо более точно определить в будущем (14).
У человека пять генов CFHR находятся рядом с геном CFH и кодируют пять различных белков FHR. Эти белки имеют структурную гомологию с FH; однако у них отсутствуют домены, гомологичные CCP 1-4 FH, которые ответственны за активность ингибирования комплемента (Рис. 1В).Первоначальные исследования FHR изучали их способность ингибировать комплемент, и для всех них действительно была описана некоторая форма — как правило, слабой — активности. Сообщалось, что FHR-1 ингибирует C5 и терминальный путь (15), FHR-2 должен ингибировать конвертазу C3 альтернативного пути и активировать терминальный путь (16), FHR-3 и FHR-4 должны усиливать активность кофактора. FH (17), FHR-3 также должен был обладать активностью кофактора сам по себе (18), а FHR-5 должен был проявлять слабую активность кофактора и ингибировать конвертазу C3 в жидкой фазе (19). Однако некоторые из описанных активностей не были подтверждены другими исследованиями, например, ингибирование терминального пути с помощью FHR-1 (20–22). В целом, белки FHR, по-видимому, не обладают значительной активностью, ингибирующей комплемент (4), но необходимы дальнейшие исследования, чтобы выяснить, обладают ли какие-либо из FHR той или иной формой такой активности. Поскольку было показано, что FHR взаимодействуют с C3b, они могут модулировать деградацию C3b, конкурируя с FH, но могут также мешать сборке и/или активности C3b, содержащих ферменты конвертазы (т.е., конвертаза C3 альтернативного пути и конвертазы C5), как предполагается для FHR-5 и FHR-2.
Однако некоторые из описанных активностей не были подтверждены другими исследованиями, например, ингибирование терминального пути с помощью FHR-1 (20–22). В целом, белки FHR, по-видимому, не обладают значительной активностью, ингибирующей комплемент (4), но необходимы дальнейшие исследования, чтобы выяснить, обладают ли какие-либо из FHR той или иной формой такой активности. Поскольку было показано, что FHR взаимодействуют с C3b, они могут модулировать деградацию C3b, конкурируя с FH, но могут также мешать сборке и/или активности C3b, содержащих ферменты конвертазы (т.е., конвертаза C3 альтернативного пути и конвертазы C5), как предполагается для FHR-5 и FHR-2.
Консервативные домены белков FHR гомологичны CCP 6–9 и 18–20 FH (рис. 1B). Поскольку CCP 6–7 и 19–20 FH опосредуют взаимодействия регулятора комплемента с C3b, пентраксины, С-реактивный белок (CRP) и пентраксин 3 (PTX3), эпитопы MDA, клетки-хозяева и базальные мембраны, из-за потенциально перекрывая лиганд-связывающую способность, связанную с гомологичными доменами, FHR могут вмешиваться в функции FH через конкуренцию (23). Недавние данные предполагают, что, вопреки предыдущим предположениям, основная роль белков FHR заключается в том, чтобы распознавать и связывать определенные лиганды, поверхности и клетки и, таким образом, действовать как конкурентные ингибиторы FH.
Недавние данные предполагают, что, вопреки предыдущим предположениям, основная роль белков FHR заключается в том, чтобы распознавать и связывать определенные лиганды, поверхности и клетки и, таким образом, действовать как конкурентные ингибиторы FH.
Было обнаружено, что
CCP 1–2 FHR-1, FHR-2 и FHR-5 опосредуют димеризацию этих белков, тем самым увеличивая их авидность в отношении связанного с поверхностью C3b и приводя к усилению конкуренции с FH, что называется нарушением регуляции комплемента. Ассоциированные с заболеванием мутанты этих белков с дублированными доменами димеризации приводят к усиленной активации альтернативного пути за счет уменьшения связывания FH с поверхностно-связанным C3b (21, 24, 25).FHR-5 также может конкурировать с FH за связывание с CRP, PTX3 и внеклеточным матриксом, что приводит к усилению активации комплемента (26). В целом, эти недавние данные подтверждают важную роль FHR в модулировании активации альтернативного пути как антагонистов FH.
Кроме того, было показано, что FHR-4 активирует альтернативный путь, связывая C3b и обеспечивая сборку активной конвертазы C3bBb, а также способствует активации классического пути посредством его взаимодействия с CRP (27–29). Точно так же было показано, что FHR-5 усиливает активацию альтернативного пути за счет связывания C3b (26).
Точно так же было показано, что FHR-5 усиливает активацию альтернативного пути за счет связывания C3b (26).
Почему эта повышенная активация комплемента может быть полезной для нас как хозяев и что это означает в контексте инфекционных заболеваний? СГ хозяина секвестрируется патогенными микробами, что способствует резистентности к сыворотке/комплементу (рис. 2А). Это может быть важным шагом в уклонении от первой линии иммунной защиты и способствует распространению микробов и колонизации ниш хозяина. FHR, в свою очередь, были предложены как приманки, которые из-за их перекрывающегося спектра лигандов с FH могут вытеснять этот ингибитор комплемента с поверхности микробов, а также могут точно настраивать активацию комплемента в физиологических условиях, например.г., на измененное Я (4). Таким образом, FHR могут усиливать опсонизацию микробов, умирающих клеток и клеточного дебриса и способствовать разрешению воспаления (рис. 2А). Примечательно, что большинство FH-связывающих микробных белков также связываются с теми доменами FH, которые консервативны среди белков FHR (4, 30).
Рисунок 2. Роль семейства белков человеческого фактора H (FH) в уклонении микробов от иммунитета. (A) В дополнение к своей роли ингибитора комплемента в плазме, FH распознает и связывается с поверхностями хозяина и защищает их от атаки комплемента.Некоторые микробы используют этот механизм и рекрутируют FH на свою поверхность, чтобы выйти из системы комплемента. Связанные с FH (FHR) белки могут связываться с определенными лигандами хозяина или измененными поверхностями хозяина, которые подвергаются воздействию во время воспаления или повреждения тканей (например, пентраксины, белки внеклеточного матрикса или окислительные модификации липидов) и вытеснять FH, что приводит к усилению опсонизации. FHR могут действовать как приманки и конкурировать с FH за связывание с микробными белками. Например, было описано, что FHR-3 ингибирует связывание FH с fHbp Neisseria meningitidis . (B) FH имеет дополнительные функции. Одновременно связываясь с определенными микробами и рецепторами (такими как CR3) на клетках-хозяевах, он может способствовать поглощению микробов иммунными клетками и модулировать активацию клеток или способствовать проникновению микробов в эпителиальные клетки (левая панель). Также было показано, что FH ингибирует связывание C1q с апоптотическими клетками и E. coli и, таким образом, может модулировать активацию и опсонизацию классического пути (правая панель).
Также было показано, что FH ингибирует связывание C1q с апоптотическими клетками и E. coli и, таким образом, может модулировать активацию и опсонизацию классического пути (правая панель).
Роль FH во взаимодействиях хозяин-микроб
Было показано, что различные классы микробных патогенов связывают FH человека; они были подробно рассмотрены в другом месте [см., e.г., исх. (30, 31)]. Вместо того, чтобы предоставлять постоянно растущий список таких микроорганизмов, этот мини-обзор направлен на то, чтобы выделить общие закономерности (из которых могут существовать исключения) в отношении актуальности связывания FH с микробами и критически оценить доступную литературу путем обсуждения избранных репрезентативных примеров.
В целом считается, что связывание FH (или FHL-1) с жидкостями организма способствует выживанию патогенных микробов в организме хозяина (рис. 2А). Известные примеры включают белок OspE Borrelia burgdorferi (32), Sbi Staphylococcus aureus (33), PspC Streptococcus pneumoniae (34) и fHbp Neisseria meningitidis (35). Сиалилированный Neisseria gonorrhoeae связывает FH и представляет собой пример мимикрии патогенов с гликанами хозяина (36, 31). По-видимому, многочисленные и иначе неродственные микробные белки нацелены на одни и те же консервативные домены FH, которые, таким образом, включают сайты связывания патогенов и лигандов-хозяев. Такой общий сайт связывания микробов был недавно определен и охарактеризован в CCP20 FH (37). Таким образом, микробы могут неправильно направлять домены самораспознавания и имитировать лиганды/поверхности хозяина (38).
Сиалилированный Neisseria gonorrhoeae связывает FH и представляет собой пример мимикрии патогенов с гликанами хозяина (36, 31). По-видимому, многочисленные и иначе неродственные микробные белки нацелены на одни и те же консервативные домены FH, которые, таким образом, включают сайты связывания патогенов и лигандов-хозяев. Такой общий сайт связывания микробов был недавно определен и охарактеризован в CCP20 FH (37). Таким образом, микробы могут неправильно направлять домены самораспознавания и имитировать лиганды/поверхности хозяина (38).
Избирательное связывание FH является одной из причин рестрикции определенных инфекций хозяином: FH человека преимущественно связывается, например, с.g., стрептококки группы А (39), N. meningitidis (38, 40), N. gonorrhoeae (41) и нетипируемые Haemophilus influenzae (42). Напротив, бактерии, инфицирующие различных хозяев, такие как B. burgdorferi , связывают FH нескольких видов (43).
Важность связывания FH для выживания бактерий хорошо документирована для N. meningitidis , а fHbp является одним из компонентов вакцины N. meningitidis серогруппы B (35, 38, 44, 45).В других случаях роль FH как полезного для микроба противоречива. Гипервариабельная область нескольких М-белков Streptococcus pyogenes связывает FH, что, как было приписано, подавляет опсонизацию и способствует фагоцитарной резистентности патогена (46). Более поздние исследования, с другой стороны, не обнаружили явного преимущества связывания FH в отношении сопротивления уничтожению в модели цельной крови или в модели инфекции in vivo (47). На это могут влиять используемые штаммы и модели; недавно у трансгенной мыши FH человека увеличилась вирулентность S.pyogenes , штамм AP1 (который экспрессирует белок H) (39). Сходным образом, несмотря на то, что было описано несколько боррелиозных белков, способных связываться с FH (48), в некоторых случаях они могут быть необязательны для вирулентности (49).
meningitidis , а fHbp является одним из компонентов вакцины N. meningitidis серогруппы B (35, 38, 44, 45).В других случаях роль FH как полезного для микроба противоречива. Гипервариабельная область нескольких М-белков Streptococcus pyogenes связывает FH, что, как было приписано, подавляет опсонизацию и способствует фагоцитарной резистентности патогена (46). Более поздние исследования, с другой стороны, не обнаружили явного преимущества связывания FH в отношении сопротивления уничтожению в модели цельной крови или в модели инфекции in vivo (47). На это могут влиять используемые штаммы и модели; недавно у трансгенной мыши FH человека увеличилась вирулентность S.pyogenes , штамм AP1 (который экспрессирует белок H) (39). Сходным образом, несмотря на то, что было описано несколько боррелиозных белков, способных связываться с FH (48), в некоторых случаях они могут быть необязательны для вирулентности (49).
Кроме того, было показано, что некоторые микроорганизмы разрушают FH (50–52). Это кажется контрпродуктивным, потому что расщепленный FH затем теряет свою способность ингибировать активацию комплемента (51). Тем не менее, микробы могут получить преимущество от более воспалительной микросреды (53, 54) или, поскольку их протеазы могут также расщеплять факторы комплемента, необходимые для распространения каскада (55), функциональная инактивация FH может не вызывать значительных проблем у комплементарное сопротивление.Кроме того, кинетика инактивации может обеспечивать достаточную регуляцию FH. В любом случае этот вопрос нуждается в дополнительном разъяснении.
Это кажется контрпродуктивным, потому что расщепленный FH затем теряет свою способность ингибировать активацию комплемента (51). Тем не менее, микробы могут получить преимущество от более воспалительной микросреды (53, 54) или, поскольку их протеазы могут также расщеплять факторы комплемента, необходимые для распространения каскада (55), функциональная инактивация FH может не вызывать значительных проблем у комплементарное сопротивление.Кроме того, кинетика инактивации может обеспечивать достаточную регуляцию FH. В любом случае этот вопрос нуждается в дополнительном разъяснении.
Помимо своей роли в регуляции альтернативного пути, было также показано, что FH конкурирует с C1q за связывание с липидом A, компонентом LPS, а также с поверхностью штамма E. coli TG1, что указывает на возможность того, что в в некоторых случаях СГ может модулировать активность классического пути (рис. 2В) (56, 57). Этот потенциально важный аспект нуждается в дальнейшем изучении.
Кроме того, связываясь с рецепторами на клетках, FH может опосредовать взаимодействие между микробом и клеткой-хозяином (рис. 2В). Было описано, что в этой неканонической роли СГ действует как связующая молекула между рецептором комплемента 3 (CR3; CD11b/CD18) и патогенами и помогает либо проникновению патогена в клетки-хозяева, либо антимикробному ответу клеток-хозяев (51, 58). –62). Такие сценарии были описаны для СГ, связанной с S. pneumoniae, N. gonorrhoeae и Candida albicans (58–61).Было показано, что FH, связанный с C. albicans , способствует адгезии, фагоцитозу и противогрибковым реакциям нейтрофильных гранулоцитов, таким как повышенная продукция лактоферрина и активных форм кислорода (61). FH также может усиливать реакцию макрофагов при воздействии C. albicans (51).
2В). Было описано, что в этой неканонической роли СГ действует как связующая молекула между рецептором комплемента 3 (CR3; CD11b/CD18) и патогенами и помогает либо проникновению патогена в клетки-хозяева, либо антимикробному ответу клеток-хозяев (51, 58). –62). Такие сценарии были описаны для СГ, связанной с S. pneumoniae, N. gonorrhoeae и Candida albicans (58–61).Было показано, что FH, связанный с C. albicans , способствует адгезии, фагоцитозу и противогрибковым реакциям нейтрофильных гранулоцитов, таким как повышенная продукция лактоферрина и активных форм кислорода (61). FH также может усиливать реакцию макрофагов при воздействии C. albicans (51).
Таким образом, в то время как для большинства исследованных микробов связывание FH (а в некоторых случаях и FHL-1) и способность FH/FHL-1 выступать в качестве кофактора расщепления C3b при связывании на поверхности или на определенных микробных лигандах были показаны in vitro , прямые доказательства, демонстрирующие существенную роль определенных FH/FHR-связывающих белков в резистентности сыворотки, менее существенны. Важно определить относительный вклад таких потенциальных факторов вирулентности в выживаемость микробов в сыворотке и в животных моделях инфекционных заболеваний. Новые технологии и модельные организмы могут помочь выяснить, в какой степени специфические FH-связывающие белки способствуют выживанию патогенов. Параллельное изучение непатогенных штаммов на предмет связывания и активности ФГ, вероятно, также будет информативным.
Важно определить относительный вклад таких потенциальных факторов вирулентности в выживаемость микробов в сыворотке и в животных моделях инфекционных заболеваний. Новые технологии и модельные организмы могут помочь выяснить, в какой степени специфические FH-связывающие белки способствуют выживанию патогенов. Параллельное изучение непатогенных штаммов на предмет связывания и активности ФГ, вероятно, также будет информативным.
Связывание FHR с микробами
Взаимодействие белков FHR с микробами (63) еще недостаточно изучено; в частности, функциональные исследования редки.Это связано с нашими ограниченными знаниями об этих белках, как обсуждалось выше. Тем не менее, некоторые важные наблюдения позволяют предположить, что FHR могут возникать в ходе эволюции как приманки, противодействующие секвестрации FH из жидкостей тела хозяина (4). Примечательно, что в FHR консервативные домены гомологичны доменам FH, которые опосредуют связывание FH с различными лигандами/поверхностями, как собственными, так и чужими, таким образом, FHR, вероятно, разделяют способность связывать микробы. FHR также описаны у нескольких нечеловеческих видов, включая мышей, крыс и рыб; в этих FHR также отсутствуют регуляторные домены комплемента FH, и они отличаются по количеству и составу доменов от своих аналогов человека, нет четких прямых гомологов (64-68).
FHR также описаны у нескольких нечеловеческих видов, включая мышей, крыс и рыб; в этих FHR также отсутствуют регуляторные домены комплемента FH, и они отличаются по количеству и составу доменов от своих аналогов человека, нет четких прямых гомологов (64-68).
В большинстве случаев было продемонстрировано связывание FHR-1 с микробами и микробными белками, которые иначе связывают FH (а в некоторых случаях также FHL-1), например, для нескольких боррелийных белков (48, 69, 70), Leptospira interrogans ( 71), S. aureus (33), Pseudomonas aeruginosa (72), N. gonorrhoeae (60), Plasmodium falciparum (73), C. albicans (621) и Aspergtus 900 (74). До сих пор в большинстве отчетов не было продемонстрировано никакой функциональной роли FHR-1, когда он связан / связан с микробами; в большинстве случаев просто предполагалось, что FHR-1 ингибирует терминальный путь комплемента на основании отчета Heinen et al.(15). Было показано, что в случае стрептококкового белка Scl1 FHR-1 ингибирует активацию терминального пути (75). Тем не менее было показано, что FHR-1 не влияет на опсонизацию и выживаемость бактерий в случае B. burgdorferi (70).
Тем не менее было показано, что FHR-1 не влияет на опсонизацию и выживаемость бактерий в случае B. burgdorferi (70).
FHR-1, FHR-2 и FHR-5 связываются с B. burgdorferi . Однако функциональный анализ не смог продемонстрировать вклад белков FHR в сывороточную резистентность этого микроба (70). С другой стороны, было показано, что FHR-1, связанный с C. albicans , облегчает взаимодействие с нейтрофилами человека и способствует антимикробным реакциям нейтрофилов (61).
Fusobacterium necrophorum связывает FH, FHL-1, FHR-1 и FHR-4. Сравнивали различные штаммы, и штамм, слабо связывающий FH, показал повышенное отложение C3b и терминального комплекса C5b-9 на своей поверхности и снижение выживаемости в сыворотке человека по сравнению со штаммами, которые сильнее связывают FH. Роль FHR-1 и FHR-4 не рассматривалась (76). FHR-4 также связывается с C. albicans , но функциональное значение этого взаимодействия неясно (61). В обоих случаях изоформа FHR-4A (77) связывалась с сывороткой, что показывает повышенное связывание C3b по сравнению с FHR-4B и активирует альтернативный путь (29). Дальнейшие исследования должны оценить его потенциальную роль в усилении опсонизации.
Дальнейшие исследования должны оценить его потенциальную роль в усилении опсонизации.
Описаны прямые доказательства важной роли FHR-3 в инфекционных заболеваниях. Полногеномное исследование ассоциации заболеваний связывает ген CFHR3 с инфекцией N. meningitidis (78). Следующее функциональное исследование показало, что FHR-3 связывается с этим патогеном и конкурирует с FH за связывание с fHbp N. meningitidis , таким образом, действует как конкурентный ингибитор FH и усиливает активацию комплемента (рис. 2А).FHR-3 и FH связываются с одинаковым наномолярным сродством к fHbp, но относительная аффинность различается между вариантами fHbp. В целом гены как человека-хозяина (путем определения уровней FH/FHR-3), так и патогена (путем определения вариантов fHbp, например, которые преимущественно связываются с FH) влияют на восприимчивость к заболеванию (79).
Дополнительные косвенные данные подтверждают такую роль FHR. Например, повышенные концентрации FHR были описаны в выпотной жидкости среднего уха у пациентов со средним отитом с выпотом (80). Было обнаружено, что у рыбок данио экспрессия FHR усиливается с помощью LPS, что указывает на их роль в качестве белков острой фазы (68). Эти и другие данные (81) указывают на то, что FHR могут активироваться во время инфекции или воспаления.
Было обнаружено, что у рыбок данио экспрессия FHR усиливается с помощью LPS, что указывает на их роль в качестве белков острой фазы (68). Эти и другие данные (81) указывают на то, что FHR могут активироваться во время инфекции или воспаления.
Заключение и перспективы
Хотя роль FH в уклонении от комплемента имеет медицинское значение для некоторых микробов, необходимо выяснить дополнительные аспекты связывания этого регулятора, такие как значимость опосредования клеточных взаимодействий и регуляции классического пути.Роль белков FHR до сих пор плохо изучена. Хотя они появляются как позитивные регуляторы комплемента через конкуренцию с FH и путем прямой активации альтернативного пути через связывание C3b, важные вопросы включают (1) относительные концентрации и их регуляцию, (2) различия в аффинности по отношению к конкретным лигандам, (3) функциональные избыточность среди них и (4) уточнение предполагаемой и до сих пор неизвестной ингибирующей способности комплемента. Дальнейшие исследования помогут оценить их роль во взаимодействиях хозяин-патоген, выявить новые кандидаты на вакцины, а также могут рассмотреть потенциальное терапевтическое использование белков FHR при инфекционных заболеваниях.
Дальнейшие исследования помогут оценить их роль во взаимодействиях хозяин-патоген, выявить новые кандидаты на вакцины, а также могут рассмотреть потенциальное терапевтическое использование белков FHR при инфекционных заболеваниях.
Вклад авторов
MJ подготовили текст и рисунки.
Заявление о конфликте интересов
Автор заявляет, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могли бы быть истолкованы как потенциальный конфликт интересов.
Финансирование
Работа автора по изучению функции белков семейства Н человеческого фактора поддерживается грантами Венгерской академии наук (программа Lendület, грант №.LP2012-43), Национальное бюро исследований, разработок и инноваций (грант OTKA № K 109055), MedInProt и Kidneeds Foundation (IA, США).
Ссылки
2. Merle NS, Church SE, Fremeaux-Bacchi V, Roumenina LT. I часть системы комплемента – молекулярные механизмы активации и регуляции. Фронт Иммунол (2015) 6:262. doi:10.3389/fimmu.2015.00262
Фронт Иммунол (2015) 6:262. doi:10.3389/fimmu.2015.00262
Полнотекстовая перекрестная ссылка | Академия Google
4. Йози М., Тортахада А., Узони Б., Гойкоэчеа де Хорхе Э., Родригес де Кордова С.Белки, родственные фактору Н, определяют поверхности, активирующие комплемент. Trends Immunol (2015) 36(6):374–84. doi:10.1016/j.it.2015.04.008
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
6. Копп А., Хебекер М., Свободова Э., Йози М. Фактор Н: регулятор комплемента в норме и при болезни и медиатор клеточных взаимодействий. Биомолекулы (2012) 2(1):46–75. doi: 10.3390/biom2010046
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
7.Паренте Р., Кларк С.Дж., Инфорзато А., Дэй А.Дж. Фактор комплемента H в защите хозяина и уклонении от иммунитета. Cell Mol Life Sci (2016) 74(9):1605–24. дои: 10.1007/s00018-016-2418-4
Полнотекстовая перекрестная ссылка | Академия Google
8. Wu J, Wu YQ, Ricklin D, Janssen BJ, Lambris JD, Gros P. Структура фрагмента комплемента C3b-фактор H и последствия для защиты хозяина регуляторами комплемента. Nat Immunol (2009) 10(7):728–33. дои: 10.1038/ni.1755
Wu J, Wu YQ, Ricklin D, Janssen BJ, Lambris JD, Gros P. Структура фрагмента комплемента C3b-фактор H и последствия для защиты хозяина регуляторами комплемента. Nat Immunol (2009) 10(7):728–33. дои: 10.1038/ni.1755
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
9.Kajander T, Lehtinen MJ, Hyvärinen S, Bhattacharjee A, Leung E, Isenman DE, et al. Двойное взаимодействие фактора H с C3d и гликозаминогликанами при дискриминации хозяина и нехозяина с помощью комплемента. Proc Natl Acad Sci U S A (2011) 108(7):2897–902. doi:10.1073/pnas.1017087108
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
10. Morgan HP, Schmidt CQ, Guariento M, Blaum BS, Gillespie D, Herbert AP, et al. Структурная основа взаимодействия фактора комплемента H C3b с собственной поверхностью. Nat Struct Mol Biol (2011) 18(4):463–70. doi: 10.1038/nsmb.2018
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
11. Schmidt CQ, Herbert AP, Kavanagh D, Gandy C, Fenton CJ, Blaum BS, et al. Новая карта сайтов связывания гликозаминогликанов и C3b на факторе H. J Immunol (2008) 181(4):2610–9. doi:10.4049/jиммунол.181.4.2610
Schmidt CQ, Herbert AP, Kavanagh D, Gandy C, Fenton CJ, Blaum BS, et al. Новая карта сайтов связывания гликозаминогликанов и C3b на факторе H. J Immunol (2008) 181(4):2610–9. doi:10.4049/jиммунол.181.4.2610
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
12. Блаум Б.С., Ханнан Дж.П., Герберт А.П., Кавана Д., Урин Д., Штеле Т.Структурная основа опосредованного сиаловой кислотой самораспознавания с помощью фактора комплемента H. Nat Chem Biol (2015) 11(1):77–82. doi:10.1038/nchembio.1696
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
13. Мери С. Дискриминация себя-не-я по системе комплемента. FEBS Lett (2016) 590(15):2418–34. дои: 10.1002/1873-3468.12284
Полнотекстовая перекрестная ссылка | Академия Google
14. Кларк С.Дж., Ридж Л.А., Герберт А.П., Акопян С., Маллой Б., Леннон Р. и соавт.Тканеспецифическое распознавание хозяина с помощью фактора комплемента H опосредуется дифференциальной активностью его областей, связывающих гликозаминогликаны. J Immunol (2013) 190(5):2049–57. doi:10.4049/jиммунол.1201751
J Immunol (2013) 190(5):2049–57. doi:10.4049/jиммунол.1201751
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
15. Heinen S, Hartmann A, Lauer N, Wiehl U, Dahse HM, Schirmer S, et al. Белок 1, родственный фактору H (CFHR-1), ингибирует активность конвертазы комплемента C5 и образование терминальных комплексов. Кровь (2009) 114(12):2439–47.дои: 10.1182/кровь-2009-02-205641
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
16. Eberhardt HU, Buhlmann D, Hortschansky P, Chen Q, Böhm S, Kemper MJ, et al. Белок 2, родственный человеческому фактору H (CFHR2), регулирует активацию комплемента. PLoS One (2013) 8(11):e78617. doi:10.1371/journal.pone.0078617
Полнотекстовая перекрестная ссылка | Академия Google
17. Hellwage J, Jokiranta TS, Koistinen V, Vaarala O, Meri S, Zipfel PF. Функциональные свойства белков FHR-3 и FHR-4, связанных с фактором комплемента H: связывание с областью C3d C3b и дифференциальная регуляция гепарином. FEBS Lett (1999) 462(3):345–52. дои: 10.1016/S0014-5793(99)01554-9
FEBS Lett (1999) 462(3):345–52. дои: 10.1016/S0014-5793(99)01554-9
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
18. Fritsche LG, Lauer N, Hartmann A, Stippa S, Keilhauer CN, Oppermann M, et al. Дисбаланс регуляторных белков комплемента человека CFHR1, CFHR3 и фактора H влияет на риск возрастной дегенерации желтого пятна (AMD). Hum Mol Genet (2010) 19(23):4694–704. дои: 10.1093/hmg/ddq399
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
19.McRae JL, Duthy TG, Griggs KM, Ormsby RJ, Cowan PJ, Cromer BA, et al. Белок 5, родственный человеческому фактору Н, обладает кофакторной активностью, ингибирует активность конвертазы С3, связывает гепарин и С-реактивный белок и связывается с липопротеином. J Immunol (2005) 174(10):6250–6. doi:10.4049/jиммунол.174.10.6250
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
20. Strobel S, Abarrategui-Garrido C, Fariza-Requejo E, Seeberger H, Sánchez-Corral P, Józsi M. Белок 1, связанный с фактором H, нейтрализует аутоантитела против фактора H при аутоиммунном гемолитико-уремическом синдроме. Kidney Int (2011) 80(4):397–404. doi:10.1038/ki.2011.152
Белок 1, связанный с фактором H, нейтрализует аутоантитела против фактора H при аутоиммунном гемолитико-уремическом синдроме. Kidney Int (2011) 80(4):397–404. doi:10.1038/ki.2011.152
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
21. Goicoechea de Jorge E, Caesar JJ, Malik TH, Patel M, Colledge M, Johnson S, et al. Димеризация белков, связанных с фактором комплемента H, модулирует активацию комплемента in vivo. Proc Natl Acad Sci U S A (2013) 110(12):4685–90. doi:10.1073/pnas.1219260110
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
22.Месарош Т., Синчи А.И., Узони Б., Хебекер М., Фюлоп Т.Г., Эрдеи А. и соавт. Фактор H ингибирует активацию комплемента, индуцированную липосомальными и мицеллярными препаратами и терапевтическим антителом ритуксимабом in vitro. Наномедицина (2016) 12(4):1023–31. doi:10.1016/j.nano.2015.11.019
Полнотекстовая перекрестная ссылка | Академия Google
24. Tortajada A, Yébenes H, Abarrategui-Garrido C, Anter J, García-Fernandez JM, Martinez-Barricarte R, et al. Мутация CFHR1, связанная с гломерулопатией C3, изменяет олигомеризацию FHR и регуляцию комплемента. J Clin Invest (2013) 123(6):2434–46. дои: 10.1172/JCI68280
Tortajada A, Yébenes H, Abarrategui-Garrido C, Anter J, García-Fernandez JM, Martinez-Barricarte R, et al. Мутация CFHR1, связанная с гломерулопатией C3, изменяет олигомеризацию FHR и регуляцию комплемента. J Clin Invest (2013) 123(6):2434–46. дои: 10.1172/JCI68280
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
25. Chen Q, Wiesener M, Eberhardt HU, Hartmann A, Uzonyi B, Kirschfink M, et al. Гибридный белок, родственный фактору комплемента H, нарушает регуляцию комплемента при болезни плотных отложений. J Clin Invest (2014) 124(1):145–55. дои: 10.1172/JCI71866
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
26. Csincsi ÁI, Kopp A, Zöldi M, Bánlaki Z, Uzonyi B, Hebecker M, et al.Белок 5, родственный фактору Н, взаимодействует с пентраксином 3 и внеклеточным матриксом и модулирует активацию комплемента. J Immunol (2015) 194(10):4963–73. doi:10.4049/jиммунол.1403121
Полнотекстовая перекрестная ссылка | Академия Google
27.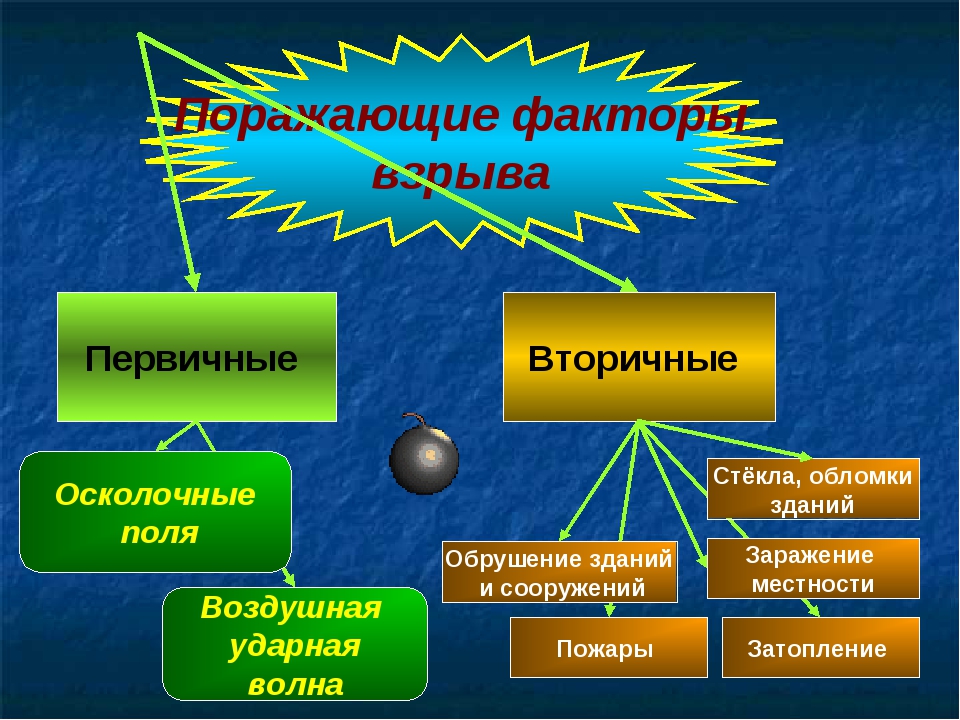 Mihlan M, Hebecker M, Dahse HM, Hälbich S, Huber-Lang M, Dahse R, et al. Белок 4, родственный фактору комплемента человека H, связывает и рекрутирует нативный пентамерный С-реактивный белок в некротические клетки. Мол Иммунол (2009) 46(3):335–44.doi:10.1016/j.molimm.2008.10.029
Mihlan M, Hebecker M, Dahse HM, Hälbich S, Huber-Lang M, Dahse R, et al. Белок 4, родственный фактору комплемента человека H, связывает и рекрутирует нативный пентамерный С-реактивный белок в некротические клетки. Мол Иммунол (2009) 46(3):335–44.doi:10.1016/j.molimm.2008.10.029
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
28. Hebecker M, Okemefuna AI, Perkins SJ, Mihlan M, Huber-Lang M, Józsi M. Молекулярные основы связывания С-реактивного белка и модуляция активации комплемента белком, родственным фактору H 4. Mol Immunol (2010 ) 47(6):1347–55. doi:10.1016/j.molimm.2009.12.005
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
29. Hebecker M, Józsi M. Белок 4, родственный фактору H, активирует комплемент, выступая в качестве платформы для сборки конвертазы C3 альтернативного пути посредством ее взаимодействия с белком C3b. J Biol Chem (2012) 287(23):19528–36. дои: 10.1074/jbc.M112. 364471
364471
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
30. Ламбрис Д.Д., Риклин Д., Гейсбрехт Б.В. Дополняют уклонение от патогенов человека. Nat Rev Microbiol (2008) 6(2):132–42. дои: 10.1038/nrmicro1824
Полнотекстовая перекрестная ссылка | Академия Google
31. Рам С., Шонесси Дж., ДеОливейра Р.Б., Льюис Л.А., Гулати С., Райс П.А. Использование стратегий уклонения от комплемента для разработки антибактериальных иммунотерапевтических препаратов на основе комплемента: уроки патогенных Neisseriae . Иммунобиология (2016) 221(10):1110–23. doi:10.1016/j.imbio.2016.05.016
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
32. Hellwage J, Meri T, Heikkilä T, Alitalo A, Panelius J, Lahdenne P, et al. Фактор регулятора комплемента H связывается с поверхностным белком OspE Borrelia burgdorferi . J Biol Chem (2001) 276(11):8427–35. дои: 10.1074/jbc.M007994200
Полнотекстовая перекрестная ссылка | Академия Google
33. Haupt K, Reuter M, van den Elsen J, Burman J, Hälbich S, Richter J, et al.Белок Sbi Staphylococcus aureus действует как ингибитор комплемента и образует трехчастный комплекс с фактором комплемента хозяина H и C3b. PLoS Pathog (2008) 4(12):e1000250. doi:10.1371/journal.ppat.1000250
Haupt K, Reuter M, van den Elsen J, Burman J, Hälbich S, Richter J, et al.Белок Sbi Staphylococcus aureus действует как ингибитор комплемента и образует трехчастный комплекс с фактором комплемента хозяина H и C3b. PLoS Pathog (2008) 4(12):e1000250. doi:10.1371/journal.ppat.1000250
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
34. Janulczyk R, Iannelli F, Sjoholm AG, Pozzi G, Bjorck L. Hic, новый поверхностный белок Streptococcus pneumoniae , который препятствует функции комплемента. J Biol Chem (2000) 275(47):37257–63.дои: 10.1074/jbc.M004572200
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
36. Ram S, Sharma AK, Simpson SD, Gulati S, McQuillen DP, Pangburn MK, et al. Новый сайт связывания сиаловой кислоты на факторе H опосредует сывороточную резистентность сиалилированного Neisseria gonorrhoeae . J Exp Med (1998) 187(5):743–52. doi:10.1084/jem.187. 5.743
5.743
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
37. Meri T, Amdahl H, Lehtinen MJ, Hyvärinen S, McDowell JV, Bhattacharjee A, et al.Микробы связывают фактор ингибитора комплемента H через общий сайт. PLoS Pathog (2013) 9(4):e1003308. doi:10.1371/journal.ppat.1003308
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
38. Schneider MC, Prosser BE, Caesar JJ, Kugelberg E, Li S, Zhang Q, et al. Neisseria meningitidis рекрутирует фактор H, используя белковую мимикрию углеводов хозяина. Природа (2009) 458(7240):890–3. дои: 10.1038/природа07769
Полнотекстовая перекрестная ссылка | Академия Google
39.Эрмерт Д., Шонесси Дж., Джоерис Т., Каплан Дж., Панг С.Дж., Курт-Джонс Э.А. и др. Вирулентность стрептококков группы А усиливается ингибиторами комплемента человека. PLoS Pathog (2015) 11(7):e1005043. doi:10.1371/journal.ppat.1005043
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
40. Granoff DM, Welsch JA, Ram S. Связывание фактора комплемента H (fH) с Neisseria meningitidis специфично для fH человека и ингибирует активацию комплемента крысиной и кроличьей сыворотками. Infect Immun (2009) 77(2):764–9. doi: 10.1128/IAI.01191-08
Granoff DM, Welsch JA, Ram S. Связывание фактора комплемента H (fH) с Neisseria meningitidis специфично для fH человека и ингибирует активацию комплемента крысиной и кроличьей сыворотками. Infect Immun (2009) 77(2):764–9. doi: 10.1128/IAI.01191-08
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
41. Нгампасутадол Дж., Рам С., Гулати С., Агарвал С., Ли С., Висинтин А. и соавт. Человеческий фактор H избирательно взаимодействует с Neisseria gonorrhoeae и приводит к видоспецифичному уклонению от комплемента. J Immunol (2008) 180(5):3426–35. doi:10.4049/jиммунол.180.5.3426
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
42.Лангерейс Дж.Д., де Йонге М.И., Вайзер Дж.Н. Связывание человеческого фактора Н с белком наружной мембраны Р5 нетипируемого штамма Haemophilus influenzae способствует резистентности к комплементу. Mol Microbiol (2014) 94(1):89–106. дои: 10. 1111/mmi.12741
1111/mmi.12741
Полнотекстовая перекрестная ссылка | Академия Google
43. Ховис К.М., Тран Э., Санди К.М., Баклз Э., Макдауэлл Дж.В., Маркони Р.Т. Селективное связывание паралогов OspE Borrelia burgdorferi с фактором H и белками сыворотки различных животных: возможное расширение роли OspE в патогенезе болезни Лайма. Infect Immun (2006) 74(3):1967–72. doi:10.1128/IAI.74.3.1967-1972.2006
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
44. Schneider MC, Exley RM, Chan H, Feavers I, Kang YH, Sim RB, et al. Функциональное значение связывания фактора H с Neisseria meningitidis . J Immunol (2006) 176(12):7566–75. doi:10.4049/jиммунол.176.12.7566
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
45. Seib KL, Serruto D, Oriente F, Delany I, Adu-Bobie J, Veggi D, et al.Белок, связывающий фактор Н, важен для выживания менингококков в цельной крови и сыворотке человека и в присутствии противомикробного пептида LL-37. Infect Immun (2009) 77(1):292–9. doi: 10.1128/IAI.01071-08
Infect Immun (2009) 77(1):292–9. doi: 10.1128/IAI.01071-08
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
46. Horstmann RD, Sievertsen HJ, Knobloch J, Fischetti VA. Антифагоцитарная активность стрептококкового М-белка: селективное связывание белка-фактора контроля комплемента H. Proc Natl Acad Sci U S A (1988) 85(5):1657–61.doi:10.1073/pnas.85.5.1657
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
47. Gustafsson MC, Lannergård J, Nilsson OR, Kristensen BM, Olsen JE, Harris CL, et al. Фактор H связывается с гипервариабельной областью многих белков M Streptococcus pyogenes , но не способствует устойчивости к фагоцитозу или острой вирулентности. PLoS Pathog (2013) 9(4):e1003323. doi:10.1371/journal.ppat.1003323
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
48.Крайчи П. Прятки: как спирохеты болезни Лайма преодолевают атаку комплемента. Фронт Иммунол (2016) 7:385. doi:10.3389/fimmu.2016.00385
Фронт Иммунол (2016) 7:385. doi:10.3389/fimmu.2016.00385
Полнотекстовая перекрестная ссылка | Академия Google
49. Fine LM, Miller DP, Mallory KL, Tegels BK, Earnhart CG, Marconi RT. Белок FhbA, связывающий фактор H Borrelia hermsii , не требуется для инфекционности у мышей или для устойчивости к человеческому комплементу in vitro. Infect Immun (2014) 82(8):3324–32. дои: 10.1128/ИАИ.01892-14
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
50. Макдауэлл Дж.В., Хуанг Б., Фенно Дж.К., Маркони Р.Т. Анализ уникального взаимодействия между регуляторным белком фактора комплемента H и пародонтальным патогеном Treponema denticola . Infect Immun (2009) 77(4):1417–25. doi: 10.1128/IAI.01544-08
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
51. Свобода Э., Шнайдер А.Е., Шандор Н., Лерманн У., Стаиб П., Кремлицка М. и соавт.Секретируемая аспарагиновая протеаза 2 из Candida albicans инактивирует фактор Н и рецепторы фактора Н макрофагов CR3 (CD11b/CD18) и CR4 (CD11c/CD18). Immunol Lett (2015) 168(1):13–21. doi:10.1016/j.imlet.2015.08.009
Immunol Lett (2015) 168(1):13–21. doi:10.1016/j.imlet.2015.08.009
Полнотекстовая перекрестная ссылка | Академия Google
52. Рива Р., Корхонен Т.К., Мери С. Протеаза наружной мембраны PgtE Salmonella enterica препятствует альтернативному пути комплемента за счет расщепления факторов B и H. Front Microbiol (2015) 6:63.doi:10.3389/fmicb.2015.00063
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
53. Miller DP, Bell JK, McDowell JV, Conrad DH, Burgner JW, Héroux A, et al. Структура фактора H-связывающего белка B (FhbB) периопатогена, Treponema denticola : понимание прогрессирования заболеваний пародонта. J Biol Chem (2012) 287(16):12715–22. дои: 10.1074/jbc.M112.339721
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
54.Миллер Д.П., Макдауэлл Дж.В., Белл Дж.К., Геттинг-Минески М.П., Фенно Дж.К., Маркони Р.Т. Анализ чувствительности комплемента трепонем полости рта и потенциального влияния связывания ФГ, расщепления ФГ и активности дентилизина на патогенез заболеваний пародонта. Mol Oral Microbiol (2014) 29(5):194–207. дои: 10.1111/оми.12054
Mol Oral Microbiol (2014) 29(5):194–207. дои: 10.1111/оми.12054
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
55. Gropp K, Schild L, Schindler S, Hube B, Zipfel PF, Skerka C. Дрожжи Candida albicans избегают атаки человеческого комплемента за счет секреции аспарагиновых протеаз. Мол Иммунол (2009) 47(2–3):465–75. doi:10.1016/j.molimm.2009.08.019
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
56. Тан Л.А., Ян А.С., Кишор У., Сим Р.Б. Взаимодействие белков комплемента C1q и фактора Н с липидом А и Escherichia coli : еще одно свидетельство того, что фактор Н регулирует классический путь комплемента. Protein Cell (2011) 2(4):320–32. doi: 10.1007/s13238-011-1029-y
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
58.Хаммершмидт С., Агарвал В., Кунерт А., Хельбих С., Скерка С., Зипфель П.Ф. Иммунный регулятор фактора H хозяина взаимодействует через два сайта контакта с белком PspC Streptococcus pneumoniae и опосредует адгезию к эпителиальным клеткам хозяина. J Immunol (2007) 178(9):5848–58. doi:10.4049/jиммунол.178.9.5848
J Immunol (2007) 178(9):5848–58. doi:10.4049/jиммунол.178.9.5848
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
59. Agarwal V, Asmat TM, Luo S, Jensch I, Zipfel PF, Hammerschmidt S. Фактор регулятора комплемента H опосредует двухступенчатое поглощение Streptococcus pneumoniae клетками человека. J Biol Chem (2010) 285(30):23486–95. дои: 10.1074/jbc.M110.142703
Полнотекстовая перекрестная ссылка | Академия Google
60. Агарвал С., Рам С., Нгампасутадол Дж., Гулати С., Зипфель П.Ф., Райс П.А. Фактор H способствует прикреплению Neisseria gonorrhoeae к рецептору комплемента 3 на эукариотических клетках. J Immunol (2010) 185(7):4344–53. doi:10.4049/jиммунол.0
1
Полнотекстовая перекрестная ссылка | Академия Google
61. Losse J, Zipfel PF, Józsi M.Фактор H и белок 1, родственный фактору H, связываются с нейтрофилами человека через рецептор комплемента 3, опосредуют присоединение к Candida albicans и усиливают противомикробную активность нейтрофилов. J Immunol (2010) 184(2):912–21. doi:10.4049/jиммунол.0
J Immunol (2010) 184(2):912–21. doi:10.4049/jиммунол.0
2
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
62. Schneider AE, Sándor N, Kárpáti É, Józsi M. Фактор комплемента H модулирует активацию нейтрофильных гранулоцитов человека и образование нейтрофильных внеклеточных ловушек. Мол Иммунол (2016) 72:37–48. doi:10.1016/j.molimm.2016.02.011
Полнотекстовая перекрестная ссылка | Академия Google
63. Zipfel PF, Skerka C, Hellwage J, Jokiranta ST, Meri S, Brade V, et al. Белки семейства фактора Н: комплемент, микробы и болезни человека. Biochem Soc Trans (2002) 30 (Pt 6): 971–8. дои: 10.1042/bst0300971
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
64. Вик Д.П., Муньос-Кановес П., Козоно Х., Мартин Л.Г., Тэк Б.Ф., Чаплин Д.Д.Идентификация и анализ последовательности четырех связанных с фактором комплемента H транскриптов в печени мыши. J Biol Chem (1990) 265(6):3193–201.
Реферат PubMed | Академия Google
65. Рен Г., Доши М., Хак Б.К., Александр Дж.Дж., Куигг Р.Дж. Выделение и характеристика нового белка, связанного с крысиным фактором H, который активируется в клубочках при атаке комплемента. J Biol Chem (2002) 277(50):48351–8. дои: 10.1074/jbc.M205135200
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
66.Hellwage J, Eberle F, Babuke T, Seeberger H, Richter H, Kunert A, et al. Два мышиных белка, родственных фактору H: анализ экспрессии и функциональная характеристика. Immunogenetics (2006) 58(11):883–93. doi: 10.1007/s00251-006-0153-y
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
67. Pouw RB, Vredevoogd DW, Kuijpers TW, Wouters D. О мышах и людях: семейство белков фактора H и регуляция комплемента. Мол Иммунол (2015) 67(1):12–20.doi:10.1016/j.molimm.2015.03.011
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
68.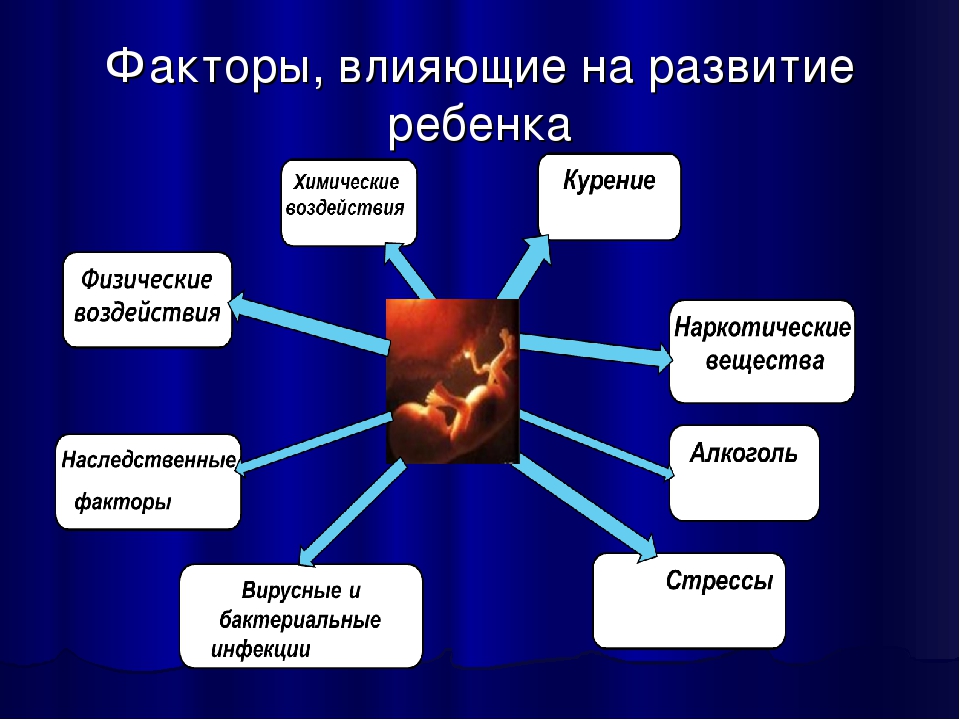 Sun G, Li H, Wang Y, Zhang B, Zhang S. Фактор комплемента H рыбок данио и родственные ему гены: идентификация, эволюция и экспрессия. Funct Integr Genomics (2010) 10(4):577–87. дои: 10.1007/s10142-010-0182-3
Sun G, Li H, Wang Y, Zhang B, Zhang S. Фактор комплемента H рыбок данио и родственные ему гены: идентификация, эволюция и экспрессия. Funct Integr Genomics (2010) 10(4):577–87. дои: 10.1007/s10142-010-0182-3
Полнотекстовая перекрестная ссылка | Академия Google
69. Haupt K, Kraiczy P, Wallich R, Brade V, Skerka C, Zipfel PF. Связывание белка 1, родственного человеческому фактору Н, с резистентным к сыворотке штаммом Borrelia burgdorferi опосредуется поверхностными белками, приобретающими регулятор комплемента боррелий. J Infect Dis (2007) 196(1):124–33. дои: 10.1086/518509
Полнотекстовая перекрестная ссылка | Академия Google
70. Siegel C, Hallström T, Skerka C, Eberhardt H, Uzonyi B, Beckhaus T, et al. Связанные с фактором комплемента H белки CFHR2 и CFHR5 представляют собой новые лиганды для ассоциированных с инфекцией белков CRASP Borrelia burgdorferi . PLoS One (2010) 5(10):e13519. doi:10.1371/journal. pone.0013519
pone.0013519
Полнотекстовая перекрестная ссылка | Академия Google
71.Castiblanco-Valencia MM, Fraga TR, Silva LB, Monaris D, Abreu PA, Strobel S, et al. Иммуноглобулиноподобные белки лептоспиры взаимодействуют с регуляторами комплемента человека факторами H, FHL-1, FHR-1 и C4BP. J Infect Dis (2012) 205(6):995–1004. doi: 10.1093/infdis/jir875
Полнотекстовая перекрестная ссылка | Академия Google
72. Kunert A, Losse J, Gruszin C, Hühn M, Kaendler K, Mikkat S, et al. Иммунное уклонение от человеческого патогена Pseudomonas aeruginosa : фактор элонгации Tuf представляет собой белок, связывающий фактор H и плазминоген. J Immunol (2007) 179(5):2979–88. doi:10.4049/jиммунол.179.5.2979
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
73. Rosa TF, Flammersfeld A, Ngwa CJ, Kiesow M, Fischer R, Zipfel PF, et al. Стадии крови Plasmodium falciparum приобретают белки семейства фактора H, чтобы избежать разрушения человеческим комплементом. Cell Microbiol (2016) 18(4):573–90. дои: 10.1111/см.12535
Cell Microbiol (2016) 18(4):573–90. дои: 10.1111/см.12535
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
74.Бенсен Дж., Хартманн А., Шмалер Дж., Герке А., Брэхейдж А.А., Зипфель П.Ф. Условно-патогенный грибок человека Aspergillus fumigatus уклоняется от системы комплемента хозяина. Infect Immun (2008) 76(2):820–7. doi:10.1128/IAI.01037-07
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
75. Reuter M, Caswell CC, Lukomski S, Zipfel PF. Связывание регуляторов комплемента человека CFHR1 и фактора H стрептококковым коллагеноподобным белком 1 (Scl1) через их консервативные С-концы позволяет контролировать каскад комплемента на нескольких уровнях. J Biol Chem (2010) 285(49):38473–85. дои: 10.1074/jbc.M110.143727
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
76. Фриберг Н., Карлсон П., Кентала Э., Маттила П.С., Куусела П., Мери С. и соавт. Связывание фактора Н как механизм уклонения от комплемента для анаэробного патогена, Fusobacterium necrophorum . J Immunol (2008) 181(12):8624–32. doi:10.4049/jиммунол.181.12.8624
Связывание фактора Н как механизм уклонения от комплемента для анаэробного патогена, Fusobacterium necrophorum . J Immunol (2008) 181(12):8624–32. doi:10.4049/jиммунол.181.12.8624
Полнотекстовая перекрестная ссылка | Академия Google
77.Йози М., Рихтер Х., Лёшманн И., Скерка С., Бак Ф., Бейзигель У. и др. FHR-4A: новый белок, родственный фактору H, кодируется человеческим геном FHR-4. Eur J Hum Genet (2005) 13(3):321–9. doi:10.1038/sj.ejhg.5201324
Полнотекстовая перекрестная ссылка | Академия Google
78. Давила С., Райт В.Дж., Хор С.С., Сим К.С., Биндер А., Бреунис В.Б. и соавт. Полногеномное ассоциативное исследование выявляет варианты в области CFH, связанные с восприимчивостью хозяина к менингококковому заболеванию. Nat Genet (2010) 42(9):772–6.дои: 10.1038/ng.640
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
79. Caesar JJ, Lavender H, Ward PN, Exley RM, Eaton J, Chittock E, et al. Конкуренция между антагонистическими факторами комплемента за один белок на N. meningitidis определяет восприимчивость к заболеванию. Элиф (2014) 3:e04008. doi:10.7554/eLife.04008
Конкуренция между антагонистическими факторами комплемента за один белок на N. meningitidis определяет восприимчивость к заболеванию. Элиф (2014) 3:e04008. doi:10.7554/eLife.04008
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
80. Няркио-Мякеля М., Хеллвейдж Дж., Тахкокаллио О., Мери С.Фактор Н-регулятора комплемента и родственные ему белки при среднем отите с выпотом. Clin Immunol (2001) 100(1):118–26. doi:10.1006/clim.2001.5043
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
81. Schäfer N, Grosche A, Reinders J, Hauck SM, Pouw RB, Kuijpers TW, et al. Регулятор комплемента FHR-3 повышается либо локально, либо системно при ряде аутоиммунных заболеваний. Фронт Иммунол (2016) 7:542. doi:10.3389/fimmu.2016.00542
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Фактор H – обзор
Дефекты функции фактора H и других регуляторов, которые приводят к почечной и глазной патологии
FH является критическим негативным регулятором как жидкой фазы, так и связанной с клетками активности комплемента, для защиты наших клеток и ткани от атаки, опосредованной комплементом. FH выполняет свою функцию посредством ускорения распада и действует как кофактор для FI (рис. 7B и C). FH состоит из 20 SCR-доменов, расположенных в виде бусинок на нитке, где N-концевые домены 1–5 содержат функциональный сайт белка, а сайты связывания полианионов и C3b/d (для распознавания клеточных поверхностей) распределены по всему периметру. белок. Домены SCR 7 и 19–20 считаются особенно важными для распознавания клетками-хозяевами закрепления FH на поверхности для выполнения своих защитных функций [рассмотрено в Ferreira et al.(2010b) и Haque et al. (2020)]. Понимание распределения этих сайтов позволяет лучше понять, как заболевания связаны с дисфункцией FH, в зависимости от того, является ли FH полностью дефицитным или дефектен конкретный домен FH. Таким образом, дефицит ФГ приводит к неспособности ускорять распад АП-конвертаз и выступать в качестве кофактора ФИ в жидкой фазе и на клеточных поверхностях. Поскольку ФГ является основным регулятором активности комплемента в жидкой фазе крови, дефицит ФГ приводит к полному потреблению С3.
FH выполняет свою функцию посредством ускорения распада и действует как кофактор для FI (рис. 7B и C). FH состоит из 20 SCR-доменов, расположенных в виде бусинок на нитке, где N-концевые домены 1–5 содержат функциональный сайт белка, а сайты связывания полианионов и C3b/d (для распознавания клеточных поверхностей) распределены по всему периметру. белок. Домены SCR 7 и 19–20 считаются особенно важными для распознавания клетками-хозяевами закрепления FH на поверхности для выполнения своих защитных функций [рассмотрено в Ferreira et al.(2010b) и Haque et al. (2020)]. Понимание распределения этих сайтов позволяет лучше понять, как заболевания связаны с дисфункцией FH, в зависимости от того, является ли FH полностью дефицитным или дефектен конкретный домен FH. Таким образом, дефицит ФГ приводит к неспособности ускорять распад АП-конвертаз и выступать в качестве кофактора ФИ в жидкой фазе и на клеточных поверхностях. Поскольку ФГ является основным регулятором активности комплемента в жидкой фазе крови, дефицит ФГ приводит к полному потреблению С3. Это массивное, хроническое потребление С3 (синтез С3 в норме) приводит к неконтролируемому отложению C3b, iC3b и C3d/dg на клетках с повреждением, в частности, базальной мембраны почек, которые в основном полагаются на FH для защиты, что приводит к типу II мембранопролиферативный гломерулонефрит (МПГН). Некоторые люди также имеют повышенный риск заражения.
Это массивное, хроническое потребление С3 (синтез С3 в норме) приводит к неконтролируемому отложению C3b, iC3b и C3d/dg на клетках с повреждением, в частности, базальной мембраны почек, которые в основном полагаются на FH для защиты, что приводит к типу II мембранопролиферативный гломерулонефрит (МПГН). Некоторые люди также имеют повышенный риск заражения.
С другой стороны, когда врожденные мутации происходят на С-конце FH, FH все еще может регулировать комплемент в жидкой фазе крови (уровни C3 остаются нормальными), но он не может должным образом связываться с поверхностью клетки-хозяина, чтобы регулировать комплемент, что приводит к повреждению клеток.Это приводит к потенциальному развитию атипичного гемолитико-уремического синдрома (аГУС), гематологического заболевания, вызывающего гемолиз, образование тромбов, почечную недостаточность и смерть. Для проявления аГУС обычно требуется пусковое событие, включая повреждение эндотелиальных клеток почек, вторичное по отношению к беременности/послеродовому периоду, инфекциям, аутоиммунным заболеваниям или определенным фармакологическим методам лечения [обзор в Nester et al. (2015)]. Текущее лечение аГУС, одобренное FDA, представляет собой ингибирование C5 моноклональными антителами против C5 Eculizumab или Ravulizumab.
(2015)]. Текущее лечение аГУС, одобренное FDA, представляет собой ингибирование C5 моноклональными антителами против C5 Eculizumab или Ravulizumab.
аГУС также может быть вызван мутациями в других областях FH или регуляторов комплемента FI, MCP/CD46 или аутоантител против FH, а также мутациями с усилением функции в C3 или FB [рассмотрено в Nester et др. (2015)]. Другие почечные патологии, вызванные нарушением регуляции АД, включают редкие гломерулопатии C3 (C3G) и нефропатию IgA (IgAN), наиболее частый гломерулонефрит у взрослых [рассмотрено в López-Lera et al. (2019)].
В случае глазной патологии, когда домен SCR 7 FH или FHL-1 имеет определенный полиморфизм, Y402H, у людей значительно выше вероятность развития возрастной дегенерации желтого пятна (ARMD), основной причины слепоты у пожилых людей. , из-за недостаточного контроля активации комплемента в сетчатке [рассмотрено в López-Lera et al.(2019)].
хорошие, плохие и неадекватные
3.1. Нормальное распознавание клеток фактором Н
Ген фактора Н расположен в кластере генов регуляторов активации комплемента (RCA) на хромосоме 1 человека (Rodriguez de et al. , 1985; Vik et al., 1990). Ripoche et al (1988) вывели аминокислотную последовательность из 3 перекрывающихся клонов кДНК. В дополнение к белку фактора Н массой 150 кДа в плазме человека был идентифицирован второй генный продукт, молекула, подобная фактору Н массой 43 кДа (FHL-1) (Schwaeble et al., 1987). Существует также ряд молекул, связанных с фактором H (FHR), рассмотренных в другом месте (Skerka and Zipfel, 2008), которые обладают гомологией с фактором H и FHL-1, хотя они не транскрибируются с гена фактора H. Общим структурным мотивом генов в кластере RCA является единица белка контроля комплемента (CCP) (также известная как короткий консенсусный повтор или SCR), высококонсервативная единица длиной около 60 аминокислот с спейсерами от трех до восьми аминокислот. между доменами (Klickstein et al., 1987). Фактор H состоит из 20 гомологичных CCP-доменов (Kristensen and Tack, 1986; Ripoche et al., 1988), которые в электронном микроскопе придают фактору H вид гибких «бусинок на нитке», способных сворачиваться обратно (рис.
, 1985; Vik et al., 1990). Ripoche et al (1988) вывели аминокислотную последовательность из 3 перекрывающихся клонов кДНК. В дополнение к белку фактора Н массой 150 кДа в плазме человека был идентифицирован второй генный продукт, молекула, подобная фактору Н массой 43 кДа (FHL-1) (Schwaeble et al., 1987). Существует также ряд молекул, связанных с фактором H (FHR), рассмотренных в другом месте (Skerka and Zipfel, 2008), которые обладают гомологией с фактором H и FHL-1, хотя они не транскрибируются с гена фактора H. Общим структурным мотивом генов в кластере RCA является единица белка контроля комплемента (CCP) (также известная как короткий консенсусный повтор или SCR), высококонсервативная единица длиной около 60 аминокислот с спейсерами от трех до восьми аминокислот. между доменами (Klickstein et al., 1987). Фактор H состоит из 20 гомологичных CCP-доменов (Kristensen and Tack, 1986; Ripoche et al., 1988), которые в электронном микроскопе придают фактору H вид гибких «бусинок на нитке», способных сворачиваться обратно (рис. Аслам и Перкинс, 2001 г.; Discipio, 1992 г.; Перкинс и др., 1991 г.; Сим и Перкинс, 1989 г.). Фактическая конформация фактора H может зависеть от ионной силы и рН его локального микроокружения (Okemefuna et al., 2009b).
Аслам и Перкинс, 2001 г.; Discipio, 1992 г.; Перкинс и др., 1991 г.; Сим и Перкинс, 1989 г.). Фактическая конформация фактора H может зависеть от ионной силы и рН его локального микроокружения (Okemefuna et al., 2009b).
Структурно-функциональный анализ определил, что сайт связывания C3b, расположенный в N-концевых четырех доменах CCP, обладает активностью, ускоряющей распад, и кофакторной активностью (Alsenz et al., 1984; Гордон и др., 1995; Кюн и др., 1995; Кун и Зипфель, 1996; Pangburn и др., 1977). Два дополнительных сайта связывания C3b были сопоставлены с различными областями в CCP 7–15 и CCP 19–20 (Jokiranta et al., 1996; Jokiranta et al., 2000; Schmidt et al., 2008b; Sharma and Pangburn, 1996). ). Сайт на CCP 19-20 взаимодействует с C3b, iC3b и C3d (Gordon et al., 1995; Jokiranta et al., 2000; Pangburn et al., 2004) ().
Функциональные домены фактора H и основные области, в которых мутации, полиморфизмы или аутоантитела связаны с заболеванием.Фактор H состоит из 20 единиц CCP. Сплошные линии указывают области фактора H, которые выполняют критические функции, такие как контроль активации комплемента, связывание с C3b, распознавание клеток-хозяев или имеют полиморфизмы, связанные с заболеванием (ARMD), мутации (aHUS) или которые распознаются аутоантителами (aHUS). ) связанные с болезнью. Пунктирные линии указывают области, в которых сайты или функции связывания, о которых сообщалось, остаются неопределенными.
Сплошные линии указывают области фактора H, которые выполняют критические функции, такие как контроль активации комплемента, связывание с C3b, распознавание клеток-хозяев или имеют полиморфизмы, связанные с заболеванием (ARMD), мутации (aHUS) или которые распознаются аутоантителами (aHUS). ) связанные с болезнью. Пунктирные линии указывают области, в которых сайты или функции связывания, о которых сообщалось, остаются неопределенными.
Фактор H имеет по крайней мере три сайта связывания гепарина и других полианионов, расположенных в области CCP 7, CCP 20 и в области CCP 9–15 (Blackmore et al., 1996; Блэкмор и др., 1998b; Джокиранта и др., 2000; Ормсби и др., 2006 г.; Pangburn и др., 1991; Продингер и др., 1998 г.; Sharma and Pangburn, 1996), хотя последние данные ставят под сомнение существование последнего участка (Schmidt et al., 2008b). Также было показано, что С-концевой участок связывает сиаловые кислоты (Blackmore and Gordon, 1996; Ram et al., 1998b). Важно отметить, что сайты связывания C3b и полианионов в CCP 19–20 являются ключевыми для взаимодействия фактора H с поверхностями хозяина (Ferreira et al. , 2006; Jokiranta et al., 2000; Джокиранта и др., 2005 г.; Джози и др., 2007 г.; Пангберн, 2002 г.; Пикеринг и др., 2007 г.; Рам и др., 1998b). Таким образом, было показано, что рекомбинантная форма этих C-концевых CCP (rh29–20) конкурирует с полноразмерным фактором H за связывание с C3b и полианионами хозяина (Ferreira et al., 2006; Ferreira and Pangburn, 2007), что приводит к в повышенной активации комплемента на поверхности хозяина in vitro (Ferreira et al., 2006). Полноразмерный фактор H и изолированный rh29-20 связываются в 7 раз лучше с клетками, несущими C3b и полианионы, чем с клетками, несущими C3b, но лишенными полианионов (Ferreira et al., 2006). Максимальная разница в 10 раз для этого эффекта была зарегистрирована для полноразмерного фактора H (Meri and Pangburn, 1990; Pangburn and Muller-Eberhard, 1978). Кроме того, исследования, анализирующие функции делеционных мутантов фактора H (Pangburn et al., 2000), показали, что делеция пяти С-концевых доменов вызывает 50-кратное снижение связывания с C3b-покрытыми клетками, несущими полианионы.
, 2006; Jokiranta et al., 2000; Джокиранта и др., 2005 г.; Джози и др., 2007 г.; Пангберн, 2002 г.; Пикеринг и др., 2007 г.; Рам и др., 1998b). Таким образом, было показано, что рекомбинантная форма этих C-концевых CCP (rh29–20) конкурирует с полноразмерным фактором H за связывание с C3b и полианионами хозяина (Ferreira et al., 2006; Ferreira and Pangburn, 2007), что приводит к в повышенной активации комплемента на поверхности хозяина in vitro (Ferreira et al., 2006). Полноразмерный фактор H и изолированный rh29-20 связываются в 7 раз лучше с клетками, несущими C3b и полианионы, чем с клетками, несущими C3b, но лишенными полианионов (Ferreira et al., 2006). Максимальная разница в 10 раз для этого эффекта была зарегистрирована для полноразмерного фактора H (Meri and Pangburn, 1990; Pangburn and Muller-Eberhard, 1978). Кроме того, исследования, анализирующие функции делеционных мутантов фактора H (Pangburn et al., 2000), показали, что делеция пяти С-концевых доменов вызывает 50-кратное снижение связывания с C3b-покрытыми клетками, несущими полианионы. Точно так же трансгенная мышь, лишенная четырех С-концевых доменов фактора Н, теряет способность эффективно защищать почечные ткани от атаки комплемента (Pickering et al., 2007). Кроме того, в этих исследованиях было показано, что отсутствие С-концевых доменов, по-видимому, не влияет на способность фактора Н контролировать комплемент в жидкой фазе плазмы (Ferreira et al., 2006; Pickering et al., 2007). . Взятые вместе, эти наблюдения позволяют предположить, что два С-концевых домена могут отвечать за большую часть способностей распознавания/дискриминации фактора H клеткой-хозяином. –20 доменов фактора H взаимодействуют с C3b и полианионами на поверхности клетки.Хотя существуют расхождения в точном расположении С-концевых C3b и полианионных сайтов, исследования структуры/функции действительно согласны с тем, что оба сайта связывания действительно перекрываются, но все же различны (Ferreira et al., 2009; Lehtinen et al., 2009). Связывание С-конца фактора Н с клеткой, по-видимому, зависит от оптимальной комбинации аффинностей как для C3b, так и для полианионных лигандов на неактивирующей поверхности.
Точно так же трансгенная мышь, лишенная четырех С-концевых доменов фактора Н, теряет способность эффективно защищать почечные ткани от атаки комплемента (Pickering et al., 2007). Кроме того, в этих исследованиях было показано, что отсутствие С-концевых доменов, по-видимому, не влияет на способность фактора Н контролировать комплемент в жидкой фазе плазмы (Ferreira et al., 2006; Pickering et al., 2007). . Взятые вместе, эти наблюдения позволяют предположить, что два С-концевых домена могут отвечать за большую часть способностей распознавания/дискриминации фактора H клеткой-хозяином. –20 доменов фактора H взаимодействуют с C3b и полианионами на поверхности клетки.Хотя существуют расхождения в точном расположении С-концевых C3b и полианионных сайтов, исследования структуры/функции действительно согласны с тем, что оба сайта связывания действительно перекрываются, но все же различны (Ferreira et al., 2009; Lehtinen et al., 2009). Связывание С-конца фактора Н с клеткой, по-видимому, зависит от оптимальной комбинации аффинностей как для C3b, так и для полианионных лигандов на неактивирующей поверхности. Таким образом, определенные мутации в CCP 20, которые не изменяют общую структуру домена, но фактически увеличивают их способность связывать полианион (гепарин) и/или C3b при отдельном измерении, в значительной степени снижают способность С-конца связывать комбинации обоих маркеров на клеточной поверхности (Ferreira et al., 2009).
Таким образом, определенные мутации в CCP 20, которые не изменяют общую структуру домена, но фактически увеличивают их способность связывать полианион (гепарин) и/или C3b при отдельном измерении, в значительной степени снижают способность С-конца связывать комбинации обоих маркеров на клеточной поверхности (Ferreira et al., 2009).
В дополнение к сложности того, как фактор H взаимодействует с маркерами хозяина на клеточной поверхности, было показано, что фактор H самоассоциируется в димеры и тетрамеры в присутствии полианионных молекул, и эта самоассоциация, индуцированная полианионами, опосредована, по крайней мере, частично, путем образования комплекса от С-конца к С-концу, в частности, через ССР 18-20 (Pangburn et al., 2009). Это согласуется со структурой тетрамера, наблюдаемой в кристаллах доменов CCP 19–20 (Jokiranta et al., 2005), и слабой самоассоциацией, наблюдаемой с CCP 16–20 (Nan et al., 2008; Okemefuna et al., 2008), предполагая, что С-концевой домен фактора H может формировать контактную точку для образования тетрамера. Кроме того, недавно было показано, что C-конец фактора H образует мультимерные комплексы с C3d, состоящие из димеров каждой молекулы (Okemefuna et al., 2009b). Следовательно, взаимодействие с поверхностными маркерами (полианионами) и C3b/C3d может индуцировать образование определенных кластеров фактора H, которые будут защищать обширные области поверхности благодаря гибкости и вытянутой форме фактора H (12).
Кроме того, недавно было показано, что C-конец фактора H образует мультимерные комплексы с C3d, состоящие из димеров каждой молекулы (Okemefuna et al., 2009b). Следовательно, взаимодействие с поверхностными маркерами (полианионами) и C3b/C3d может индуцировать образование определенных кластеров фактора H, которые будут защищать обширные области поверхности благодаря гибкости и вытянутой форме фактора H (12).
Модель, иллюстрирующая сборку тетрамера, специфичного для клетки-хозяина. Клетки и ткани человека обладают связанными с поверхностью полианионными структурами (красная структура ), включая гепаран, другие гликозаминогликаны и сиаловые кислоты, многие из которых, как известно, взаимодействуют с фактором Н ( синий ). Взаимодействия могут индуцировать самосборку ( левая панель ) в С-концевой области фактора H и приводить к более высокой плотности фактора H на поверхности клеток-хозяев, что инактивирует C3b ( желтая структура ) через N- терминальная область фактора Н. Микробы и другие частицы, как правило, лишены таких полианионов (, правая панель, ), и эти поверхности не будут тетрамеризовать фактор Н, что приведет к снижению контроля над альтернативным путем комплемента. В результате ожидается, что активация альтернативного пути и амплификация C3b будут происходить с минимальным контролем над микробами (, правая панель, ), в то время как амплификация будет ингибироваться у хозяина (, левая панель, ). Мультимерные взаимодействия между C-концевой областью фактора H и C3b/C3d, которые также могут способствовать сборке димера/тетрамера, в этой модели не показаны.
Микробы и другие частицы, как правило, лишены таких полианионов (, правая панель, ), и эти поверхности не будут тетрамеризовать фактор Н, что приведет к снижению контроля над альтернативным путем комплемента. В результате ожидается, что активация альтернативного пути и амплификация C3b будут происходить с минимальным контролем над микробами (, правая панель, ), в то время как амплификация будет ингибироваться у хозяина (, левая панель, ). Мультимерные взаимодействия между C-концевой областью фактора H и C3b/C3d, которые также могут способствовать сборке димера/тетрамера, в этой модели не показаны.
Дополнительным способом, которым фактор H участвует в нормальном распознавании клеток-хозяев, является связывание с клеточными маркерами, которые экспонируются на клетках, подвергающихся апоптозу (запрограммированная гибель клеток). Идентифицированные на сегодняшний день клеточные маркеры, которые перемещаются на поверхности апоптотических клеток и могут распознаваться фактором H, представляют собой ДНК и аннексин II (Leffler et al. , 2010). ДНК была впервые идентифицирована как содержащая два основных связывающих белка, фактор H и фактор B, более 30 лет назад, когда человеческая сыворотка была фракционирована с помощью аффинной хроматографии на ДНК-целлюлозе (Gardner et al., 1980). Аннексин II, обильный белок, связывающий фосфолипиды, который присутствует в цитозоле и на цитоплазматической поверхности плазматической мембраны и ранних эндосомах (Moss, 1992), первоначально был предложен в качестве возможного лиганда для фактора Н, который экспрессируется в постишемической почке. (Коулман и др., 2010). Кроме того, сообщалось, что растворимые белки острой фазы, С-реактивный белок (Mold et al., 1999; Okemefuna et al., 2010) и пентраксин 3 (Deban et al., 2008) обладают способностью связываться с апоптотическими клетками. и рекрутировать фактор H на эту клеточную поверхность (Deban et al., 2008; Гершов и др., 2000). Хотя предполагается, что взаимодействие между фактором H и CRP является артефактом из-за взаимодействия между денатурированным CRP и фактором H (Hakobyan et al.
, 2010). ДНК была впервые идентифицирована как содержащая два основных связывающих белка, фактор H и фактор B, более 30 лет назад, когда человеческая сыворотка была фракционирована с помощью аффинной хроматографии на ДНК-целлюлозе (Gardner et al., 1980). Аннексин II, обильный белок, связывающий фосфолипиды, который присутствует в цитозоле и на цитоплазматической поверхности плазматической мембраны и ранних эндосомах (Moss, 1992), первоначально был предложен в качестве возможного лиганда для фактора Н, который экспрессируется в постишемической почке. (Коулман и др., 2010). Кроме того, сообщалось, что растворимые белки острой фазы, С-реактивный белок (Mold et al., 1999; Okemefuna et al., 2010) и пентраксин 3 (Deban et al., 2008) обладают способностью связываться с апоптотическими клетками. и рекрутировать фактор H на эту клеточную поверхность (Deban et al., 2008; Гершов и др., 2000). Хотя предполагается, что взаимодействие между фактором H и CRP является артефактом из-за взаимодействия между денатурированным CRP и фактором H (Hakobyan et al. , 2008), дополнительные недавние исследования сообщают о его достоверности (Okemefuna et al., 2010). Эти белки острой фазы, по-видимому, служат растворимыми молекулами, которые помогают фактору Н в нормальном распознавании умирающих клеток-хозяев. Известно, что умирающие клетки активируют комплемент для достижения надлежащей опсонизации для эффективного удаления, и связывание фактора Н может иметь важное значение для ограничения чрезмерной активации комплемента во время этого процесса (Trouw et al., 2008). Связывание фактора H с маркерами хозяина на умирающих клетках может также способствовать ограничению активации комплемента, так что она не будет продолжаться дальше отложения C3b. Таким образом, не допуская полного разрушения клеток, можно было бы избежать высвобождения опасных аутоантигенов.
, 2008), дополнительные недавние исследования сообщают о его достоверности (Okemefuna et al., 2010). Эти белки острой фазы, по-видимому, служат растворимыми молекулами, которые помогают фактору Н в нормальном распознавании умирающих клеток-хозяев. Известно, что умирающие клетки активируют комплемент для достижения надлежащей опсонизации для эффективного удаления, и связывание фактора Н может иметь важное значение для ограничения чрезмерной активации комплемента во время этого процесса (Trouw et al., 2008). Связывание фактора H с маркерами хозяина на умирающих клетках может также способствовать ограничению активации комплемента, так что она не будет продолжаться дальше отложения C3b. Таким образом, не допуская полного разрушения клеток, можно было бы избежать высвобождения опасных аутоантигенов.
Сообщалось, что некоторые клетки-хозяева (нейтрофилы, В-лимфоциты, моноциты и тромбоциты) экспрессируют на своей поверхности рецепторы фактора Н, включая рецептор комплемента 3 (CR3; CD11b/CD18; интегрин αMβ2), другие интегрины (αvβ3, αIIbβ3 ) и L-селектин (Ault, 2000; Discipio et al.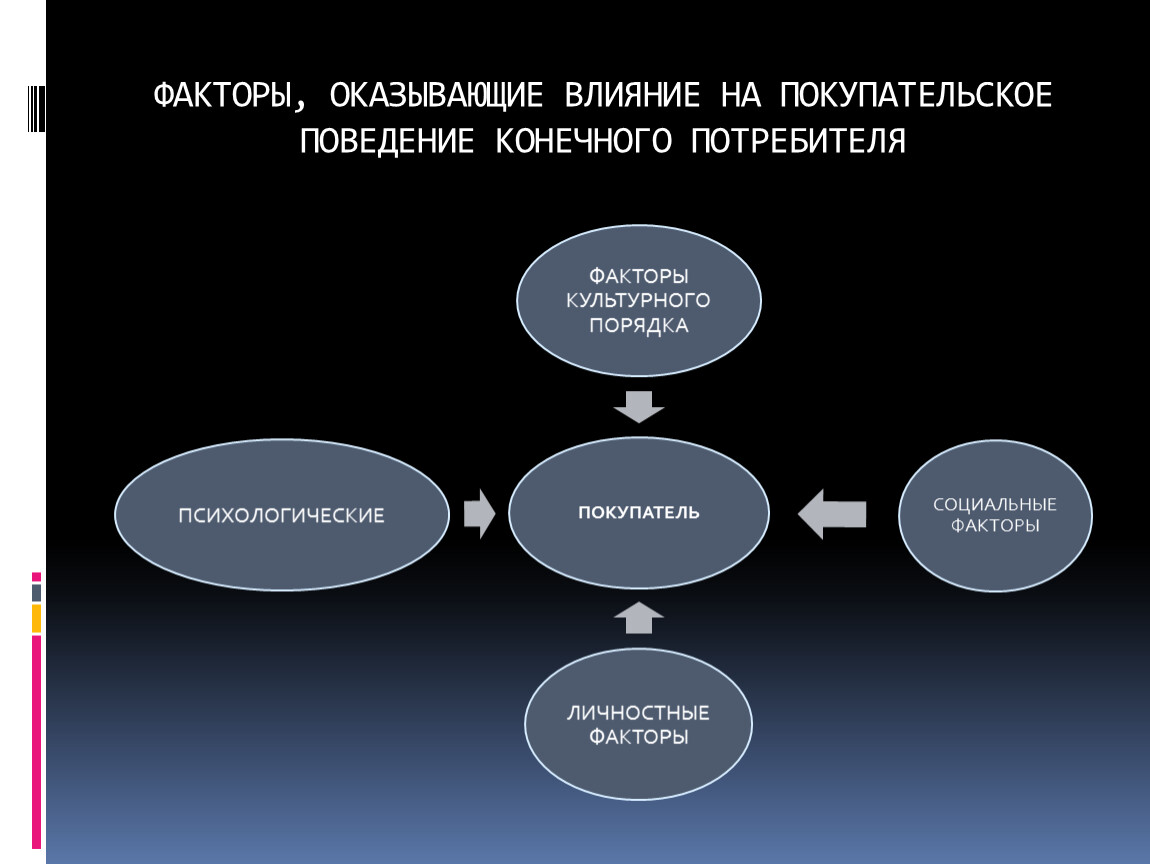 , 1998; Малхотра и др., 1999; Мнджоян и др., 2008). Эти взаимодействия, по-видимому, опосредуют функции, дополнительные к тем, которые участвуют в распознавании хозяином и регуляции комплемента (включая клеточную адгезию и индукцию цитокинов) и выходят за рамки этого обзора.
, 1998; Малхотра и др., 1999; Мнджоян и др., 2008). Эти взаимодействия, по-видимому, опосредуют функции, дополнительные к тем, которые участвуют в распознавании хозяином и регуляции комплемента (включая клеточную адгезию и индукцию цитокинов) и выходят за рамки этого обзора.
Важно отметить, что нормальный фактор H, распознавая маркеры клеток-хозяев, не только контролирует комплемент при нормальном гомеостазе, но также играет важную роль, ограничивая опосредованное комплементом повреждение больных клеток и тканей.Например, нормальный фактор Н (если экспрессируется на нормальных уровнях) может играть важную роль в защите клеток и тканей, подвергающихся патологическим процессам, в патогенезе которых участвует повреждение, опосредованное альтернативным путем. Примеры таких заболеваний рассмотрены в другом месте (Holers, 2008). Одной из причин опосредованного альтернативным путем повреждения собственных тканей является нарушение надлежащей регуляции комплемента. Пример того, как нормальный фактор Н может частично компенсировать этот сбой в контроле комплемента, проиллюстрирован на модели ПНГ (пароксизмальная ночная гемоглобинурия). ПНГ представляет собой приобретенное заболевание стволовых клеток, которое приводит к незначительному синтезу гликозилфосфатидилинозитола (ГФИ) или его полному отсутствию, что приводит к частичному или полному дефициту GPI-связанных мембранных белков, включая фактор, ускоряющий распад регуляторных молекул комплемента (DAF; CD55) и CD59 (Luzzatto). , 2006; Россе, 2001). Потеря этих регуляторов комплемента на эритроцитах хозяина приводит к комплемент-опосредованной патологии при заболевании. Продолжительность жизни in vivo нормальных эритроцитов человека составляет от 60 до 120 дней, однако аномальные клетки ПНГ лизируются за 6-60 дней (Navenot et al., 1998; Rosse, 1971) из-за низкого уровня активации комплемента на их поверхности (Luzzatto, 2006; Navenot et al., 1998; Rosse, 2001). Эти клетки не лизируются за более короткий период времени (т.е. минуты) благодаря защите клеточной поверхности, обеспечиваемой фактором Н (Ferreira and Pangburn, 2007).
ПНГ представляет собой приобретенное заболевание стволовых клеток, которое приводит к незначительному синтезу гликозилфосфатидилинозитола (ГФИ) или его полному отсутствию, что приводит к частичному или полному дефициту GPI-связанных мембранных белков, включая фактор, ускоряющий распад регуляторных молекул комплемента (DAF; CD55) и CD59 (Luzzatto). , 2006; Россе, 2001). Потеря этих регуляторов комплемента на эритроцитах хозяина приводит к комплемент-опосредованной патологии при заболевании. Продолжительность жизни in vivo нормальных эритроцитов человека составляет от 60 до 120 дней, однако аномальные клетки ПНГ лизируются за 6-60 дней (Navenot et al., 1998; Rosse, 1971) из-за низкого уровня активации комплемента на их поверхности (Luzzatto, 2006; Navenot et al., 1998; Rosse, 2001). Эти клетки не лизируются за более короткий период времени (т.е. минуты) благодаря защите клеточной поверхности, обеспечиваемой фактором Н (Ferreira and Pangburn, 2007).
Фактор H вносит вклад в нормальную регуляторную избыточность на поверхности клеток-хозяев, и было показано, что он важен для других сценариев заболевания, таких как экспериментальный аутоиммунный энцефаломиелит (Griffiths et al. , 2009), атеросклероз (Haskard et al., 2008), инсулинорезистентность (Moreno-Navarrete et al., 2010), IgA-нефропатия (Zhang et al., 2009) и цисплатиновая нефропатия (Fuke et al., 2009). В соответствии с важной ролью фактора H в защите тканей хозяина успешное использование химерной молекулы фактора H-CR2 (fH-CR2) в качестве целевого терапевтического агента для ингибирования комплемента в зависимых от альтернативного пути мышиных моделях антител к коллагену индуцированный артрит (Banda et al., 2009), ишемически-реперфузионное повреждение кишечника (Huang et al., 2008) и хориоидальной неоваскуляризации (Rohrer et al., 2009). Фактор H-CR2 также способен уменьшать индуцированное окислительным стрессом комплемент-опосредованное повреждение клеток пигментного эпителия сетчатки in vitro (Rohrer et al., 2009; Thurman et al., 2009). Этот ингибитор использует домен CR2 для нацеливания на сайты начального отложения iC3b/C3d и пять амино-концевых SCR фактора H, которые кодируют регуляторный домен молекулы.
, 2009), атеросклероз (Haskard et al., 2008), инсулинорезистентность (Moreno-Navarrete et al., 2010), IgA-нефропатия (Zhang et al., 2009) и цисплатиновая нефропатия (Fuke et al., 2009). В соответствии с важной ролью фактора H в защите тканей хозяина успешное использование химерной молекулы фактора H-CR2 (fH-CR2) в качестве целевого терапевтического агента для ингибирования комплемента в зависимых от альтернативного пути мышиных моделях антител к коллагену индуцированный артрит (Banda et al., 2009), ишемически-реперфузионное повреждение кишечника (Huang et al., 2008) и хориоидальной неоваскуляризации (Rohrer et al., 2009). Фактор H-CR2 также способен уменьшать индуцированное окислительным стрессом комплемент-опосредованное повреждение клеток пигментного эпителия сетчатки in vitro (Rohrer et al., 2009; Thurman et al., 2009). Этот ингибитор использует домен CR2 для нацеливания на сайты начального отложения iC3b/C3d и пять амино-концевых SCR фактора H, которые кодируют регуляторный домен молекулы.
3.2. Неадекватное распознавание клеток фактором H
Клинические данные указывают на то, что аллели и мутации, влияющие на домены распознавания клетки-хозяина в факторе H, приводят к патологии, связанной с активацией комплемента, о чем свидетельствует наследственный атипичный гемолитико-уремический синдром (aHUS) (de Cordoba and de Jorge, 2008; Holers, 2008), возрастная дегенерация желтого пятна (ARMD) (Holers, 2008) и болезнь плотных отложений (мембранопролиферативный гломерулонефрит II типа) (Pickering and Cook, 2008; de Cordoba and de Jorge, 2008).Атипичный гемолитико-уремический синдром представляет собой заболевание, характеризующееся гемолитической анемией, тромбоцитопенией и острой почечной недостаточностью (Kavanagh et al., 2008). Изучение генетики аГУС привлекло внимание к С-концевым доменам фактора Н, несущим C3d и сайты связывания сиаловой кислоты/полианиона (Bettinaglio et al., 2001; Buddles et al., 2000; Dragon-Durey et al., 2004). ; Heinen et al., 2006; Manuelian et al. , 2003; Pichette et al., 1994; Richards et al., 2001; Rodriguez de Cordoba et al., 2004; Warwicker et al., 1998; Ин и др., 1999; Зипфель и др., 1999). Более того, возрастная дегенерация желтого пятна предполагает, что аналогичная роль может быть у сайта связывания полианионов в CCP 7 (Edwards et al., 2005; Hageman et al., 2005; Haines et al., 2005; Klein et al., 2005). ). Связь мутаций и полиморфизмов фактора H с заболеванием внесла значительный вклад в выяснение того, какие области фактора H важны для распознавания хозяином, как описано в предыдущем разделе.
, 2003; Pichette et al., 1994; Richards et al., 2001; Rodriguez de Cordoba et al., 2004; Warwicker et al., 1998; Ин и др., 1999; Зипфель и др., 1999). Более того, возрастная дегенерация желтого пятна предполагает, что аналогичная роль может быть у сайта связывания полианионов в CCP 7 (Edwards et al., 2005; Hageman et al., 2005; Haines et al., 2005; Klein et al., 2005). ). Связь мутаций и полиморфизмов фактора H с заболеванием внесла значительный вклад в выяснение того, какие области фактора H важны для распознавания хозяином, как описано в предыдущем разделе.
Анализ мутаций показал, что большинство мутаций, связанных с аГУС, сосредоточены на С-конце или опосредованно затрагивают С-конец, особенно домен 20, фактора комплемента Н (Bettinaglio et al., 2001; Герберт и др., 2006 г.; Джокиранта и др., 2006 г.; Перес-Кабальеро и др., 2001; Перкинс и Гудшип, 2002 г.; Ричардс и др., 2001). Было показано, что молекулы, несущие эти мутации в домене 20, обладают дефектной способностью связывать либо C3b, либо полианионы, либо и то, и другое (Ferreira et al. , 2009; Kavanagh et al., 2006; Lehtinen et al., 2009; Schmidt et al. ., 2008a), или, что удивительно, в некоторых случаях иметь повышенное сродство к C3b, как к C3b, так и к полианионам (Ferreira et al., 2009) или только к полианионам (Lehtinen et al., 2009). В одном исследовании (Ferreira et al., 2009) сродство к C3b, измеренное Biacore, хорошо коррелировало со связыванием с зимозаном, покрытым C3b (в котором отсутствуют полианионы). Тем не менее, сродство к C3b и гепарину (при раздельном измерении) не всегда коррелировало с силой связывания с богатыми полианионами поверхностями эритроцитов человека и овцы, на которых был отложен C3b; они также не коррелировали с фенотипом риска заболевания. Другие (Lehtinen et al., 2009) наблюдали корреляцию между способностью некоторых мутантов aHUS связываться с повышенной аффинностью к гепарину и TNF-активированным мышиным гломерулярным эндотелиальным клеткам при сохранении нормальной аффинности C3b.В совокупности многочисленные исследования мутантов, связанных с аГУС (Ferreira et al.
, 2009; Kavanagh et al., 2006; Lehtinen et al., 2009; Schmidt et al. ., 2008a), или, что удивительно, в некоторых случаях иметь повышенное сродство к C3b, как к C3b, так и к полианионам (Ferreira et al., 2009) или только к полианионам (Lehtinen et al., 2009). В одном исследовании (Ferreira et al., 2009) сродство к C3b, измеренное Biacore, хорошо коррелировало со связыванием с зимозаном, покрытым C3b (в котором отсутствуют полианионы). Тем не менее, сродство к C3b и гепарину (при раздельном измерении) не всегда коррелировало с силой связывания с богатыми полианионами поверхностями эритроцитов человека и овцы, на которых был отложен C3b; они также не коррелировали с фенотипом риска заболевания. Другие (Lehtinen et al., 2009) наблюдали корреляцию между способностью некоторых мутантов aHUS связываться с повышенной аффинностью к гепарину и TNF-активированным мышиным гломерулярным эндотелиальным клеткам при сохранении нормальной аффинности C3b.В совокупности многочисленные исследования мутантов, связанных с аГУС (Ferreira et al. , 2009; Lehtinen et al., 2009; Schmidt et al., 2008a), по-видимому, позволяют предположить, что дефект связывания (отрицательный или положительный) с любым из его известных лиганды распознавания клеток (C3b/C3d, полианионы) могут приводить к дефекту связывания комбинации этих лигандов на клеточной поверхности. Следовательно, мутации, связанные с aHUS, могут нарушать сложную взаимосвязь между сродством фактора H к обоим лигандам, необходимым для распознавания клеток.
, 2009; Lehtinen et al., 2009; Schmidt et al., 2008a), по-видимому, позволяют предположить, что дефект связывания (отрицательный или положительный) с любым из его известных лиганды распознавания клеток (C3b/C3d, полианионы) могут приводить к дефекту связывания комбинации этих лигандов на клеточной поверхности. Следовательно, мутации, связанные с aHUS, могут нарушать сложную взаимосвязь между сродством фактора H к обоим лигандам, необходимым для распознавания клеток.
Дополнительные факторы могут играть роль в восприимчивости к аГУС, в том числе то, что мутации могут мешать третьему функциональному сайту в CCP 19–20, возможно, отличному от тех, которые участвуют в связывании C3b или полианиона. Например, мутация может повлиять на область, участвующую в формировании предполагаемых димеров или тетрамеров (Nan et al., 2008; Okemefuna et al., 2008; Okemefuna et al., 2009a; Pangburn et al., 2009), что может быть важным для связывания/функции фактора H на клеточной поверхности.Аутоантитела к фактору H также были идентифицированы у пациентов с аГУС, и их специфичность была картирована на С-конце в области, которая считается горячей точкой для связанных с аГУС мутаций (Skerka et al. , 2009; Strobel et al., 2010), который является той же областью, которая необходима для функций распознавания фактора H.
, 2009; Strobel et al., 2010), который является той же областью, которая необходима для функций распознавания фактора H.
ARMD является основной причиной слепоты у пожилых людей (Klein et al., 2004) и, по-видимому, является еще одним примером заболевания, вызванного неадекватно контролируемой активацией каскада комплемента, хотя точные молекулярные механизмы еще предстоит определить.ARMD тесно связан с вариантом одной аминокислоты в и седьмом (Y402H) доменах фактора H, в то время как присутствие Ile62 в факторе H CCP1 связано с более низким риском ARMD и болезни плотных отложений (Edwards et al., 2005; Hageman et al., 2005; Haines et al., 2005; Klein et al., 2005). Было показано, что рекомбинантные фрагменты фактора H, включающие полиморфизм Y402H, имеют нарушенную способность взаимодействовать с различными лигандами, включая гепарин, С-реактивный белок и фибромодулин (Clark et al., 2006; Герберт и др., 2007 г.; Лайне и др., 2007 г.; Шоберг и др., 2007 г.; Skerka et al., 2007), демонстрируя повышенное связывание с ДНК и некротическими клетками (Sjoberg et al.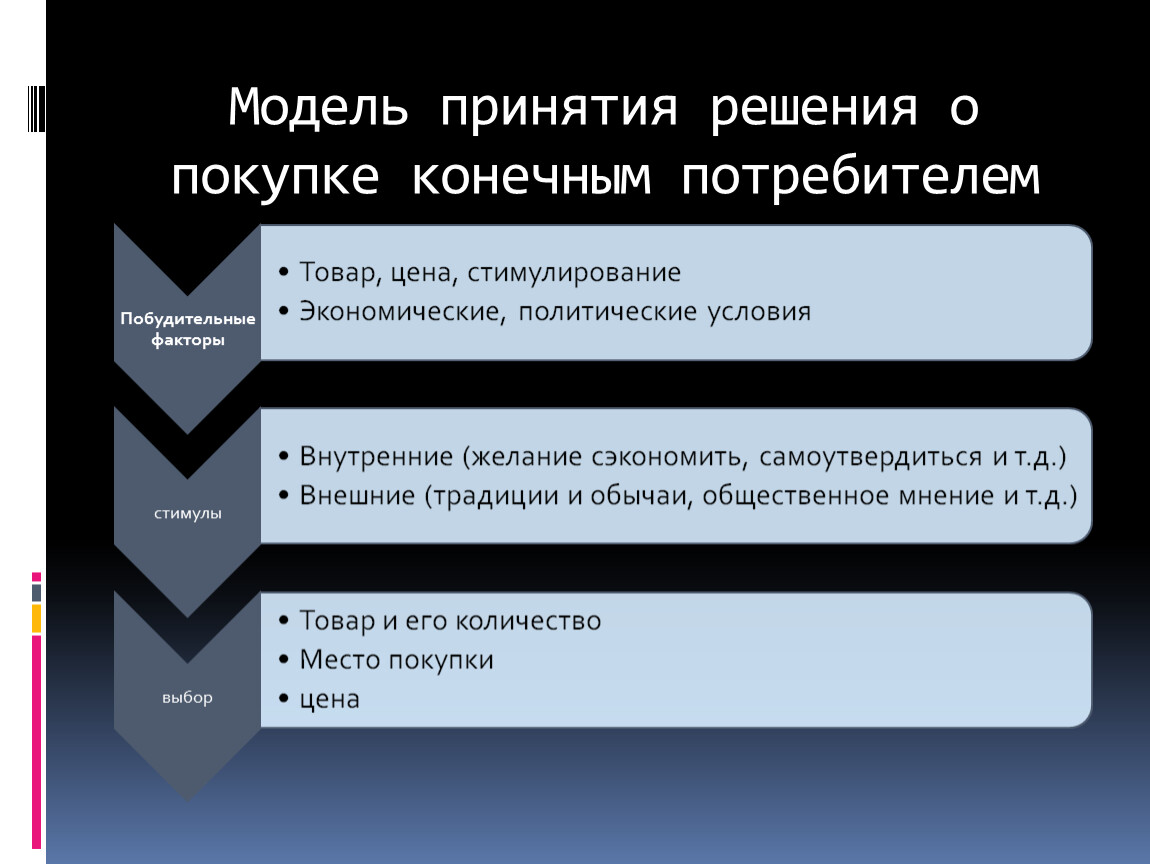 , 2007). Было показано, что вариант FHL-1 Y402H обладает пониженной активностью кофактора на поверхности клеток CHO (Skerka et al., 2007). Кроме того, фактор H, очищенный от особей, гомозиготных по вариантам Ile62 или Val62 и идентичных по всем остальным аминокислотным остаткам, показал, что защитный вариант (Ile62) проявляет повышенное связывание с C3b и является более эффективным кофактором для фактора I по сравнению с . вариант, связанный с ARMD (Tortajada et al., 2009).
, 2007). Было показано, что вариант FHL-1 Y402H обладает пониженной активностью кофактора на поверхности клеток CHO (Skerka et al., 2007). Кроме того, фактор H, очищенный от особей, гомозиготных по вариантам Ile62 или Val62 и идентичных по всем остальным аминокислотным остаткам, показал, что защитный вариант (Ile62) проявляет повышенное связывание с C3b и является более эффективным кофактором для фактора I по сравнению с . вариант, связанный с ARMD (Tortajada et al., 2009).
Болезнь плотных отложений (мембранопролиферативный гломерулонефрит II типа) сопровождается массивной активацией комплемента по альтернативному пути за счет неконтролируемой активации жидкой фазы и неадекватно контролируемой поверхностной активации. Это может привести к полной недостаточности органов (Pickering and Cook, 2008; Pickering et al., 2002). В линии свиней с дефицитом фактора H гомозиготные особи умирают вскоре после рождения от комплемент-опосредованной острой почечной недостаточности (Hogasen et al. , 1995), а у мышей с дефицитом фактора H спонтанно развивается мембранопролиферативный гломерулонефрит (Pickering et al., 2002).
, 1995), а у мышей с дефицитом фактора H спонтанно развивается мембранопролиферативный гломерулонефрит (Pickering et al., 2002).
Как упоминалось выше, мутации и полиморфизмы фактора H связаны с заболеваниями, поражающими различные ткани (например, почки, глаза). Точно так же появляется все больше доказательств того, что каждый сайт связывания полианиона на факторе H имеет уникальную специфичность. Например, было показано, что домен 7 демонстрирует профиль распознавания полианионов, отличный от профиля CCP 19-20 (Ormsby et al., 2006). Таким образом, вероятно, что фактор H проявляет специфическое распознавание клеточного типа в зависимости от массива полианионов, которые конкретная клетка экспрессирует на своей поверхности.
Интересно, что определенные клеточные стрессовые состояния могут приводить к подавлению экспрессии фактора H, например, гипоксия (Okroj et al., 2009) и стресс, вызванный сульфатом металла (Pogue et al., 2009). Снижение экспрессии фактора H, наблюдаемое в нервных клетках из-за последнего, может привести к неадекватной защите фактором H, способствуя воспалительным реакциям, наблюдаемым при нейродегенеративных заболеваниях, таких как болезнь Альцгеймера (Pogue et al. , 2009).
, 2009).
Терапевтические стратегии, основанные на ингибировании комплемента, должны способствовать уменьшению опосредованного комплементом повреждения клеток и тканей из-за неадекватной защиты фактором Н.Недавно экулизумаб (моноклональное антитело против C5 от Alexion), первый одобренный ингибитор комплемента для лечения ПНГ человека, был протестирован с положительными результатами у пациентов с аГУС (Davin et al., 2009; De et al., 2010) и был рекомендован при болезни плотных отложений (Smith et al., 2007). Дополнительные стратегии ингибирования комплемента, такие как использование компстатина, пептида, который связывается с C3 и ингибирует все три пути комплемента (Sahu et al., 1996), были рассмотрены в другом месте (Qu et al., 2009). Для заболеваний, вызванных неадекватной защитой фактора H на клеточных поверхностях, могут оказаться многообещающими более целенаправленные стратегии, такие как использование химерного белка fH-CR2, описанного в предыдущем разделе.
хорошие, плохие и неадекватные
3.
 1. Нормальное распознавание клеток фактором Н
1. Нормальное распознавание клеток фактором Н
Ген фактора Н расположен в кластере генов регуляторов активации комплемента (RCA) на хромосоме 1 человека (Rodriguez de et al., 1985; Vik et al., 1990). Ripoche et al (1988) вывели аминокислотную последовательность из 3 перекрывающихся клонов кДНК.В дополнение к белку фактора Н массой 150 кДа в плазме человека был идентифицирован второй генный продукт, молекула, подобная фактору Н массой 43 кДа (FHL-1) (Schwaeble et al., 1987). Существует также ряд молекул, связанных с фактором H (FHR), рассмотренных в другом месте (Skerka and Zipfel, 2008), которые обладают гомологией с фактором H и FHL-1, хотя они не транскрибируются с гена фактора H. Общим структурным мотивом генов в кластере RCA является единица белка контроля комплемента (CCP) (также известная как короткий консенсусный повтор или SCR), высококонсервативная единица длиной около 60 аминокислот с спейсерами от трех до восьми аминокислот. между доменами (Klickstein et al., 1987). Фактор H состоит из 20 гомологичных CCP-доменов (Kristensen and Tack, 1986; Ripoche et al. , 1988), которые в электронном микроскопе придают фактору H вид гибких «бусинок на нитке», способных сворачиваться обратно (рис. Аслам и Перкинс, 2001 г.; Discipio, 1992 г.; Перкинс и др., 1991 г.; Сим и Перкинс, 1989 г.). Фактическая конформация фактора H может зависеть от ионной силы и рН его локального микроокружения (Okemefuna et al., 2009b).
, 1988), которые в электронном микроскопе придают фактору H вид гибких «бусинок на нитке», способных сворачиваться обратно (рис. Аслам и Перкинс, 2001 г.; Discipio, 1992 г.; Перкинс и др., 1991 г.; Сим и Перкинс, 1989 г.). Фактическая конформация фактора H может зависеть от ионной силы и рН его локального микроокружения (Okemefuna et al., 2009b).
Структурно-функциональный анализ определил, что сайт связывания C3b, расположенный в N-концевых четырех доменах CCP, обладает активностью, ускоряющей распад, и кофакторной активностью (Alsenz et al., 1984; Гордон и др., 1995; Кюн и др., 1995; Кун и Зипфель, 1996; Pangburn и др., 1977). Два дополнительных сайта связывания C3b были сопоставлены с различными областями в CCP 7–15 и CCP 19–20 (Jokiranta et al., 1996; Jokiranta et al., 2000; Schmidt et al., 2008b; Sharma and Pangburn, 1996). ). Сайт на CCP 19-20 взаимодействует с C3b, iC3b и C3d (Gordon et al., 1995; Jokiranta et al., 2000; Pangburn et al., 2004) ().
Функциональные домены фактора H и основные области, в которых мутации, полиморфизмы или аутоантитела связаны с заболеванием. Фактор H состоит из 20 единиц CCP. Сплошные линии указывают области фактора H, которые выполняют критические функции, такие как контроль активации комплемента, связывание с C3b, распознавание клеток-хозяев или имеют полиморфизмы, связанные с заболеванием (ARMD), мутации (aHUS) или которые распознаются аутоантителами (aHUS). ) связанные с болезнью. Пунктирные линии указывают области, в которых сайты или функции связывания, о которых сообщалось, остаются неопределенными.
Фактор H состоит из 20 единиц CCP. Сплошные линии указывают области фактора H, которые выполняют критические функции, такие как контроль активации комплемента, связывание с C3b, распознавание клеток-хозяев или имеют полиморфизмы, связанные с заболеванием (ARMD), мутации (aHUS) или которые распознаются аутоантителами (aHUS). ) связанные с болезнью. Пунктирные линии указывают области, в которых сайты или функции связывания, о которых сообщалось, остаются неопределенными.
Фактор H имеет по крайней мере три сайта связывания гепарина и других полианионов, расположенных в области CCP 7, CCP 20 и в области CCP 9–15 (Blackmore et al., 1996; Блэкмор и др., 1998b; Джокиранта и др., 2000; Ормсби и др., 2006 г.; Pangburn и др., 1991; Продингер и др., 1998 г.; Sharma and Pangburn, 1996), хотя последние данные ставят под сомнение существование последнего участка (Schmidt et al., 2008b). Также было показано, что С-концевой участок связывает сиаловые кислоты (Blackmore and Gordon, 1996; Ram et al. , 1998b). Важно отметить, что сайты связывания C3b и полианионов в CCP 19–20 являются ключевыми для взаимодействия фактора H с поверхностями хозяина (Ferreira et al., 2006; Jokiranta et al., 2000; Джокиранта и др., 2005 г.; Джози и др., 2007 г.; Пангберн, 2002 г.; Пикеринг и др., 2007 г.; Рам и др., 1998b). Таким образом, было показано, что рекомбинантная форма этих C-концевых CCP (rh29–20) конкурирует с полноразмерным фактором H за связывание с C3b и полианионами хозяина (Ferreira et al., 2006; Ferreira and Pangburn, 2007), что приводит к в повышенной активации комплемента на поверхности хозяина in vitro (Ferreira et al., 2006). Полноразмерный фактор H и изолированный rh29-20 связываются в 7 раз лучше с клетками, несущими C3b и полианионы, чем с клетками, несущими C3b, но лишенными полианионов (Ferreira et al., 2006). Максимальная разница в 10 раз для этого эффекта была зарегистрирована для полноразмерного фактора H (Meri and Pangburn, 1990; Pangburn and Muller-Eberhard, 1978).
, 1998b). Важно отметить, что сайты связывания C3b и полианионов в CCP 19–20 являются ключевыми для взаимодействия фактора H с поверхностями хозяина (Ferreira et al., 2006; Jokiranta et al., 2000; Джокиранта и др., 2005 г.; Джози и др., 2007 г.; Пангберн, 2002 г.; Пикеринг и др., 2007 г.; Рам и др., 1998b). Таким образом, было показано, что рекомбинантная форма этих C-концевых CCP (rh29–20) конкурирует с полноразмерным фактором H за связывание с C3b и полианионами хозяина (Ferreira et al., 2006; Ferreira and Pangburn, 2007), что приводит к в повышенной активации комплемента на поверхности хозяина in vitro (Ferreira et al., 2006). Полноразмерный фактор H и изолированный rh29-20 связываются в 7 раз лучше с клетками, несущими C3b и полианионы, чем с клетками, несущими C3b, но лишенными полианионов (Ferreira et al., 2006). Максимальная разница в 10 раз для этого эффекта была зарегистрирована для полноразмерного фактора H (Meri and Pangburn, 1990; Pangburn and Muller-Eberhard, 1978). Кроме того, исследования, анализирующие функции делеционных мутантов фактора H (Pangburn et al., 2000), показали, что делеция пяти С-концевых доменов вызывает 50-кратное снижение связывания с C3b-покрытыми клетками, несущими полианионы. Точно так же трансгенная мышь, лишенная четырех С-концевых доменов фактора Н, теряет способность эффективно защищать почечные ткани от атаки комплемента (Pickering et al., 2007). Кроме того, в этих исследованиях было показано, что отсутствие С-концевых доменов, по-видимому, не влияет на способность фактора Н контролировать комплемент в жидкой фазе плазмы (Ferreira et al., 2006; Pickering et al., 2007). . Взятые вместе, эти наблюдения позволяют предположить, что два С-концевых домена могут отвечать за большую часть способностей распознавания/дискриминации фактора H клеткой-хозяином. –20 доменов фактора H взаимодействуют с C3b и полианионами на поверхности клетки.Хотя существуют расхождения в точном расположении С-концевых C3b и полианионных сайтов, исследования структуры/функции действительно согласны с тем, что оба сайта связывания действительно перекрываются, но все же различны (Ferreira et al.
Кроме того, исследования, анализирующие функции делеционных мутантов фактора H (Pangburn et al., 2000), показали, что делеция пяти С-концевых доменов вызывает 50-кратное снижение связывания с C3b-покрытыми клетками, несущими полианионы. Точно так же трансгенная мышь, лишенная четырех С-концевых доменов фактора Н, теряет способность эффективно защищать почечные ткани от атаки комплемента (Pickering et al., 2007). Кроме того, в этих исследованиях было показано, что отсутствие С-концевых доменов, по-видимому, не влияет на способность фактора Н контролировать комплемент в жидкой фазе плазмы (Ferreira et al., 2006; Pickering et al., 2007). . Взятые вместе, эти наблюдения позволяют предположить, что два С-концевых домена могут отвечать за большую часть способностей распознавания/дискриминации фактора H клеткой-хозяином. –20 доменов фактора H взаимодействуют с C3b и полианионами на поверхности клетки.Хотя существуют расхождения в точном расположении С-концевых C3b и полианионных сайтов, исследования структуры/функции действительно согласны с тем, что оба сайта связывания действительно перекрываются, но все же различны (Ferreira et al. , 2009; Lehtinen et al., 2009). Связывание С-конца фактора Н с клеткой, по-видимому, зависит от оптимальной комбинации аффинностей как для C3b, так и для полианионных лигандов на неактивирующей поверхности. Таким образом, определенные мутации в CCP 20, которые не изменяют общую структуру домена, но фактически увеличивают их способность связывать полианион (гепарин) и/или C3b при отдельном измерении, в значительной степени снижают способность С-конца связывать комбинации обоих маркеров на клеточной поверхности (Ferreira et al., 2009).
, 2009; Lehtinen et al., 2009). Связывание С-конца фактора Н с клеткой, по-видимому, зависит от оптимальной комбинации аффинностей как для C3b, так и для полианионных лигандов на неактивирующей поверхности. Таким образом, определенные мутации в CCP 20, которые не изменяют общую структуру домена, но фактически увеличивают их способность связывать полианион (гепарин) и/или C3b при отдельном измерении, в значительной степени снижают способность С-конца связывать комбинации обоих маркеров на клеточной поверхности (Ferreira et al., 2009).
В дополнение к сложности того, как фактор H взаимодействует с маркерами хозяина на клеточной поверхности, было показано, что фактор H самоассоциируется в димеры и тетрамеры в присутствии полианионных молекул, и эта самоассоциация, индуцированная полианионами, опосредована, по крайней мере, частично, путем образования комплекса от С-конца к С-концу, в частности, через ССР 18-20 (Pangburn et al., 2009). Это согласуется со структурой тетрамера, наблюдаемой в кристаллах доменов CCP 19–20 (Jokiranta et al. , 2005), и слабой самоассоциацией, наблюдаемой с CCP 16–20 (Nan et al., 2008; Okemefuna et al., 2008), предполагая, что С-концевой домен фактора H может формировать контактную точку для образования тетрамера. Кроме того, недавно было показано, что C-конец фактора H образует мультимерные комплексы с C3d, состоящие из димеров каждой молекулы (Okemefuna et al., 2009b). Следовательно, взаимодействие с поверхностными маркерами (полианионами) и C3b/C3d может индуцировать образование определенных кластеров фактора H, которые будут защищать обширные области поверхности благодаря гибкости и вытянутой форме фактора H (12).
, 2005), и слабой самоассоциацией, наблюдаемой с CCP 16–20 (Nan et al., 2008; Okemefuna et al., 2008), предполагая, что С-концевой домен фактора H может формировать контактную точку для образования тетрамера. Кроме того, недавно было показано, что C-конец фактора H образует мультимерные комплексы с C3d, состоящие из димеров каждой молекулы (Okemefuna et al., 2009b). Следовательно, взаимодействие с поверхностными маркерами (полианионами) и C3b/C3d может индуцировать образование определенных кластеров фактора H, которые будут защищать обширные области поверхности благодаря гибкости и вытянутой форме фактора H (12).
Модель, иллюстрирующая сборку тетрамера, специфичного для клетки-хозяина. Клетки и ткани человека обладают связанными с поверхностью полианионными структурами (красная структура ), включая гепаран, другие гликозаминогликаны и сиаловые кислоты, многие из которых, как известно, взаимодействуют с фактором Н ( синий ). Взаимодействия могут индуцировать самосборку ( левая панель ) в С-концевой области фактора H и приводить к более высокой плотности фактора H на поверхности клеток-хозяев, что инактивирует C3b ( желтая структура ) через N- терминальная область фактора Н. Микробы и другие частицы, как правило, лишены таких полианионов (, правая панель, ), и эти поверхности не будут тетрамеризовать фактор Н, что приведет к снижению контроля над альтернативным путем комплемента. В результате ожидается, что активация альтернативного пути и амплификация C3b будут происходить с минимальным контролем над микробами (, правая панель, ), в то время как амплификация будет ингибироваться у хозяина (, левая панель, ). Мультимерные взаимодействия между C-концевой областью фактора H и C3b/C3d, которые также могут способствовать сборке димера/тетрамера, в этой модели не показаны.
Микробы и другие частицы, как правило, лишены таких полианионов (, правая панель, ), и эти поверхности не будут тетрамеризовать фактор Н, что приведет к снижению контроля над альтернативным путем комплемента. В результате ожидается, что активация альтернативного пути и амплификация C3b будут происходить с минимальным контролем над микробами (, правая панель, ), в то время как амплификация будет ингибироваться у хозяина (, левая панель, ). Мультимерные взаимодействия между C-концевой областью фактора H и C3b/C3d, которые также могут способствовать сборке димера/тетрамера, в этой модели не показаны.
Дополнительным способом, которым фактор H участвует в нормальном распознавании клеток-хозяев, является связывание с клеточными маркерами, которые экспонируются на клетках, подвергающихся апоптозу (запрограммированная гибель клеток). Идентифицированные на сегодняшний день клеточные маркеры, которые перемещаются на поверхности апоптотических клеток и могут распознаваться фактором H, представляют собой ДНК и аннексин II (Leffler et al. , 2010). ДНК была впервые идентифицирована как содержащая два основных связывающих белка, фактор H и фактор B, более 30 лет назад, когда человеческая сыворотка была фракционирована с помощью аффинной хроматографии на ДНК-целлюлозе (Gardner et al., 1980). Аннексин II, обильный белок, связывающий фосфолипиды, который присутствует в цитозоле и на цитоплазматической поверхности плазматической мембраны и ранних эндосомах (Moss, 1992), первоначально был предложен в качестве возможного лиганда для фактора Н, который экспрессируется в постишемической почке. (Коулман и др., 2010). Кроме того, сообщалось, что растворимые белки острой фазы, С-реактивный белок (Mold et al., 1999; Okemefuna et al., 2010) и пентраксин 3 (Deban et al., 2008) обладают способностью связываться с апоптотическими клетками. и рекрутировать фактор H на эту клеточную поверхность (Deban et al., 2008; Гершов и др., 2000). Хотя предполагается, что взаимодействие между фактором H и CRP является артефактом из-за взаимодействия между денатурированным CRP и фактором H (Hakobyan et al.
, 2010). ДНК была впервые идентифицирована как содержащая два основных связывающих белка, фактор H и фактор B, более 30 лет назад, когда человеческая сыворотка была фракционирована с помощью аффинной хроматографии на ДНК-целлюлозе (Gardner et al., 1980). Аннексин II, обильный белок, связывающий фосфолипиды, который присутствует в цитозоле и на цитоплазматической поверхности плазматической мембраны и ранних эндосомах (Moss, 1992), первоначально был предложен в качестве возможного лиганда для фактора Н, который экспрессируется в постишемической почке. (Коулман и др., 2010). Кроме того, сообщалось, что растворимые белки острой фазы, С-реактивный белок (Mold et al., 1999; Okemefuna et al., 2010) и пентраксин 3 (Deban et al., 2008) обладают способностью связываться с апоптотическими клетками. и рекрутировать фактор H на эту клеточную поверхность (Deban et al., 2008; Гершов и др., 2000). Хотя предполагается, что взаимодействие между фактором H и CRP является артефактом из-за взаимодействия между денатурированным CRP и фактором H (Hakobyan et al. , 2008), дополнительные недавние исследования сообщают о его достоверности (Okemefuna et al., 2010). Эти белки острой фазы, по-видимому, служат растворимыми молекулами, которые помогают фактору Н в нормальном распознавании умирающих клеток-хозяев. Известно, что умирающие клетки активируют комплемент для достижения надлежащей опсонизации для эффективного удаления, и связывание фактора Н может иметь важное значение для ограничения чрезмерной активации комплемента во время этого процесса (Trouw et al., 2008). Связывание фактора H с маркерами хозяина на умирающих клетках может также способствовать ограничению активации комплемента, так что она не будет продолжаться дальше отложения C3b. Таким образом, не допуская полного разрушения клеток, можно было бы избежать высвобождения опасных аутоантигенов.
, 2008), дополнительные недавние исследования сообщают о его достоверности (Okemefuna et al., 2010). Эти белки острой фазы, по-видимому, служат растворимыми молекулами, которые помогают фактору Н в нормальном распознавании умирающих клеток-хозяев. Известно, что умирающие клетки активируют комплемент для достижения надлежащей опсонизации для эффективного удаления, и связывание фактора Н может иметь важное значение для ограничения чрезмерной активации комплемента во время этого процесса (Trouw et al., 2008). Связывание фактора H с маркерами хозяина на умирающих клетках может также способствовать ограничению активации комплемента, так что она не будет продолжаться дальше отложения C3b. Таким образом, не допуская полного разрушения клеток, можно было бы избежать высвобождения опасных аутоантигенов.
Сообщалось, что некоторые клетки-хозяева (нейтрофилы, В-лимфоциты, моноциты и тромбоциты) экспрессируют на своей поверхности рецепторы фактора Н, включая рецептор комплемента 3 (CR3; CD11b/CD18; интегрин αMβ2), другие интегрины (αvβ3, αIIbβ3 ) и L-селектин (Ault, 2000; Discipio et al. , 1998; Малхотра и др., 1999; Мнджоян и др., 2008). Эти взаимодействия, по-видимому, опосредуют функции, дополнительные к тем, которые участвуют в распознавании хозяином и регуляции комплемента (включая клеточную адгезию и индукцию цитокинов) и выходят за рамки этого обзора.
, 1998; Малхотра и др., 1999; Мнджоян и др., 2008). Эти взаимодействия, по-видимому, опосредуют функции, дополнительные к тем, которые участвуют в распознавании хозяином и регуляции комплемента (включая клеточную адгезию и индукцию цитокинов) и выходят за рамки этого обзора.
Важно отметить, что нормальный фактор H, распознавая маркеры клеток-хозяев, не только контролирует комплемент при нормальном гомеостазе, но также играет важную роль, ограничивая опосредованное комплементом повреждение больных клеток и тканей.Например, нормальный фактор Н (если экспрессируется на нормальных уровнях) может играть важную роль в защите клеток и тканей, подвергающихся патологическим процессам, в патогенезе которых участвует повреждение, опосредованное альтернативным путем. Примеры таких заболеваний рассмотрены в другом месте (Holers, 2008). Одной из причин опосредованного альтернативным путем повреждения собственных тканей является нарушение надлежащей регуляции комплемента. Пример того, как нормальный фактор Н может частично компенсировать этот сбой в контроле комплемента, проиллюстрирован на модели ПНГ (пароксизмальная ночная гемоглобинурия). ПНГ представляет собой приобретенное заболевание стволовых клеток, которое приводит к незначительному синтезу гликозилфосфатидилинозитола (ГФИ) или его полному отсутствию, что приводит к частичному или полному дефициту GPI-связанных мембранных белков, включая фактор, ускоряющий распад регуляторных молекул комплемента (DAF; CD55) и CD59 (Luzzatto). , 2006; Россе, 2001). Потеря этих регуляторов комплемента на эритроцитах хозяина приводит к комплемент-опосредованной патологии при заболевании. Продолжительность жизни in vivo нормальных эритроцитов человека составляет от 60 до 120 дней, однако аномальные клетки ПНГ лизируются за 6-60 дней (Navenot et al., 1998; Rosse, 1971) из-за низкого уровня активации комплемента на их поверхности (Luzzatto, 2006; Navenot et al., 1998; Rosse, 2001). Эти клетки не лизируются за более короткий период времени (т.е. минуты) благодаря защите клеточной поверхности, обеспечиваемой фактором Н (Ferreira and Pangburn, 2007).
ПНГ представляет собой приобретенное заболевание стволовых клеток, которое приводит к незначительному синтезу гликозилфосфатидилинозитола (ГФИ) или его полному отсутствию, что приводит к частичному или полному дефициту GPI-связанных мембранных белков, включая фактор, ускоряющий распад регуляторных молекул комплемента (DAF; CD55) и CD59 (Luzzatto). , 2006; Россе, 2001). Потеря этих регуляторов комплемента на эритроцитах хозяина приводит к комплемент-опосредованной патологии при заболевании. Продолжительность жизни in vivo нормальных эритроцитов человека составляет от 60 до 120 дней, однако аномальные клетки ПНГ лизируются за 6-60 дней (Navenot et al., 1998; Rosse, 1971) из-за низкого уровня активации комплемента на их поверхности (Luzzatto, 2006; Navenot et al., 1998; Rosse, 2001). Эти клетки не лизируются за более короткий период времени (т.е. минуты) благодаря защите клеточной поверхности, обеспечиваемой фактором Н (Ferreira and Pangburn, 2007).
Фактор H вносит вклад в нормальную регуляторную избыточность на поверхности клеток-хозяев, и было показано, что он важен для других сценариев заболевания, таких как экспериментальный аутоиммунный энцефаломиелит (Griffiths et al., 2009), атеросклероз (Haskard et al., 2008), инсулинорезистентность (Moreno-Navarrete et al., 2010), IgA-нефропатия (Zhang et al., 2009) и цисплатиновая нефропатия (Fuke et al., 2009). В соответствии с важной ролью фактора H в защите тканей хозяина успешное использование химерной молекулы фактора H-CR2 (fH-CR2) в качестве целевого терапевтического агента для ингибирования комплемента в зависимых от альтернативного пути мышиных моделях антител к коллагену индуцированный артрит (Banda et al., 2009), ишемически-реперфузионное повреждение кишечника (Huang et al., 2008) и хориоидальной неоваскуляризации (Rohrer et al., 2009). Фактор H-CR2 также способен уменьшать индуцированное окислительным стрессом комплемент-опосредованное повреждение клеток пигментного эпителия сетчатки in vitro (Rohrer et al., 2009; Thurman et al., 2009). Этот ингибитор использует домен CR2 для нацеливания на сайты начального отложения iC3b/C3d и пять амино-концевых SCR фактора H, которые кодируют регуляторный домен молекулы.
3.2. Неадекватное распознавание клеток фактором H
Клинические данные указывают на то, что аллели и мутации, влияющие на домены распознавания клетки-хозяина в факторе H, приводят к патологии, связанной с активацией комплемента, о чем свидетельствует наследственный атипичный гемолитико-уремический синдром (aHUS) (de Cordoba and de Jorge, 2008; Holers, 2008), возрастная дегенерация желтого пятна (ARMD) (Holers, 2008) и болезнь плотных отложений (мембранопролиферативный гломерулонефрит II типа) (Pickering and Cook, 2008; de Cordoba and de Jorge, 2008).Атипичный гемолитико-уремический синдром представляет собой заболевание, характеризующееся гемолитической анемией, тромбоцитопенией и острой почечной недостаточностью (Kavanagh et al., 2008). Изучение генетики аГУС привлекло внимание к С-концевым доменам фактора Н, несущим C3d и сайты связывания сиаловой кислоты/полианиона (Bettinaglio et al., 2001; Buddles et al., 2000; Dragon-Durey et al., 2004). ; Heinen et al., 2006; Manuelian et al., 2003; Pichette et al., 1994; Richards et al., 2001; Rodriguez de Cordoba et al., 2004; Warwicker et al., 1998; Ин и др., 1999; Зипфель и др., 1999). Более того, возрастная дегенерация желтого пятна предполагает, что аналогичная роль может быть у сайта связывания полианионов в CCP 7 (Edwards et al., 2005; Hageman et al., 2005; Haines et al., 2005; Klein et al., 2005). ). Связь мутаций и полиморфизмов фактора H с заболеванием внесла значительный вклад в выяснение того, какие области фактора H важны для распознавания хозяином, как описано в предыдущем разделе.
Анализ мутаций показал, что большинство мутаций, связанных с аГУС, сосредоточены на С-конце или опосредованно затрагивают С-конец, особенно домен 20, фактора комплемента Н (Bettinaglio et al., 2001; Герберт и др., 2006 г.; Джокиранта и др., 2006 г.; Перес-Кабальеро и др., 2001; Перкинс и Гудшип, 2002 г.; Ричардс и др., 2001). Было показано, что молекулы, несущие эти мутации в домене 20, обладают дефектной способностью связывать либо C3b, либо полианионы, либо и то, и другое (Ferreira et al., 2009; Kavanagh et al., 2006; Lehtinen et al., 2009; Schmidt et al. ., 2008a), или, что удивительно, в некоторых случаях иметь повышенное сродство к C3b, как к C3b, так и к полианионам (Ferreira et al., 2009) или только к полианионам (Lehtinen et al., 2009). В одном исследовании (Ferreira et al., 2009) сродство к C3b, измеренное Biacore, хорошо коррелировало со связыванием с зимозаном, покрытым C3b (в котором отсутствуют полианионы). Тем не менее, сродство к C3b и гепарину (при раздельном измерении) не всегда коррелировало с силой связывания с богатыми полианионами поверхностями эритроцитов человека и овцы, на которых был отложен C3b; они также не коррелировали с фенотипом риска заболевания. Другие (Lehtinen et al., 2009) наблюдали корреляцию между способностью некоторых мутантов aHUS связываться с повышенной аффинностью к гепарину и TNF-активированным мышиным гломерулярным эндотелиальным клеткам при сохранении нормальной аффинности C3b.В совокупности многочисленные исследования мутантов, связанных с аГУС (Ferreira et al., 2009; Lehtinen et al., 2009; Schmidt et al., 2008a), по-видимому, позволяют предположить, что дефект связывания (отрицательный или положительный) с любым из его известных лиганды распознавания клеток (C3b/C3d, полианионы) могут приводить к дефекту связывания комбинации этих лигандов на клеточной поверхности. Следовательно, мутации, связанные с aHUS, могут нарушать сложную взаимосвязь между сродством фактора H к обоим лигандам, необходимым для распознавания клеток.
Дополнительные факторы могут играть роль в восприимчивости к аГУС, в том числе то, что мутации могут мешать третьему функциональному сайту в CCP 19–20, возможно, отличному от тех, которые участвуют в связывании C3b или полианиона. Например, мутация может повлиять на область, участвующую в формировании предполагаемых димеров или тетрамеров (Nan et al., 2008; Okemefuna et al., 2008; Okemefuna et al., 2009a; Pangburn et al., 2009), что может быть важным для связывания/функции фактора H на клеточной поверхности.Аутоантитела к фактору H также были идентифицированы у пациентов с аГУС, и их специфичность была картирована на С-конце в области, которая считается горячей точкой для связанных с аГУС мутаций (Skerka et al., 2009; Strobel et al., 2010), который является той же областью, которая необходима для функций распознавания фактора H.
ARMD является основной причиной слепоты у пожилых людей (Klein et al., 2004) и, по-видимому, является еще одним примером заболевания, вызванного неадекватно контролируемой активацией каскада комплемента, хотя точные молекулярные механизмы еще предстоит определить.ARMD тесно связан с вариантом одной аминокислоты в и седьмом (Y402H) доменах фактора H, в то время как присутствие Ile62 в факторе H CCP1 связано с более низким риском ARMD и болезни плотных отложений (Edwards et al., 2005; Hageman et al., 2005; Haines et al., 2005; Klein et al., 2005). Было показано, что рекомбинантные фрагменты фактора H, включающие полиморфизм Y402H, имеют нарушенную способность взаимодействовать с различными лигандами, включая гепарин, С-реактивный белок и фибромодулин (Clark et al., 2006; Герберт и др., 2007 г.; Лайне и др., 2007 г.; Шоберг и др., 2007 г.; Skerka et al., 2007), демонстрируя повышенное связывание с ДНК и некротическими клетками (Sjoberg et al., 2007). Было показано, что вариант FHL-1 Y402H обладает пониженной активностью кофактора на поверхности клеток CHO (Skerka et al., 2007). Кроме того, фактор H, очищенный от особей, гомозиготных по вариантам Ile62 или Val62 и идентичных по всем остальным аминокислотным остаткам, показал, что защитный вариант (Ile62) проявляет повышенное связывание с C3b и является более эффективным кофактором для фактора I по сравнению с . вариант, связанный с ARMD (Tortajada et al., 2009).
Болезнь плотных отложений (мембранопролиферативный гломерулонефрит II типа) сопровождается массивной активацией комплемента по альтернативному пути за счет неконтролируемой активации жидкой фазы и неадекватно контролируемой поверхностной активации. Это может привести к полной недостаточности органов (Pickering and Cook, 2008; Pickering et al., 2002). В линии свиней с дефицитом фактора H гомозиготные особи умирают вскоре после рождения от комплемент-опосредованной острой почечной недостаточности (Hogasen et al., 1995), а у мышей с дефицитом фактора H спонтанно развивается мембранопролиферативный гломерулонефрит (Pickering et al., 2002).
Как упоминалось выше, мутации и полиморфизмы фактора H связаны с заболеваниями, поражающими различные ткани (например, почки, глаза). Точно так же появляется все больше доказательств того, что каждый сайт связывания полианиона на факторе H имеет уникальную специфичность. Например, было показано, что домен 7 демонстрирует профиль распознавания полианионов, отличный от профиля CCP 19-20 (Ormsby et al., 2006). Таким образом, вероятно, что фактор H проявляет специфическое распознавание клеточного типа в зависимости от массива полианионов, которые конкретная клетка экспрессирует на своей поверхности.
Интересно, что определенные клеточные стрессовые состояния могут приводить к подавлению экспрессии фактора H, например, гипоксия (Okroj et al., 2009) и стресс, вызванный сульфатом металла (Pogue et al., 2009). Снижение экспрессии фактора H, наблюдаемое в нервных клетках из-за последнего, может привести к неадекватной защите фактором H, способствуя воспалительным реакциям, наблюдаемым при нейродегенеративных заболеваниях, таких как болезнь Альцгеймера (Pogue et al., 2009).
Терапевтические стратегии, основанные на ингибировании комплемента, должны способствовать уменьшению опосредованного комплементом повреждения клеток и тканей из-за неадекватной защиты фактором Н.Недавно экулизумаб (моноклональное антитело против C5 от Alexion), первый одобренный ингибитор комплемента для лечения ПНГ человека, был протестирован с положительными результатами у пациентов с аГУС (Davin et al., 2009; De et al., 2010) и был рекомендован при болезни плотных отложений (Smith et al., 2007). Дополнительные стратегии ингибирования комплемента, такие как использование компстатина, пептида, который связывается с C3 и ингибирует все три пути комплемента (Sahu et al., 1996), были рассмотрены в другом месте (Qu et al., 2009). Для заболеваний, вызванных неадекватной защитой фактора H на клеточных поверхностях, могут оказаться многообещающими более целенаправленные стратегии, такие как использование химерного белка fH-CR2, описанного в предыдущем разделе.
хорошие, плохие и неадекватные
3.1. Нормальное распознавание клеток фактором Н
Ген фактора Н расположен в кластере генов регуляторов активации комплемента (RCA) на хромосоме 1 человека (Rodriguez de et al., 1985; Vik et al., 1990). Ripoche et al (1988) вывели аминокислотную последовательность из 3 перекрывающихся клонов кДНК.В дополнение к белку фактора Н массой 150 кДа в плазме человека был идентифицирован второй генный продукт, молекула, подобная фактору Н массой 43 кДа (FHL-1) (Schwaeble et al., 1987). Существует также ряд молекул, связанных с фактором H (FHR), рассмотренных в другом месте (Skerka and Zipfel, 2008), которые обладают гомологией с фактором H и FHL-1, хотя они не транскрибируются с гена фактора H. Общим структурным мотивом генов в кластере RCA является единица белка контроля комплемента (CCP) (также известная как короткий консенсусный повтор или SCR), высококонсервативная единица длиной около 60 аминокислот с спейсерами от трех до восьми аминокислот. между доменами (Klickstein et al., 1987). Фактор H состоит из 20 гомологичных CCP-доменов (Kristensen and Tack, 1986; Ripoche et al., 1988), которые в электронном микроскопе придают фактору H вид гибких «бусинок на нитке», способных сворачиваться обратно (рис. Аслам и Перкинс, 2001 г.; Discipio, 1992 г.; Перкинс и др., 1991 г.; Сим и Перкинс, 1989 г.). Фактическая конформация фактора H может зависеть от ионной силы и рН его локального микроокружения (Okemefuna et al., 2009b).
Структурно-функциональный анализ определил, что сайт связывания C3b, расположенный в N-концевых четырех доменах CCP, обладает активностью, ускоряющей распад, и кофакторной активностью (Alsenz et al., 1984; Гордон и др., 1995; Кюн и др., 1995; Кун и Зипфель, 1996; Pangburn и др., 1977). Два дополнительных сайта связывания C3b были сопоставлены с различными областями в CCP 7–15 и CCP 19–20 (Jokiranta et al., 1996; Jokiranta et al., 2000; Schmidt et al., 2008b; Sharma and Pangburn, 1996). ). Сайт на CCP 19-20 взаимодействует с C3b, iC3b и C3d (Gordon et al., 1995; Jokiranta et al., 2000; Pangburn et al., 2004) ().
Функциональные домены фактора H и основные области, в которых мутации, полиморфизмы или аутоантитела связаны с заболеванием.Фактор H состоит из 20 единиц CCP. Сплошные линии указывают области фактора H, которые выполняют критические функции, такие как контроль активации комплемента, связывание с C3b, распознавание клеток-хозяев или имеют полиморфизмы, связанные с заболеванием (ARMD), мутации (aHUS) или которые распознаются аутоантителами (aHUS). ) связанные с болезнью. Пунктирные линии указывают области, в которых сайты или функции связывания, о которых сообщалось, остаются неопределенными.
Фактор H имеет по крайней мере три сайта связывания гепарина и других полианионов, расположенных в области CCP 7, CCP 20 и в области CCP 9–15 (Blackmore et al., 1996; Блэкмор и др., 1998b; Джокиранта и др., 2000; Ормсби и др., 2006 г.; Pangburn и др., 1991; Продингер и др., 1998 г.; Sharma and Pangburn, 1996), хотя последние данные ставят под сомнение существование последнего участка (Schmidt et al., 2008b). Также было показано, что С-концевой участок связывает сиаловые кислоты (Blackmore and Gordon, 1996; Ram et al., 1998b). Важно отметить, что сайты связывания C3b и полианионов в CCP 19–20 являются ключевыми для взаимодействия фактора H с поверхностями хозяина (Ferreira et al., 2006; Jokiranta et al., 2000; Джокиранта и др., 2005 г.; Джози и др., 2007 г.; Пангберн, 2002 г.; Пикеринг и др., 2007 г.; Рам и др., 1998b). Таким образом, было показано, что рекомбинантная форма этих C-концевых CCP (rh29–20) конкурирует с полноразмерным фактором H за связывание с C3b и полианионами хозяина (Ferreira et al., 2006; Ferreira and Pangburn, 2007), что приводит к в повышенной активации комплемента на поверхности хозяина in vitro (Ferreira et al., 2006). Полноразмерный фактор H и изолированный rh29-20 связываются в 7 раз лучше с клетками, несущими C3b и полианионы, чем с клетками, несущими C3b, но лишенными полианионов (Ferreira et al., 2006). Максимальная разница в 10 раз для этого эффекта была зарегистрирована для полноразмерного фактора H (Meri and Pangburn, 1990; Pangburn and Muller-Eberhard, 1978). Кроме того, исследования, анализирующие функции делеционных мутантов фактора H (Pangburn et al., 2000), показали, что делеция пяти С-концевых доменов вызывает 50-кратное снижение связывания с C3b-покрытыми клетками, несущими полианионы. Точно так же трансгенная мышь, лишенная четырех С-концевых доменов фактора Н, теряет способность эффективно защищать почечные ткани от атаки комплемента (Pickering et al., 2007). Кроме того, в этих исследованиях было показано, что отсутствие С-концевых доменов, по-видимому, не влияет на способность фактора Н контролировать комплемент в жидкой фазе плазмы (Ferreira et al., 2006; Pickering et al., 2007). . Взятые вместе, эти наблюдения позволяют предположить, что два С-концевых домена могут отвечать за большую часть способностей распознавания/дискриминации фактора H клеткой-хозяином. –20 доменов фактора H взаимодействуют с C3b и полианионами на поверхности клетки.Хотя существуют расхождения в точном расположении С-концевых C3b и полианионных сайтов, исследования структуры/функции действительно согласны с тем, что оба сайта связывания действительно перекрываются, но все же различны (Ferreira et al., 2009; Lehtinen et al., 2009). Связывание С-конца фактора Н с клеткой, по-видимому, зависит от оптимальной комбинации аффинностей как для C3b, так и для полианионных лигандов на неактивирующей поверхности. Таким образом, определенные мутации в CCP 20, которые не изменяют общую структуру домена, но фактически увеличивают их способность связывать полианион (гепарин) и/или C3b при отдельном измерении, в значительной степени снижают способность С-конца связывать комбинации обоих маркеров на клеточной поверхности (Ferreira et al., 2009).
В дополнение к сложности того, как фактор H взаимодействует с маркерами хозяина на клеточной поверхности, было показано, что фактор H самоассоциируется в димеры и тетрамеры в присутствии полианионных молекул, и эта самоассоциация, индуцированная полианионами, опосредована, по крайней мере, частично, путем образования комплекса от С-конца к С-концу, в частности, через ССР 18-20 (Pangburn et al., 2009). Это согласуется со структурой тетрамера, наблюдаемой в кристаллах доменов CCP 19–20 (Jokiranta et al., 2005), и слабой самоассоциацией, наблюдаемой с CCP 16–20 (Nan et al., 2008; Okemefuna et al., 2008), предполагая, что С-концевой домен фактора H может формировать контактную точку для образования тетрамера. Кроме того, недавно было показано, что C-конец фактора H образует мультимерные комплексы с C3d, состоящие из димеров каждой молекулы (Okemefuna et al., 2009b). Следовательно, взаимодействие с поверхностными маркерами (полианионами) и C3b/C3d может индуцировать образование определенных кластеров фактора H, которые будут защищать обширные области поверхности благодаря гибкости и вытянутой форме фактора H (12).
Модель, иллюстрирующая сборку тетрамера, специфичного для клетки-хозяина. Клетки и ткани человека обладают связанными с поверхностью полианионными структурами (красная структура ), включая гепаран, другие гликозаминогликаны и сиаловые кислоты, многие из которых, как известно, взаимодействуют с фактором Н ( синий ). Взаимодействия могут индуцировать самосборку ( левая панель ) в С-концевой области фактора H и приводить к более высокой плотности фактора H на поверхности клеток-хозяев, что инактивирует C3b ( желтая структура ) через N- терминальная область фактора Н.Микробы и другие частицы, как правило, лишены таких полианионов (, правая панель, ), и эти поверхности не будут тетрамеризовать фактор Н, что приведет к снижению контроля над альтернативным путем комплемента. В результате ожидается, что активация альтернативного пути и амплификация C3b будут происходить с минимальным контролем над микробами (, правая панель, ), в то время как амплификация будет ингибироваться у хозяина (, левая панель, ). Мультимерные взаимодействия между C-концевой областью фактора H и C3b/C3d, которые также могут способствовать сборке димера/тетрамера, в этой модели не показаны.
Дополнительным способом, которым фактор H участвует в нормальном распознавании клеток-хозяев, является связывание с клеточными маркерами, которые экспонируются на клетках, подвергающихся апоптозу (запрограммированная гибель клеток). Идентифицированные на сегодняшний день клеточные маркеры, которые перемещаются на поверхности апоптотических клеток и могут распознаваться фактором H, представляют собой ДНК и аннексин II (Leffler et al., 2010). ДНК была впервые идентифицирована как содержащая два основных связывающих белка, фактор H и фактор B, более 30 лет назад, когда человеческая сыворотка была фракционирована с помощью аффинной хроматографии на ДНК-целлюлозе (Gardner et al., 1980). Аннексин II, обильный белок, связывающий фосфолипиды, который присутствует в цитозоле и на цитоплазматической поверхности плазматической мембраны и ранних эндосомах (Moss, 1992), первоначально был предложен в качестве возможного лиганда для фактора Н, который экспрессируется в постишемической почке. (Коулман и др., 2010). Кроме того, сообщалось, что растворимые белки острой фазы, С-реактивный белок (Mold et al., 1999; Okemefuna et al., 2010) и пентраксин 3 (Deban et al., 2008) обладают способностью связываться с апоптотическими клетками. и рекрутировать фактор H на эту клеточную поверхность (Deban et al., 2008; Гершов и др., 2000). Хотя предполагается, что взаимодействие между фактором H и CRP является артефактом из-за взаимодействия между денатурированным CRP и фактором H (Hakobyan et al., 2008), дополнительные недавние исследования сообщают о его достоверности (Okemefuna et al., 2010). Эти белки острой фазы, по-видимому, служат растворимыми молекулами, которые помогают фактору Н в нормальном распознавании умирающих клеток-хозяев. Известно, что умирающие клетки активируют комплемент для достижения надлежащей опсонизации для эффективного удаления, и связывание фактора Н может иметь важное значение для ограничения чрезмерной активации комплемента во время этого процесса (Trouw et al., 2008). Связывание фактора H с маркерами хозяина на умирающих клетках может также способствовать ограничению активации комплемента, так что она не будет продолжаться дальше отложения C3b. Таким образом, не допуская полного разрушения клеток, можно было бы избежать высвобождения опасных аутоантигенов.
Сообщалось, что некоторые клетки-хозяева (нейтрофилы, В-лимфоциты, моноциты и тромбоциты) экспрессируют на своей поверхности рецепторы фактора Н, включая рецептор комплемента 3 (CR3; CD11b/CD18; интегрин αMβ2), другие интегрины (αvβ3, αIIbβ3 ) и L-селектин (Ault, 2000; Discipio et al., 1998; Малхотра и др., 1999; Мнджоян и др., 2008). Эти взаимодействия, по-видимому, опосредуют функции, дополнительные к тем, которые участвуют в распознавании хозяином и регуляции комплемента (включая клеточную адгезию и индукцию цитокинов) и выходят за рамки этого обзора.
Важно отметить, что нормальный фактор H, распознавая маркеры клеток-хозяев, не только контролирует комплемент при нормальном гомеостазе, но также играет важную роль, ограничивая опосредованное комплементом повреждение больных клеток и тканей.Например, нормальный фактор Н (если экспрессируется на нормальных уровнях) может играть важную роль в защите клеток и тканей, подвергающихся патологическим процессам, в патогенезе которых участвует повреждение, опосредованное альтернативным путем. Примеры таких заболеваний рассмотрены в другом месте (Holers, 2008). Одной из причин опосредованного альтернативным путем повреждения собственных тканей является нарушение надлежащей регуляции комплемента. Пример того, как нормальный фактор Н может частично компенсировать этот сбой в контроле комплемента, проиллюстрирован на модели ПНГ (пароксизмальная ночная гемоглобинурия).ПНГ представляет собой приобретенное заболевание стволовых клеток, которое приводит к незначительному синтезу гликозилфосфатидилинозитола (ГФИ) или его полному отсутствию, что приводит к частичному или полному дефициту GPI-связанных мембранных белков, включая фактор, ускоряющий распад регуляторных молекул комплемента (DAF; CD55) и CD59 (Luzzatto). , 2006; Россе, 2001). Потеря этих регуляторов комплемента на эритроцитах хозяина приводит к комплемент-опосредованной патологии при заболевании. Продолжительность жизни in vivo нормальных эритроцитов человека составляет от 60 до 120 дней, однако аномальные клетки ПНГ лизируются за 6-60 дней (Navenot et al., 1998; Rosse, 1971) из-за низкого уровня активации комплемента на их поверхности (Luzzatto, 2006; Navenot et al., 1998; Rosse, 2001). Эти клетки не лизируются за более короткий период времени (т.е. минуты) благодаря защите клеточной поверхности, обеспечиваемой фактором Н (Ferreira and Pangburn, 2007).
Фактор H вносит вклад в нормальную регуляторную избыточность на поверхности клеток-хозяев, и было показано, что он важен для других сценариев заболевания, таких как экспериментальный аутоиммунный энцефаломиелит (Griffiths et al., 2009), атеросклероз (Haskard et al., 2008), инсулинорезистентность (Moreno-Navarrete et al., 2010), IgA-нефропатия (Zhang et al., 2009) и цисплатиновая нефропатия (Fuke et al., 2009). В соответствии с важной ролью фактора H в защите тканей хозяина успешное использование химерной молекулы фактора H-CR2 (fH-CR2) в качестве целевого терапевтического агента для ингибирования комплемента в зависимых от альтернативного пути мышиных моделях антител к коллагену индуцированный артрит (Banda et al., 2009), ишемически-реперфузионное повреждение кишечника (Huang et al., 2008) и хориоидальной неоваскуляризации (Rohrer et al., 2009). Фактор H-CR2 также способен уменьшать индуцированное окислительным стрессом комплемент-опосредованное повреждение клеток пигментного эпителия сетчатки in vitro (Rohrer et al., 2009; Thurman et al., 2009). Этот ингибитор использует домен CR2 для нацеливания на сайты начального отложения iC3b/C3d и пять амино-концевых SCR фактора H, которые кодируют регуляторный домен молекулы.
3.2. Неадекватное распознавание клеток фактором H
Клинические данные указывают на то, что аллели и мутации, влияющие на домены распознавания клетки-хозяина в факторе H, приводят к патологии, связанной с активацией комплемента, о чем свидетельствует наследственный атипичный гемолитико-уремический синдром (aHUS) (de Cordoba and de Jorge, 2008; Holers, 2008), возрастная дегенерация желтого пятна (ARMD) (Holers, 2008) и болезнь плотных отложений (мембранопролиферативный гломерулонефрит II типа) (Pickering and Cook, 2008; de Cordoba and de Jorge, 2008).Атипичный гемолитико-уремический синдром представляет собой заболевание, характеризующееся гемолитической анемией, тромбоцитопенией и острой почечной недостаточностью (Kavanagh et al., 2008). Изучение генетики аГУС привлекло внимание к С-концевым доменам фактора Н, несущим C3d и сайты связывания сиаловой кислоты/полианиона (Bettinaglio et al., 2001; Buddles et al., 2000; Dragon-Durey et al., 2004). ; Heinen et al., 2006; Manuelian et al., 2003; Pichette et al., 1994; Richards et al., 2001; Rodriguez de Cordoba et al., 2004; Warwicker et al., 1998; Ин и др., 1999; Зипфель и др., 1999). Более того, возрастная дегенерация желтого пятна предполагает, что аналогичная роль может быть у сайта связывания полианионов в CCP 7 (Edwards et al., 2005; Hageman et al., 2005; Haines et al., 2005; Klein et al., 2005). ). Связь мутаций и полиморфизмов фактора H с заболеванием внесла значительный вклад в выяснение того, какие области фактора H важны для распознавания хозяином, как описано в предыдущем разделе.
Анализ мутаций показал, что большинство мутаций, связанных с аГУС, сосредоточены на С-конце или опосредованно затрагивают С-конец, особенно домен 20, фактора комплемента Н (Bettinaglio et al., 2001; Герберт и др., 2006 г.; Джокиранта и др., 2006 г.; Перес-Кабальеро и др., 2001; Перкинс и Гудшип, 2002 г.; Ричардс и др., 2001). Было показано, что молекулы, несущие эти мутации в домене 20, обладают дефектной способностью связывать либо C3b, либо полианионы, либо и то, и другое (Ferreira et al., 2009; Kavanagh et al., 2006; Lehtinen et al., 2009; Schmidt et al. ., 2008a), или, что удивительно, в некоторых случаях иметь повышенное сродство к C3b, как к C3b, так и к полианионам (Ferreira et al., 2009) или только к полианионам (Lehtinen et al., 2009). В одном исследовании (Ferreira et al., 2009) сродство к C3b, измеренное Biacore, хорошо коррелировало со связыванием с зимозаном, покрытым C3b (в котором отсутствуют полианионы). Тем не менее, сродство к C3b и гепарину (при раздельном измерении) не всегда коррелировало с силой связывания с богатыми полианионами поверхностями эритроцитов человека и овцы, на которых был отложен C3b; они также не коррелировали с фенотипом риска заболевания. Другие (Lehtinen et al., 2009) наблюдали корреляцию между способностью некоторых мутантов aHUS связываться с повышенной аффинностью к гепарину и TNF-активированным мышиным гломерулярным эндотелиальным клеткам при сохранении нормальной аффинности C3b.В совокупности многочисленные исследования мутантов, связанных с аГУС (Ferreira et al., 2009; Lehtinen et al., 2009; Schmidt et al., 2008a), по-видимому, позволяют предположить, что дефект связывания (отрицательный или положительный) с любым из его известных лиганды распознавания клеток (C3b/C3d, полианионы) могут приводить к дефекту связывания комбинации этих лигандов на клеточной поверхности. Следовательно, мутации, связанные с aHUS, могут нарушать сложную взаимосвязь между сродством фактора H к обоим лигандам, необходимым для распознавания клеток.
Дополнительные факторы могут играть роль в восприимчивости к аГУС, в том числе то, что мутации могут мешать третьему функциональному сайту в CCP 19–20, возможно, отличному от тех, которые участвуют в связывании C3b или полианиона. Например, мутация может повлиять на область, участвующую в формировании предполагаемых димеров или тетрамеров (Nan et al., 2008; Okemefuna et al., 2008; Okemefuna et al., 2009a; Pangburn et al., 2009), что может быть важным для связывания/функции фактора H на клеточной поверхности.Аутоантитела к фактору H также были идентифицированы у пациентов с аГУС, и их специфичность была картирована на С-конце в области, которая считается горячей точкой для связанных с аГУС мутаций (Skerka et al., 2009; Strobel et al., 2010), который является той же областью, которая необходима для функций распознавания фактора H.
ARMD является основной причиной слепоты у пожилых людей (Klein et al., 2004) и, по-видимому, является еще одним примером заболевания, вызванного неадекватно контролируемой активацией каскада комплемента, хотя точные молекулярные механизмы еще предстоит определить.ARMD тесно связан с вариантом одной аминокислоты в и седьмом (Y402H) доменах фактора H, в то время как присутствие Ile62 в факторе H CCP1 связано с более низким риском ARMD и болезни плотных отложений (Edwards et al., 2005; Hageman et al., 2005; Haines et al., 2005; Klein et al., 2005). Было показано, что рекомбинантные фрагменты фактора H, включающие полиморфизм Y402H, имеют нарушенную способность взаимодействовать с различными лигандами, включая гепарин, С-реактивный белок и фибромодулин (Clark et al., 2006; Герберт и др., 2007 г.; Лайне и др., 2007 г.; Шоберг и др., 2007 г.; Skerka et al., 2007), демонстрируя повышенное связывание с ДНК и некротическими клетками (Sjoberg et al., 2007). Было показано, что вариант FHL-1 Y402H обладает пониженной активностью кофактора на поверхности клеток CHO (Skerka et al., 2007). Кроме того, фактор H, очищенный от особей, гомозиготных по вариантам Ile62 или Val62 и идентичных по всем остальным аминокислотным остаткам, показал, что защитный вариант (Ile62) проявляет повышенное связывание с C3b и является более эффективным кофактором для фактора I по сравнению с . вариант, связанный с ARMD (Tortajada et al., 2009).
Болезнь плотных отложений (мембранопролиферативный гломерулонефрит II типа) сопровождается массивной активацией комплемента по альтернативному пути за счет неконтролируемой активации жидкой фазы и неадекватно контролируемой поверхностной активации. Это может привести к полной недостаточности органов (Pickering and Cook, 2008; Pickering et al., 2002). В линии свиней с дефицитом фактора H гомозиготные особи умирают вскоре после рождения от комплемент-опосредованной острой почечной недостаточности (Hogasen et al., 1995), а у мышей с дефицитом фактора H спонтанно развивается мембранопролиферативный гломерулонефрит (Pickering et al., 2002).
Как упоминалось выше, мутации и полиморфизмы фактора H связаны с заболеваниями, поражающими различные ткани (например, почки, глаза). Точно так же появляется все больше доказательств того, что каждый сайт связывания полианиона на факторе H имеет уникальную специфичность. Например, было показано, что домен 7 демонстрирует профиль распознавания полианионов, отличный от профиля CCP 19-20 (Ormsby et al., 2006). Таким образом, вероятно, что фактор H проявляет специфическое распознавание клеточного типа в зависимости от массива полианионов, которые конкретная клетка экспрессирует на своей поверхности.
Интересно, что определенные клеточные стрессовые состояния могут приводить к подавлению экспрессии фактора H, например, гипоксия (Okroj et al., 2009) и стресс, вызванный сульфатом металла (Pogue et al., 2009). Снижение экспрессии фактора H, наблюдаемое в нервных клетках из-за последнего, может привести к неадекватной защите фактором H, способствуя воспалительным реакциям, наблюдаемым при нейродегенеративных заболеваниях, таких как болезнь Альцгеймера (Pogue et al., 2009).
Терапевтические стратегии, основанные на ингибировании комплемента, должны способствовать уменьшению опосредованного комплементом повреждения клеток и тканей из-за неадекватной защиты фактором Н.Недавно экулизумаб (моноклональное антитело против C5 от Alexion), первый одобренный ингибитор комплемента для лечения ПНГ человека, был протестирован с положительными результатами у пациентов с аГУС (Davin et al., 2009; De et al., 2010) и был рекомендован при болезни плотных отложений (Smith et al., 2007). Дополнительные стратегии ингибирования комплемента, такие как использование компстатина, пептида, который связывается с C3 и ингибирует все три пути комплемента (Sahu et al., 1996), были рассмотрены в другом месте (Qu et al., 2009). Для заболеваний, вызванных неадекватной защитой фактора H на клеточных поверхностях, могут оказаться многообещающими более целенаправленные стратегии, такие как использование химерного белка fH-CR2, описанного в предыдущем разделе.
хорошие, плохие и неадекватные
3.1. Нормальное распознавание клеток фактором Н
Ген фактора Н расположен в кластере генов регуляторов активации комплемента (RCA) на хромосоме 1 человека (Rodriguez de et al., 1985; Vik et al., 1990). Ripoche et al (1988) вывели аминокислотную последовательность из 3 перекрывающихся клонов кДНК.В дополнение к белку фактора Н массой 150 кДа в плазме человека был идентифицирован второй генный продукт, молекула, подобная фактору Н массой 43 кДа (FHL-1) (Schwaeble et al., 1987). Существует также ряд молекул, связанных с фактором H (FHR), рассмотренных в другом месте (Skerka and Zipfel, 2008), которые обладают гомологией с фактором H и FHL-1, хотя они не транскрибируются с гена фактора H. Общим структурным мотивом генов в кластере RCA является единица белка контроля комплемента (CCP) (также известная как короткий консенсусный повтор или SCR), высококонсервативная единица длиной около 60 аминокислот с спейсерами от трех до восьми аминокислот. между доменами (Klickstein et al., 1987). Фактор H состоит из 20 гомологичных CCP-доменов (Kristensen and Tack, 1986; Ripoche et al., 1988), которые в электронном микроскопе придают фактору H вид гибких «бусинок на нитке», способных сворачиваться обратно (рис. Аслам и Перкинс, 2001 г.; Discipio, 1992 г.; Перкинс и др., 1991 г.; Сим и Перкинс, 1989 г.). Фактическая конформация фактора H может зависеть от ионной силы и рН его локального микроокружения (Okemefuna et al., 2009b).
Структурно-функциональный анализ определил, что сайт связывания C3b, расположенный в N-концевых четырех доменах CCP, обладает активностью, ускоряющей распад, и кофакторной активностью (Alsenz et al., 1984; Гордон и др., 1995; Кюн и др., 1995; Кун и Зипфель, 1996; Pangburn и др., 1977). Два дополнительных сайта связывания C3b были сопоставлены с различными областями в CCP 7–15 и CCP 19–20 (Jokiranta et al., 1996; Jokiranta et al., 2000; Schmidt et al., 2008b; Sharma and Pangburn, 1996). ). Сайт на CCP 19-20 взаимодействует с C3b, iC3b и C3d (Gordon et al., 1995; Jokiranta et al., 2000; Pangburn et al., 2004) ().
Функциональные домены фактора H и основные области, в которых мутации, полиморфизмы или аутоантитела связаны с заболеванием.Фактор H состоит из 20 единиц CCP. Сплошные линии указывают области фактора H, которые выполняют критические функции, такие как контроль активации комплемента, связывание с C3b, распознавание клеток-хозяев или имеют полиморфизмы, связанные с заболеванием (ARMD), мутации (aHUS) или которые распознаются аутоантителами (aHUS). ) связанные с болезнью. Пунктирные линии указывают области, в которых сайты или функции связывания, о которых сообщалось, остаются неопределенными.
Фактор H имеет по крайней мере три сайта связывания гепарина и других полианионов, расположенных в области CCP 7, CCP 20 и в области CCP 9–15 (Blackmore et al., 1996; Блэкмор и др., 1998b; Джокиранта и др., 2000; Ормсби и др., 2006 г.; Pangburn и др., 1991; Продингер и др., 1998 г.; Sharma and Pangburn, 1996), хотя последние данные ставят под сомнение существование последнего участка (Schmidt et al., 2008b). Также было показано, что С-концевой участок связывает сиаловые кислоты (Blackmore and Gordon, 1996; Ram et al., 1998b). Важно отметить, что сайты связывания C3b и полианионов в CCP 19–20 являются ключевыми для взаимодействия фактора H с поверхностями хозяина (Ferreira et al., 2006; Jokiranta et al., 2000; Джокиранта и др., 2005 г.; Джози и др., 2007 г.; Пангберн, 2002 г.; Пикеринг и др., 2007 г.; Рам и др., 1998b). Таким образом, было показано, что рекомбинантная форма этих C-концевых CCP (rh29–20) конкурирует с полноразмерным фактором H за связывание с C3b и полианионами хозяина (Ferreira et al., 2006; Ferreira and Pangburn, 2007), что приводит к в повышенной активации комплемента на поверхности хозяина in vitro (Ferreira et al., 2006). Полноразмерный фактор H и изолированный rh29-20 связываются в 7 раз лучше с клетками, несущими C3b и полианионы, чем с клетками, несущими C3b, но лишенными полианионов (Ferreira et al., 2006). Максимальная разница в 10 раз для этого эффекта была зарегистрирована для полноразмерного фактора H (Meri and Pangburn, 1990; Pangburn and Muller-Eberhard, 1978). Кроме того, исследования, анализирующие функции делеционных мутантов фактора H (Pangburn et al., 2000), показали, что делеция пяти С-концевых доменов вызывает 50-кратное снижение связывания с C3b-покрытыми клетками, несущими полианионы. Точно так же трансгенная мышь, лишенная четырех С-концевых доменов фактора Н, теряет способность эффективно защищать почечные ткани от атаки комплемента (Pickering et al., 2007). Кроме того, в этих исследованиях было показано, что отсутствие С-концевых доменов, по-видимому, не влияет на способность фактора Н контролировать комплемент в жидкой фазе плазмы (Ferreira et al., 2006; Pickering et al., 2007). . Взятые вместе, эти наблюдения позволяют предположить, что два С-концевых домена могут отвечать за большую часть способностей распознавания/дискриминации фактора H клеткой-хозяином. –20 доменов фактора H взаимодействуют с C3b и полианионами на поверхности клетки.Хотя существуют расхождения в точном расположении С-концевых C3b и полианионных сайтов, исследования структуры/функции действительно согласны с тем, что оба сайта связывания действительно перекрываются, но все же различны (Ferreira et al., 2009; Lehtinen et al., 2009). Связывание С-конца фактора Н с клеткой, по-видимому, зависит от оптимальной комбинации аффинностей как для C3b, так и для полианионных лигандов на неактивирующей поверхности. Таким образом, определенные мутации в CCP 20, которые не изменяют общую структуру домена, но фактически увеличивают их способность связывать полианион (гепарин) и/или C3b при отдельном измерении, в значительной степени снижают способность С-конца связывать комбинации обоих маркеров на клеточной поверхности (Ferreira et al., 2009).
В дополнение к сложности того, как фактор H взаимодействует с маркерами хозяина на клеточной поверхности, было показано, что фактор H самоассоциируется в димеры и тетрамеры в присутствии полианионных молекул, и эта самоассоциация, индуцированная полианионами, опосредована, по крайней мере, частично, путем образования комплекса от С-конца к С-концу, в частности, через ССР 18-20 (Pangburn et al., 2009). Это согласуется со структурой тетрамера, наблюдаемой в кристаллах доменов CCP 19–20 (Jokiranta et al., 2005), и слабой самоассоциацией, наблюдаемой с CCP 16–20 (Nan et al., 2008; Okemefuna et al., 2008), предполагая, что С-концевой домен фактора H может формировать контактную точку для образования тетрамера. Кроме того, недавно было показано, что C-конец фактора H образует мультимерные комплексы с C3d, состоящие из димеров каждой молекулы (Okemefuna et al., 2009b). Следовательно, взаимодействие с поверхностными маркерами (полианионами) и C3b/C3d может индуцировать образование определенных кластеров фактора H, которые будут защищать обширные области поверхности благодаря гибкости и вытянутой форме фактора H (12).
Модель, иллюстрирующая сборку тетрамера, специфичного для клетки-хозяина. Клетки и ткани человека обладают связанными с поверхностью полианионными структурами (красная структура ), включая гепаран, другие гликозаминогликаны и сиаловые кислоты, многие из которых, как известно, взаимодействуют с фактором Н ( синий ). Взаимодействия могут индуцировать самосборку ( левая панель ) в С-концевой области фактора H и приводить к более высокой плотности фактора H на поверхности клеток-хозяев, что инактивирует C3b ( желтая структура ) через N- терминальная область фактора Н.Микробы и другие частицы, как правило, лишены таких полианионов (, правая панель, ), и эти поверхности не будут тетрамеризовать фактор Н, что приведет к снижению контроля над альтернативным путем комплемента. В результате ожидается, что активация альтернативного пути и амплификация C3b будут происходить с минимальным контролем над микробами (, правая панель, ), в то время как амплификация будет ингибироваться у хозяина (, левая панель, ). Мультимерные взаимодействия между C-концевой областью фактора H и C3b/C3d, которые также могут способствовать сборке димера/тетрамера, в этой модели не показаны.
Дополнительным способом, которым фактор H участвует в нормальном распознавании клеток-хозяев, является связывание с клеточными маркерами, которые экспонируются на клетках, подвергающихся апоптозу (запрограммированная гибель клеток). Идентифицированные на сегодняшний день клеточные маркеры, которые перемещаются на поверхности апоптотических клеток и могут распознаваться фактором H, представляют собой ДНК и аннексин II (Leffler et al., 2010). ДНК была впервые идентифицирована как содержащая два основных связывающих белка, фактор H и фактор B, более 30 лет назад, когда человеческая сыворотка была фракционирована с помощью аффинной хроматографии на ДНК-целлюлозе (Gardner et al., 1980). Аннексин II, обильный белок, связывающий фосфолипиды, который присутствует в цитозоле и на цитоплазматической поверхности плазматической мембраны и ранних эндосомах (Moss, 1992), первоначально был предложен в качестве возможного лиганда для фактора Н, который экспрессируется в постишемической почке. (Коулман и др., 2010). Кроме того, сообщалось, что растворимые белки острой фазы, С-реактивный белок (Mold et al., 1999; Okemefuna et al., 2010) и пентраксин 3 (Deban et al., 2008) обладают способностью связываться с апоптотическими клетками. и рекрутировать фактор H на эту клеточную поверхность (Deban et al., 2008; Гершов и др., 2000). Хотя предполагается, что взаимодействие между фактором H и CRP является артефактом из-за взаимодействия между денатурированным CRP и фактором H (Hakobyan et al., 2008), дополнительные недавние исследования сообщают о его достоверности (Okemefuna et al., 2010). Эти белки острой фазы, по-видимому, служат растворимыми молекулами, которые помогают фактору Н в нормальном распознавании умирающих клеток-хозяев. Известно, что умирающие клетки активируют комплемент для достижения надлежащей опсонизации для эффективного удаления, и связывание фактора Н может иметь важное значение для ограничения чрезмерной активации комплемента во время этого процесса (Trouw et al., 2008). Связывание фактора H с маркерами хозяина на умирающих клетках может также способствовать ограничению активации комплемента, так что она не будет продолжаться дальше отложения C3b. Таким образом, не допуская полного разрушения клеток, можно было бы избежать высвобождения опасных аутоантигенов.
Сообщалось, что некоторые клетки-хозяева (нейтрофилы, В-лимфоциты, моноциты и тромбоциты) экспрессируют на своей поверхности рецепторы фактора Н, включая рецептор комплемента 3 (CR3; CD11b/CD18; интегрин αMβ2), другие интегрины (αvβ3, αIIbβ3 ) и L-селектин (Ault, 2000; Discipio et al., 1998; Малхотра и др., 1999; Мнджоян и др., 2008). Эти взаимодействия, по-видимому, опосредуют функции, дополнительные к тем, которые участвуют в распознавании хозяином и регуляции комплемента (включая клеточную адгезию и индукцию цитокинов) и выходят за рамки этого обзора.
Важно отметить, что нормальный фактор H, распознавая маркеры клеток-хозяев, не только контролирует комплемент при нормальном гомеостазе, но также играет важную роль, ограничивая опосредованное комплементом повреждение больных клеток и тканей.Например, нормальный фактор Н (если экспрессируется на нормальных уровнях) может играть важную роль в защите клеток и тканей, подвергающихся патологическим процессам, в патогенезе которых участвует повреждение, опосредованное альтернативным путем. Примеры таких заболеваний рассмотрены в другом месте (Holers, 2008). Одной из причин опосредованного альтернативным путем повреждения собственных тканей является нарушение надлежащей регуляции комплемента. Пример того, как нормальный фактор Н может частично компенсировать этот сбой в контроле комплемента, проиллюстрирован на модели ПНГ (пароксизмальная ночная гемоглобинурия).ПНГ представляет собой приобретенное заболевание стволовых клеток, которое приводит к незначительному синтезу гликозилфосфатидилинозитола (ГФИ) или его полному отсутствию, что приводит к частичному или полному дефициту GPI-связанных мембранных белков, включая фактор, ускоряющий распад регуляторных молекул комплемента (DAF; CD55) и CD59 (Luzzatto). , 2006; Россе, 2001). Потеря этих регуляторов комплемента на эритроцитах хозяина приводит к комплемент-опосредованной патологии при заболевании. Продолжительность жизни in vivo нормальных эритроцитов человека составляет от 60 до 120 дней, однако аномальные клетки ПНГ лизируются за 6-60 дней (Navenot et al., 1998; Rosse, 1971) из-за низкого уровня активации комплемента на их поверхности (Luzzatto, 2006; Navenot et al., 1998; Rosse, 2001). Эти клетки не лизируются за более короткий период времени (т.е. минуты) благодаря защите клеточной поверхности, обеспечиваемой фактором Н (Ferreira and Pangburn, 2007).
Фактор H вносит вклад в нормальную регуляторную избыточность на поверхности клеток-хозяев, и было показано, что он важен для других сценариев заболевания, таких как экспериментальный аутоиммунный энцефаломиелит (Griffiths et al., 2009), атеросклероз (Haskard et al., 2008), инсулинорезистентность (Moreno-Navarrete et al., 2010), IgA-нефропатия (Zhang et al., 2009) и цисплатиновая нефропатия (Fuke et al., 2009). В соответствии с важной ролью фактора H в защите тканей хозяина успешное использование химерной молекулы фактора H-CR2 (fH-CR2) в качестве целевого терапевтического агента для ингибирования комплемента в зависимых от альтернативного пути мышиных моделях антител к коллагену индуцированный артрит (Banda et al., 2009), ишемически-реперфузионное повреждение кишечника (Huang et al., 2008) и хориоидальной неоваскуляризации (Rohrer et al., 2009). Фактор H-CR2 также способен уменьшать индуцированное окислительным стрессом комплемент-опосредованное повреждение клеток пигментного эпителия сетчатки in vitro (Rohrer et al., 2009; Thurman et al., 2009). Этот ингибитор использует домен CR2 для нацеливания на сайты начального отложения iC3b/C3d и пять амино-концевых SCR фактора H, которые кодируют регуляторный домен молекулы.
3.2. Неадекватное распознавание клеток фактором H
Клинические данные указывают на то, что аллели и мутации, влияющие на домены распознавания клетки-хозяина в факторе H, приводят к патологии, связанной с активацией комплемента, о чем свидетельствует наследственный атипичный гемолитико-уремический синдром (aHUS) (de Cordoba and de Jorge, 2008; Holers, 2008), возрастная дегенерация желтого пятна (ARMD) (Holers, 2008) и болезнь плотных отложений (мембранопролиферативный гломерулонефрит II типа) (Pickering and Cook, 2008; de Cordoba and de Jorge, 2008).Атипичный гемолитико-уремический синдром представляет собой заболевание, характеризующееся гемолитической анемией, тромбоцитопенией и острой почечной недостаточностью (Kavanagh et al., 2008). Изучение генетики аГУС привлекло внимание к С-концевым доменам фактора Н, несущим C3d и сайты связывания сиаловой кислоты/полианиона (Bettinaglio et al., 2001; Buddles et al., 2000; Dragon-Durey et al., 2004). ; Heinen et al., 2006; Manuelian et al., 2003; Pichette et al., 1994; Richards et al., 2001; Rodriguez de Cordoba et al., 2004; Warwicker et al., 1998; Ин и др., 1999; Зипфель и др., 1999). Более того, возрастная дегенерация желтого пятна предполагает, что аналогичная роль может быть у сайта связывания полианионов в CCP 7 (Edwards et al., 2005; Hageman et al., 2005; Haines et al., 2005; Klein et al., 2005). ). Связь мутаций и полиморфизмов фактора H с заболеванием внесла значительный вклад в выяснение того, какие области фактора H важны для распознавания хозяином, как описано в предыдущем разделе.
Анализ мутаций показал, что большинство мутаций, связанных с аГУС, сосредоточены на С-конце или опосредованно затрагивают С-конец, особенно домен 20, фактора комплемента Н (Bettinaglio et al., 2001; Герберт и др., 2006 г.; Джокиранта и др., 2006 г.; Перес-Кабальеро и др., 2001; Перкинс и Гудшип, 2002 г.; Ричардс и др., 2001). Было показано, что молекулы, несущие эти мутации в домене 20, обладают дефектной способностью связывать либо C3b, либо полианионы, либо и то, и другое (Ferreira et al., 2009; Kavanagh et al., 2006; Lehtinen et al., 2009; Schmidt et al. ., 2008a), или, что удивительно, в некоторых случаях иметь повышенное сродство к C3b, как к C3b, так и к полианионам (Ferreira et al., 2009) или только к полианионам (Lehtinen et al., 2009). В одном исследовании (Ferreira et al., 2009) сродство к C3b, измеренное Biacore, хорошо коррелировало со связыванием с зимозаном, покрытым C3b (в котором отсутствуют полианионы). Тем не менее, сродство к C3b и гепарину (при раздельном измерении) не всегда коррелировало с силой связывания с богатыми полианионами поверхностями эритроцитов человека и овцы, на которых был отложен C3b; они также не коррелировали с фенотипом риска заболевания. Другие (Lehtinen et al., 2009) наблюдали корреляцию между способностью некоторых мутантов aHUS связываться с повышенной аффинностью к гепарину и TNF-активированным мышиным гломерулярным эндотелиальным клеткам при сохранении нормальной аффинности C3b.В совокупности многочисленные исследования мутантов, связанных с аГУС (Ferreira et al., 2009; Lehtinen et al., 2009; Schmidt et al., 2008a), по-видимому, позволяют предположить, что дефект связывания (отрицательный или положительный) с любым из его известных лиганды распознавания клеток (C3b/C3d, полианионы) могут приводить к дефекту связывания комбинации этих лигандов на клеточной поверхности. Следовательно, мутации, связанные с aHUS, могут нарушать сложную взаимосвязь между сродством фактора H к обоим лигандам, необходимым для распознавания клеток.
Дополнительные факторы могут играть роль в восприимчивости к аГУС, в том числе то, что мутации могут мешать третьему функциональному сайту в CCP 19–20, возможно, отличному от тех, которые участвуют в связывании C3b или полианиона. Например, мутация может повлиять на область, участвующую в формировании предполагаемых димеров или тетрамеров (Nan et al., 2008; Okemefuna et al., 2008; Okemefuna et al., 2009a; Pangburn et al., 2009), что может быть важным для связывания/функции фактора H на клеточной поверхности.Аутоантитела к фактору H также были идентифицированы у пациентов с аГУС, и их специфичность была картирована на С-конце в области, которая считается горячей точкой для связанных с аГУС мутаций (Skerka et al., 2009; Strobel et al., 2010), который является той же областью, которая необходима для функций распознавания фактора H.
ARMD является основной причиной слепоты у пожилых людей (Klein et al., 2004) и, по-видимому, является еще одним примером заболевания, вызванного неадекватно контролируемой активацией каскада комплемента, хотя точные молекулярные механизмы еще предстоит определить.ARMD тесно связан с вариантом одной аминокислоты в и седьмом (Y402H) доменах фактора H, в то время как присутствие Ile62 в факторе H CCP1 связано с более низким риском ARMD и болезни плотных отложений (Edwards et al., 2005; Hageman et al., 2005; Haines et al., 2005; Klein et al., 2005). Было показано, что рекомбинантные фрагменты фактора H, включающие полиморфизм Y402H, имеют нарушенную способность взаимодействовать с различными лигандами, включая гепарин, С-реактивный белок и фибромодулин (Clark et al., 2006; Герберт и др., 2007 г.; Лайне и др., 2007 г.; Шоберг и др., 2007 г.; Skerka et al., 2007), демонстрируя повышенное связывание с ДНК и некротическими клетками (Sjoberg et al., 2007). Было показано, что вариант FHL-1 Y402H обладает пониженной активностью кофактора на поверхности клеток CHO (Skerka et al., 2007). Кроме того, фактор H, очищенный от особей, гомозиготных по вариантам Ile62 или Val62 и идентичных по всем остальным аминокислотным остаткам, показал, что защитный вариант (Ile62) проявляет повышенное связывание с C3b и является более эффективным кофактором для фактора I по сравнению с . вариант, связанный с ARMD (Tortajada et al., 2009).
Болезнь плотных отложений (мембранопролиферативный гломерулонефрит II типа) сопровождается массивной активацией комплемента по альтернативному пути за счет неконтролируемой активации жидкой фазы и неадекватно контролируемой поверхностной активации. Это может привести к полной недостаточности органов (Pickering and Cook, 2008; Pickering et al., 2002). В линии свиней с дефицитом фактора H гомозиготные особи умирают вскоре после рождения от комплемент-опосредованной острой почечной недостаточности (Hogasen et al., 1995), а у мышей с дефицитом фактора H спонтанно развивается мембранопролиферативный гломерулонефрит (Pickering et al., 2002).
Как упоминалось выше, мутации и полиморфизмы фактора H связаны с заболеваниями, поражающими различные ткани (например, почки, глаза). Точно так же появляется все больше доказательств того, что каждый сайт связывания полианиона на факторе H имеет уникальную специфичность. Например, было показано, что домен 7 демонстрирует профиль распознавания полианионов, отличный от профиля CCP 19-20 (Ormsby et al., 2006). Таким образом, вероятно, что фактор H проявляет специфическое распознавание клеточного типа в зависимости от массива полианионов, которые конкретная клетка экспрессирует на своей поверхности.
Интересно, что определенные клеточные стрессовые состояния могут приводить к подавлению экспрессии фактора H, например, гипоксия (Okroj et al., 2009) и стресс, вызванный сульфатом металла (Pogue et al., 2009). Снижение экспрессии фактора H, наблюдаемое в нервных клетках из-за последнего, может привести к неадекватной защите фактором H, способствуя воспалительным реакциям, наблюдаемым при нейродегенеративных заболеваниях, таких как болезнь Альцгеймера (Pogue et al., 2009).
Терапевтические стратегии, основанные на ингибировании комплемента, должны способствовать уменьшению опосредованного комплементом повреждения клеток и тканей из-за неадекватной защиты фактором Н.Недавно экулизумаб (моноклональное антитело против C5 от Alexion), первый одобренный ингибитор комплемента для лечения ПНГ человека, был протестирован с положительными результатами у пациентов с аГУС (Davin et al., 2009; De et al., 2010) и был рекомендован при болезни плотных отложений (Smith et al., 2007). Дополнительные стратегии ингибирования комплемента, такие как использование компстатина, пептида, который связывается с C3 и ингибирует все три пути комплемента (Sahu et al., 1996), были рассмотрены в другом месте (Qu et al., 2009). Для заболеваний, вызванных неадекватной защитой фактора H на клеточных поверхностях, могут оказаться многообещающими более целенаправленные стратегии, такие как использование химерного белка fH-CR2, описанного в предыдущем разделе.
хорошие, плохие и неадекватные
3.1. Нормальное распознавание клеток фактором Н
Ген фактора Н расположен в кластере генов регуляторов активации комплемента (RCA) на хромосоме 1 человека (Rodriguez de et al., 1985; Vik et al., 1990). Ripoche et al (1988) вывели аминокислотную последовательность из 3 перекрывающихся клонов кДНК.В дополнение к белку фактора Н массой 150 кДа в плазме человека был идентифицирован второй генный продукт, молекула, подобная фактору Н массой 43 кДа (FHL-1) (Schwaeble et al., 1987). Существует также ряд молекул, связанных с фактором H (FHR), рассмотренных в другом месте (Skerka and Zipfel, 2008), которые обладают гомологией с фактором H и FHL-1, хотя они не транскрибируются с гена фактора H. Общим структурным мотивом генов в кластере RCA является единица белка контроля комплемента (CCP) (также известная как короткий консенсусный повтор или SCR), высококонсервативная единица длиной около 60 аминокислот с спейсерами от трех до восьми аминокислот. между доменами (Klickstein et al., 1987). Фактор H состоит из 20 гомологичных CCP-доменов (Kristensen and Tack, 1986; Ripoche et al., 1988), которые в электронном микроскопе придают фактору H вид гибких «бусинок на нитке», способных сворачиваться обратно (рис. Аслам и Перкинс, 2001 г.; Discipio, 1992 г.; Перкинс и др., 1991 г.; Сим и Перкинс, 1989 г.). Фактическая конформация фактора H может зависеть от ионной силы и рН его локального микроокружения (Okemefuna et al., 2009b).
Структурно-функциональный анализ определил, что сайт связывания C3b, расположенный в N-концевых четырех доменах CCP, обладает активностью, ускоряющей распад, и кофакторной активностью (Alsenz et al., 1984; Гордон и др., 1995; Кюн и др., 1995; Кун и Зипфель, 1996; Pangburn и др., 1977). Два дополнительных сайта связывания C3b были сопоставлены с различными областями в CCP 7–15 и CCP 19–20 (Jokiranta et al., 1996; Jokiranta et al., 2000; Schmidt et al., 2008b; Sharma and Pangburn, 1996). ). Сайт на CCP 19-20 взаимодействует с C3b, iC3b и C3d (Gordon et al., 1995; Jokiranta et al., 2000; Pangburn et al., 2004) ().
Функциональные домены фактора H и основные области, в которых мутации, полиморфизмы или аутоантитела связаны с заболеванием.Фактор H состоит из 20 единиц CCP. Сплошные линии указывают области фактора H, которые выполняют критические функции, такие как контроль активации комплемента, связывание с C3b, распознавание клеток-хозяев или имеют полиморфизмы, связанные с заболеванием (ARMD), мутации (aHUS) или которые распознаются аутоантителами (aHUS). ) связанные с болезнью. Пунктирные линии указывают области, в которых сайты или функции связывания, о которых сообщалось, остаются неопределенными.
Фактор H имеет по крайней мере три сайта связывания гепарина и других полианионов, расположенных в области CCP 7, CCP 20 и в области CCP 9–15 (Blackmore et al., 1996; Блэкмор и др., 1998b; Джокиранта и др., 2000; Ормсби и др., 2006 г.; Pangburn и др., 1991; Продингер и др., 1998 г.; Sharma and Pangburn, 1996), хотя последние данные ставят под сомнение существование последнего участка (Schmidt et al., 2008b). Также было показано, что С-концевой участок связывает сиаловые кислоты (Blackmore and Gordon, 1996; Ram et al., 1998b). Важно отметить, что сайты связывания C3b и полианионов в CCP 19–20 являются ключевыми для взаимодействия фактора H с поверхностями хозяина (Ferreira et al., 2006; Jokiranta et al., 2000; Джокиранта и др., 2005 г.; Джози и др., 2007 г.; Пангберн, 2002 г.; Пикеринг и др., 2007 г.; Рам и др., 1998b). Таким образом, было показано, что рекомбинантная форма этих C-концевых CCP (rh29–20) конкурирует с полноразмерным фактором H за связывание с C3b и полианионами хозяина (Ferreira et al., 2006; Ferreira and Pangburn, 2007), что приводит к в повышенной активации комплемента на поверхности хозяина in vitro (Ferreira et al., 2006). Полноразмерный фактор H и изолированный rh29-20 связываются в 7 раз лучше с клетками, несущими C3b и полианионы, чем с клетками, несущими C3b, но лишенными полианионов (Ferreira et al., 2006). Максимальная разница в 10 раз для этого эффекта была зарегистрирована для полноразмерного фактора H (Meri and Pangburn, 1990; Pangburn and Muller-Eberhard, 1978). Кроме того, исследования, анализирующие функции делеционных мутантов фактора H (Pangburn et al., 2000), показали, что делеция пяти С-концевых доменов вызывает 50-кратное снижение связывания с C3b-покрытыми клетками, несущими полианионы. Точно так же трансгенная мышь, лишенная четырех С-концевых доменов фактора Н, теряет способность эффективно защищать почечные ткани от атаки комплемента (Pickering et al., 2007). Кроме того, в этих исследованиях было показано, что отсутствие С-концевых доменов, по-видимому, не влияет на способность фактора Н контролировать комплемент в жидкой фазе плазмы (Ferreira et al., 2006; Pickering et al., 2007). . Взятые вместе, эти наблюдения позволяют предположить, что два С-концевых домена могут отвечать за большую часть способностей распознавания/дискриминации фактора H клеткой-хозяином. –20 доменов фактора H взаимодействуют с C3b и полианионами на поверхности клетки.Хотя существуют расхождения в точном расположении С-концевых C3b и полианионных сайтов, исследования структуры/функции действительно согласны с тем, что оба сайта связывания действительно перекрываются, но все же различны (Ferreira et al., 2009; Lehtinen et al., 2009). Связывание С-конца фактора Н с клеткой, по-видимому, зависит от оптимальной комбинации аффинностей как для C3b, так и для полианионных лигандов на неактивирующей поверхности. Таким образом, определенные мутации в CCP 20, которые не изменяют общую структуру домена, но фактически увеличивают их способность связывать полианион (гепарин) и/или C3b при отдельном измерении, в значительной степени снижают способность С-конца связывать комбинации обоих маркеров на клеточной поверхности (Ferreira et al., 2009).
В дополнение к сложности того, как фактор H взаимодействует с маркерами хозяина на клеточной поверхности, было показано, что фактор H самоассоциируется в димеры и тетрамеры в присутствии полианионных молекул, и эта самоассоциация, индуцированная полианионами, опосредована, по крайней мере, частично, путем образования комплекса от С-конца к С-концу, в частности, через ССР 18-20 (Pangburn et al., 2009). Это согласуется со структурой тетрамера, наблюдаемой в кристаллах доменов CCP 19–20 (Jokiranta et al., 2005), и слабой самоассоциацией, наблюдаемой с CCP 16–20 (Nan et al., 2008; Okemefuna et al., 2008), предполагая, что С-концевой домен фактора H может формировать контактную точку для образования тетрамера. Кроме того, недавно было показано, что C-конец фактора H образует мультимерные комплексы с C3d, состоящие из димеров каждой молекулы (Okemefuna et al., 2009b). Следовательно, взаимодействие с поверхностными маркерами (полианионами) и C3b/C3d может индуцировать образование определенных кластеров фактора H, которые будут защищать обширные области поверхности благодаря гибкости и вытянутой форме фактора H (12).
Модель, иллюстрирующая сборку тетрамера, специфичного для клетки-хозяина. Клетки и ткани человека обладают связанными с поверхностью полианионными структурами (красная структура ), включая гепаран, другие гликозаминогликаны и сиаловые кислоты, многие из которых, как известно, взаимодействуют с фактором Н ( синий ). Взаимодействия могут индуцировать самосборку ( левая панель ) в С-концевой области фактора H и приводить к более высокой плотности фактора H на поверхности клеток-хозяев, что инактивирует C3b ( желтая структура ) через N- терминальная область фактора Н.Микробы и другие частицы, как правило, лишены таких полианионов (, правая панель, ), и эти поверхности не будут тетрамеризовать фактор Н, что приведет к снижению контроля над альтернативным путем комплемента. В результате ожидается, что активация альтернативного пути и амплификация C3b будут происходить с минимальным контролем над микробами (, правая панель, ), в то время как амплификация будет ингибироваться у хозяина (, левая панель, ). Мультимерные взаимодействия между C-концевой областью фактора H и C3b/C3d, которые также могут способствовать сборке димера/тетрамера, в этой модели не показаны.
Дополнительным способом, которым фактор H участвует в нормальном распознавании клеток-хозяев, является связывание с клеточными маркерами, которые экспонируются на клетках, подвергающихся апоптозу (запрограммированная гибель клеток). Идентифицированные на сегодняшний день клеточные маркеры, которые перемещаются на поверхности апоптотических клеток и могут распознаваться фактором H, представляют собой ДНК и аннексин II (Leffler et al., 2010). ДНК была впервые идентифицирована как содержащая два основных связывающих белка, фактор H и фактор B, более 30 лет назад, когда человеческая сыворотка была фракционирована с помощью аффинной хроматографии на ДНК-целлюлозе (Gardner et al., 1980). Аннексин II, обильный белок, связывающий фосфолипиды, который присутствует в цитозоле и на цитоплазматической поверхности плазматической мембраны и ранних эндосомах (Moss, 1992), первоначально был предложен в качестве возможного лиганда для фактора Н, который экспрессируется в постишемической почке. (Коулман и др., 2010). Кроме того, сообщалось, что растворимые белки острой фазы, С-реактивный белок (Mold et al., 1999; Okemefuna et al., 2010) и пентраксин 3 (Deban et al., 2008) обладают способностью связываться с апоптотическими клетками. и рекрутировать фактор H на эту клеточную поверхность (Deban et al., 2008; Гершов и др., 2000). Хотя предполагается, что взаимодействие между фактором H и CRP является артефактом из-за взаимодействия между денатурированным CRP и фактором H (Hakobyan et al., 2008), дополнительные недавние исследования сообщают о его достоверности (Okemefuna et al., 2010). Эти белки острой фазы, по-видимому, служат растворимыми молекулами, которые помогают фактору Н в нормальном распознавании умирающих клеток-хозяев. Известно, что умирающие клетки активируют комплемент для достижения надлежащей опсонизации для эффективного удаления, и связывание фактора Н может иметь важное значение для ограничения чрезмерной активации комплемента во время этого процесса (Trouw et al., 2008). Связывание фактора H с маркерами хозяина на умирающих клетках может также способствовать ограничению активации комплемента, так что она не будет продолжаться дальше отложения C3b. Таким образом, не допуская полного разрушения клеток, можно было бы избежать высвобождения опасных аутоантигенов.
Сообщалось, что некоторые клетки-хозяева (нейтрофилы, В-лимфоциты, моноциты и тромбоциты) экспрессируют на своей поверхности рецепторы фактора Н, включая рецептор комплемента 3 (CR3; CD11b/CD18; интегрин αMβ2), другие интегрины (αvβ3, αIIbβ3 ) и L-селектин (Ault, 2000; Discipio et al., 1998; Малхотра и др., 1999; Мнджоян и др., 2008). Эти взаимодействия, по-видимому, опосредуют функции, дополнительные к тем, которые участвуют в распознавании хозяином и регуляции комплемента (включая клеточную адгезию и индукцию цитокинов) и выходят за рамки этого обзора.
Важно отметить, что нормальный фактор H, распознавая маркеры клеток-хозяев, не только контролирует комплемент при нормальном гомеостазе, но также играет важную роль, ограничивая опосредованное комплементом повреждение больных клеток и тканей.Например, нормальный фактор Н (если экспрессируется на нормальных уровнях) может играть важную роль в защите клеток и тканей, подвергающихся патологическим процессам, в патогенезе которых участвует повреждение, опосредованное альтернативным путем. Примеры таких заболеваний рассмотрены в другом месте (Holers, 2008). Одной из причин опосредованного альтернативным путем повреждения собственных тканей является нарушение надлежащей регуляции комплемента. Пример того, как нормальный фактор Н может частично компенсировать этот сбой в контроле комплемента, проиллюстрирован на модели ПНГ (пароксизмальная ночная гемоглобинурия).ПНГ представляет собой приобретенное заболевание стволовых клеток, которое приводит к незначительному синтезу гликозилфосфатидилинозитола (ГФИ) или его полному отсутствию, что приводит к частичному или полному дефициту GPI-связанных мембранных белков, включая фактор, ускоряющий распад регуляторных молекул комплемента (DAF; CD55) и CD59 (Luzzatto). , 2006; Россе, 2001). Потеря этих регуляторов комплемента на эритроцитах хозяина приводит к комплемент-опосредованной патологии при заболевании. Продолжительность жизни in vivo нормальных эритроцитов человека составляет от 60 до 120 дней, однако аномальные клетки ПНГ лизируются за 6-60 дней (Navenot et al., 1998; Rosse, 1971) из-за низкого уровня активации комплемента на их поверхности (Luzzatto, 2006; Navenot et al., 1998; Rosse, 2001). Эти клетки не лизируются за более короткий период времени (т.е. минуты) благодаря защите клеточной поверхности, обеспечиваемой фактором Н (Ferreira and Pangburn, 2007).
Фактор H вносит вклад в нормальную регуляторную избыточность на поверхности клеток-хозяев, и было показано, что он важен для других сценариев заболевания, таких как экспериментальный аутоиммунный энцефаломиелит (Griffiths et al., 2009), атеросклероз (Haskard et al., 2008), инсулинорезистентность (Moreno-Navarrete et al., 2010), IgA-нефропатия (Zhang et al., 2009) и цисплатиновая нефропатия (Fuke et al., 2009). В соответствии с важной ролью фактора H в защите тканей хозяина успешное использование химерной молекулы фактора H-CR2 (fH-CR2) в качестве целевого терапевтического агента для ингибирования комплемента в зависимых от альтернативного пути мышиных моделях антител к коллагену индуцированный артрит (Banda et al., 2009), ишемически-реперфузионное повреждение кишечника (Huang et al., 2008) и хориоидальной неоваскуляризации (Rohrer et al., 2009). Фактор H-CR2 также способен уменьшать индуцированное окислительным стрессом комплемент-опосредованное повреждение клеток пигментного эпителия сетчатки in vitro (Rohrer et al., 2009; Thurman et al., 2009). Этот ингибитор использует домен CR2 для нацеливания на сайты начального отложения iC3b/C3d и пять амино-концевых SCR фактора H, которые кодируют регуляторный домен молекулы.
3.2. Неадекватное распознавание клеток фактором H
Клинические данные указывают на то, что аллели и мутации, влияющие на домены распознавания клетки-хозяина в факторе H, приводят к патологии, связанной с активацией комплемента, о чем свидетельствует наследственный атипичный гемолитико-уремический синдром (aHUS) (de Cordoba and de Jorge, 2008; Holers, 2008), возрастная дегенерация желтого пятна (ARMD) (Holers, 2008) и болезнь плотных отложений (мембранопролиферативный гломерулонефрит II типа) (Pickering and Cook, 2008; de Cordoba and de Jorge, 2008).Атипичный гемолитико-уремический синдром представляет собой заболевание, характеризующееся гемолитической анемией, тромбоцитопенией и острой почечной недостаточностью (Kavanagh et al., 2008). Изучение генетики аГУС привлекло внимание к С-концевым доменам фактора Н, несущим C3d и сайты связывания сиаловой кислоты/полианиона (Bettinaglio et al., 2001; Buddles et al., 2000; Dragon-Durey et al., 2004). ; Heinen et al., 2006; Manuelian et al., 2003; Pichette et al., 1994; Richards et al., 2001; Rodriguez de Cordoba et al., 2004; Warwicker et al., 1998; Ин и др., 1999; Зипфель и др., 1999). Более того, возрастная дегенерация желтого пятна предполагает, что аналогичная роль может быть у сайта связывания полианионов в CCP 7 (Edwards et al., 2005; Hageman et al., 2005; Haines et al., 2005; Klein et al., 2005). ). Связь мутаций и полиморфизмов фактора H с заболеванием внесла значительный вклад в выяснение того, какие области фактора H важны для распознавания хозяином, как описано в предыдущем разделе.
Анализ мутаций показал, что большинство мутаций, связанных с аГУС, сосредоточены на С-конце или опосредованно затрагивают С-конец, особенно домен 20, фактора комплемента Н (Bettinaglio et al., 2001; Герберт и др., 2006 г.; Джокиранта и др., 2006 г.; Перес-Кабальеро и др., 2001; Перкинс и Гудшип, 2002 г.; Ричардс и др., 2001). Было показано, что молекулы, несущие эти мутации в домене 20, обладают дефектной способностью связывать либо C3b, либо полианионы, либо и то, и другое (Ferreira et al., 2009; Kavanagh et al., 2006; Lehtinen et al., 2009; Schmidt et al. ., 2008a), или, что удивительно, в некоторых случаях иметь повышенное сродство к C3b, как к C3b, так и к полианионам (Ferreira et al., 2009) или только к полианионам (Lehtinen et al., 2009). В одном исследовании (Ferreira et al., 2009) сродство к C3b, измеренное Biacore, хорошо коррелировало со связыванием с зимозаном, покрытым C3b (в котором отсутствуют полианионы). Тем не менее, сродство к C3b и гепарину (при раздельном измерении) не всегда коррелировало с силой связывания с богатыми полианионами поверхностями эритроцитов человека и овцы, на которых был отложен C3b; они также не коррелировали с фенотипом риска заболевания. Другие (Lehtinen et al., 2009) наблюдали корреляцию между способностью некоторых мутантов aHUS связываться с повышенной аффинностью к гепарину и TNF-активированным мышиным гломерулярным эндотелиальным клеткам при сохранении нормальной аффинности C3b.В совокупности многочисленные исследования мутантов, связанных с аГУС (Ferreira et al., 2009; Lehtinen et al., 2009; Schmidt et al., 2008a), по-видимому, позволяют предположить, что дефект связывания (отрицательный или положительный) с любым из его известных лиганды распознавания клеток (C3b/C3d, полианионы) могут приводить к дефекту связывания комбинации этих лигандов на клеточной поверхности. Следовательно, мутации, связанные с aHUS, могут нарушать сложную взаимосвязь между сродством фактора H к обоим лигандам, необходимым для распознавания клеток.
Дополнительные факторы могут играть роль в восприимчивости к аГУС, в том числе то, что мутации могут мешать третьему функциональному сайту в CCP 19–20, возможно, отличному от тех, которые участвуют в связывании C3b или полианиона. Например, мутация может повлиять на область, участвующую в формировании предполагаемых димеров или тетрамеров (Nan et al., 2008; Okemefuna et al., 2008; Okemefuna et al., 2009a; Pangburn et al., 2009), что может быть важным для связывания/функции фактора H на клеточной поверхности.Аутоантитела к фактору H также были идентифицированы у пациентов с аГУС, и их специфичность была картирована на С-конце в области, которая считается горячей точкой для связанных с аГУС мутаций (Skerka et al., 2009; Strobel et al., 2010), который является той же областью, которая необходима для функций распознавания фактора H.
ARMD является основной причиной слепоты у пожилых людей (Klein et al., 2004) и, по-видимому, является еще одним примером заболевания, вызванного неадекватно контролируемой активацией каскада комплемента, хотя точные молекулярные механизмы еще предстоит определить.ARMD тесно связан с вариантом одной аминокислоты в и седьмом (Y402H) доменах фактора H, в то время как присутствие Ile62 в факторе H CCP1 связано с более низким риском ARMD и болезни плотных отложений (Edwards et al., 2005; Hageman et al., 2005; Haines et al., 2005; Klein et al., 2005). Было показано, что рекомбинантные фрагменты фактора H, включающие полиморфизм Y402H, имеют нарушенную способность взаимодействовать с различными лигандами, включая гепарин, С-реактивный белок и фибромодулин (Clark et al., 2006; Герберт и др., 2007 г.; Лайне и др., 2007 г.; Шоберг и др., 2007 г.; Skerka et al., 2007), демонстрируя повышенное связывание с ДНК и некротическими клетками (Sjoberg et al., 2007). Было показано, что вариант FHL-1 Y402H обладает пониженной активностью кофактора на поверхности клеток CHO (Skerka et al., 2007). Кроме того, фактор H, очищенный от особей, гомозиготных по вариантам Ile62 или Val62 и идентичных по всем остальным аминокислотным остаткам, показал, что защитный вариант (Ile62) проявляет повышенное связывание с C3b и является более эффективным кофактором для фактора I по сравнению с . вариант, связанный с ARMD (Tortajada et al., 2009).
Болезнь плотных отложений (мембранопролиферативный гломерулонефрит II типа) сопровождается массивной активацией комплемента по альтернативному пути за счет неконтролируемой активации жидкой фазы и неадекватно контролируемой поверхностной активации. Это может привести к полной недостаточности органов (Pickering and Cook, 2008; Pickering et al., 2002). В линии свиней с дефицитом фактора H гомозиготные особи умирают вскоре после рождения от комплемент-опосредованной острой почечной недостаточности (Hogasen et al., 1995), а у мышей с дефицитом фактора H спонтанно развивается мембранопролиферативный гломерулонефрит (Pickering et al., 2002).
Как упоминалось выше, мутации и полиморфизмы фактора H связаны с заболеваниями, поражающими различные ткани (например, почки, глаза). Точно так же появляется все больше доказательств того, что каждый сайт связывания полианиона на факторе H имеет уникальную специфичность. Например, было показано, что домен 7 демонстрирует профиль распознавания полианионов, отличный от профиля CCP 19-20 (Ormsby et al., 2006). Таким образом, вероятно, что фактор H проявляет специфическое распознавание клеточного типа в зависимости от массива полианионов, которые конкретная клетка экспрессирует на своей поверхности.
Интересно, что определенные клеточные стрессовые состояния могут приводить к подавлению экспрессии фактора H, например, гипоксия (Okroj et al., 2009) и стресс, вызванный сульфатом металла (Pogue et al., 2009). Снижение экспрессии фактора H, наблюдаемое в нервных клетках из-за последнего, может привести к неадекватной защите фактором H, способствуя воспалительным реакциям, наблюдаемым при нейродегенеративных заболеваниях, таких как болезнь Альцгеймера (Pogue et al.
